分泌表达量提高的葡萄糖淀粉酶突变体M5及其基因和应用
分泌表达量提高的葡萄糖淀粉酶突变体m5及其基因和应用
技术领域
1.本发明涉及基因工程领域,具体涉及分泌表达量提高的葡萄糖淀粉酶突变体m5及其基因和应用。
背景技术:
2.葡萄糖淀粉酶是糖苷水解酶(glycoside hydrolase)的一种,作用于α
‑ꢀ
1,4 糖苷键的外切酶,其系统名称为α
‑
1,4
‑
葡聚糖葡萄糖苷水解酶(α
‑
1,4
‑
glucan glucohydrolase, ec.3.2.1.3)或γ
‑
淀粉酶(γ
‑
amylase),简称糖化酶。葡萄糖淀粉酶从非还原糖末端切下葡萄糖分子,且底物专一性较低,即能够切断α
‑
1,4
‑
糖苷键,对α
‑
1,6
‑
糖苷键和α
‑
1,3
‑
糖苷键也有轻微的水解能力。葡萄糖淀粉酶由催化域、连接域及淀粉结构域组成。根据这3个结构域的位置关系,真菌糖化酶属于糖苷水解酶的第15家族,以别于第13家族的α—淀粉酶及第14族的β—淀粉酶。
3.葡萄糖淀粉酶是工业上用量最大的生物酶制剂之一,被广泛地应用于食品、医药和发酵等工业,是我国产量和用量最大的生物酶产品之一,具有很高的商业价值。
4.中国专利申请cn202010131741.9公开了葡萄糖淀粉酶突变体ga2,对从talaromyces leycettanusjcm12802菌株中得到了的糖化酶tlga1931进行突变,经q108e/s132c/y492c/s548c/a562c定点突变得到突变体ga2,70℃处理10min后野生型相对剩余酶活为14%,接近失活,葡萄糖淀粉酶突变体ga2的剩余酶活约为90%,75℃处理2min后野生型相对剩余酶活为13%,接近失活,葡萄糖淀粉酶突变体ga2的剩余酶活为95%。葡萄糖淀粉酶突变体ga2的最适温度由70℃提高至75℃。
5.葡萄糖淀粉酶中的淀粉结合域(starch
‑
binding domain. sbd)上有2个结合位点可同时结合2分子的底物,其中碳水化合物结构域(cbm)的分类较多,来源广泛,也就造成了其序列与结构上的多样性。这使得碳水化合物结构域在促进酶与底物结合、底物特异识别等方面都有不同的作用,其本身的特性也被证实会对整个蛋白产生相应影响,比如稳定性和耐热性以及活性,但是目前未曾有报道淀粉结构域与葡萄糖淀粉酶分泌量密切相关。
技术实现要素:
6.为了进一步优化葡萄糖淀粉酶tlga1931的酶学特性,提出并完成了本发明。
7.本发明的目的是提供分泌表达量提高的葡萄糖淀粉酶突变体。
8.本发明的再一目的是提供上述葡萄糖淀粉酶突变体的编码基因。
9.本发明的再一目的是提供包含上述葡萄糖淀粉酶突变体编码基因的重组载体。
10.本发明的再一目的是提供包含上述葡萄糖淀粉酶突变体编码基因的重组菌株。
11.本发明的再一目的是提供一种制备分泌表达量提高的葡萄糖淀粉酶的方法。
12.本发明的再一目的是提供上述葡萄糖淀粉酶突变体的应用。
13.中国专利申请cn202010131741.9公开了葡萄糖淀粉酶突变体ga2,对从talaromyces leycettanusjcm12802菌株中得到了的糖化酶tlga1931进行突变,经q108e/
s132c/y492c/s548c/a562c定点突变后,得到比活及热稳定性提高的葡萄糖淀粉酶突变体ga2,本发明对葡萄糖淀粉酶突变体ga2再进一步进行突变,得到分泌表达量提高的萄糖淀粉酶突变体,其中,将葡萄糖淀粉酶突变体ga2的第599位、600、603位氨基酸进行点突变得到葡萄糖淀粉酶突变体m3,将葡萄糖淀粉酶突变体ga2的第589位、607位、608位、609位、613位氨基酸进行点突变,得到葡萄糖淀粉酶突变体m5,同时突变上述位点的组合得到葡萄糖淀粉酶突变体m8,野生型糖化酶tlga1931的氨基酸序列如seq id no:1所示。
14.葡萄糖淀粉酶突变体ga2的氨基酸序列如seq id no:2所示。
15.根据本发明的具体实施方式,将葡萄糖淀粉酶突变体ga2的第599位氨基酸由gln突变为ala、第600位氨基酸由gly突变为tyr、第603位氨基酸由val突变为gln,得到葡萄糖淀粉酶突变体m3。将葡萄糖淀粉酶突变体ga2的第589位氨基酸由ser突变为asp、第607位氨基酸由thr突变为ile、第608位氨基酸由val突变为leu、第609位氨基酸由asn突变为asp、第613位氨基酸由arg突变为gln,得到葡萄糖淀粉酶突变体m5。将葡萄糖淀粉酶突变体ga2的第589位氨基酸由ser突变为asp、第599位氨基酸由gln突变为ala,第600位氨基酸由gly突变为tyr,第603位氨基酸由val突变为gln,第607位氨基酸由thr突变为ile、第608位氨基酸由val突变为leu、第609位氨基酸由asn突变为asp,第613位氨基酸由arg突变为gln,得到葡萄糖淀粉酶突变体m8。
16.根据本发明的具体实施方式,葡萄糖淀粉酶tlga1931的突变体m3的氨基酸序列seq id no:3所示。
17.根据本发明的具体实施方式,葡萄糖淀粉酶tlga1931的突变体m5的氨基酸序列seq id no:4所示。
18.根据本发明的具体实施方式,葡萄糖淀粉酶tlga1931的突变体m8的氨基酸序列seq id no:5所示。
19.本发明提供了编码上述葡萄糖淀粉酶tlga1931突变体m5的基因。
20.根据本发明的具体实施方式,葡萄糖淀粉酶突变体ga2的基因序列如seq id no:6所示。
21.根据本发明的具体实施方式,葡萄糖淀粉酶突变体m3的编码基因序列如seq id no:7所示。
22.根据本发明的具体实施方式,葡萄糖淀粉酶突变体m5的编码基因序列如seq id no:8所示。
23.根据本发明的具体实施方式,葡萄糖淀粉酶突变体m8的编码基因序列如seq id no:9所示。
24.根据本发明的提高葡萄糖淀粉酶的分泌表达量的方法包括以下步骤:将葡萄糖淀粉酶突变体ga2的第589位氨基酸由ser突变为asp、第607位氨基酸由thr突变为ile、第608位氨基酸由val突变为leu、第609位氨基酸由asn突变为asp、第613位氨基酸由arg突变为gln,其中,所述葡萄糖淀粉酶突变体ga2的氨基酸序列如seq id no:2所示。
25.本发明提供了包含上述葡萄糖淀粉酶突变体m5的编码基因的重组载体。
26.本发明还提供了包含上述葡萄糖淀粉酶突变体m5的编码基因的重组菌株,优选的菌株为毕赤酵母gs115,含葡萄糖淀粉酶突变体基因的重组菌株为重组赤酵母gs115/m5。
27.根据本发明的具体实施方式,制备分泌表达量提高的葡萄糖淀粉酶的方法如下所述:(1)用含有葡萄糖淀粉酶突变体m5的编码基因的重组载体转化宿主细胞,得到重组菌株;(2)培养重组菌株,诱导葡萄糖淀粉酶表达;(3)回收并纯化所表达的葡萄糖淀粉酶。
28.本发明的有益效果:本发明对现有葡萄糖淀粉酶的突变体ga2进行突变,葡萄糖淀粉酶突变体m5的比活力及热稳定性基本无损失,葡萄糖淀粉酶突变体m5在毕赤酵母中的可溶性表达水平获得明显提高,突变体m5的表达量较突变体ga2提高4.2倍。因此本发明也首次证明碳水化合物结构域(cbm)不仅与蛋白质的活性、稳定性相关,也对表达量具有较大的影响。突变体m5的可溶性表达水平大幅提升,并且仍可保持较好的催化效率、热稳定性,能够完全满足工业应用需求,可以很好的应用于食品、医药、纺织及饲料行业中,有广阔的应用前景。
附图说明
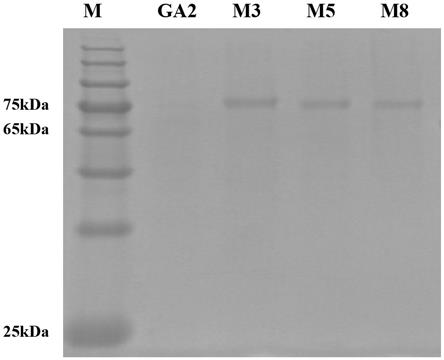
29.图1 显示葡萄糖淀粉酶突变体ga2及突变体m3、m5、m8的表达情况的sds
‑
page分析;图2显示葡萄糖淀粉酶突变体ga2及突变体m3、m5、m8的最适温度曲线;图3显示葡萄糖淀粉酶突变体ga2及突变体m3、m5、m8的比活力;图4 显示葡萄糖淀粉酶突变体ga2及突变体m3、m5、m8转录水平测定。
具体实施方式
30.试验材料和试剂1、菌株及载体:毕赤酵母(pichia pastoris gs115)、毕赤酵母表达载体ppic9及菌株gs115。
31.2、酶类及其它生化试剂:连接酶购自invitrogen公司,定点突变试剂盒购自全式金公司,其它都为国产试剂(均可从普通生化试剂公司购买得到)。
32.3、培养基:(1)大肠杆菌培养基lb (1%蛋白胨、0.5%酵母粉、1% nacl,ph7.o)。
33.(2) bmgy培养基;1%酵母粉,2%蛋白胨,1.34% ynb,0.000049< biotin,1% 甘油(v/v)。
34.(3) bmmy培养基:以0.5%甲醇代替甘油,其余成份均与bmgy相同。
35.说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
36.实施例1葡萄糖淀粉酶的定点突变以包含葡萄糖淀粉酶突变体ga2的编码基因的质粒ppic9
‑
tlga1931
‑
ga2序列为模板,将葡萄糖淀粉酶突变体ga2的氨基酸序列的第599位氨基酸所对应的密码子由caa突变为gcg、第600位氨基酸所对应的密码子由ggg突变为tac、第603位氨基酸的密码子由gtg突
变为cag,得到突变体m3。将葡萄糖淀粉酶突变体ga2的氨基酸序列的第589位氨基酸所对应的密码子由agt突变为gac、第607位氨基酸所对应的密码子由acg突变为att、第608位氨基酸所对应的密码子由gtg突变为ctt、第609位氨基酸所对应的密码子由aat突变为gac、第613位氨基酸所对应的密码子由agg突变为cag,得到突变体m5。将葡萄糖淀粉酶突变体ga2的第589位氨基酸由ser突变为asp、第599位氨基酸由gln突变为ala,第600位氨基酸由gly突变为tyr,第603位氨基酸由val突变为gln,第607位氨基酸由thr突变为ile、第608位氨基酸由val突变为leu、第609位氨基酸由asn突变为asp,第613位氨基酸由arg突变为gln,得到突变体m8。
37.每轮定点突变的引物如下表所示。本技术的突变位点选在cbm域的c端,即在整个葡萄糖淀粉酶的c端,目前没有报道cbm域与该酶的表达量相关。
38.表1定点突变所需的引物
39.实施例2葡萄糖淀粉酶工程菌株的构建(1)表达载体的构建及在酵母的表达以葡萄糖淀粉酶重组质粒ppic9
‑
tlga1931
‑
ga2为模板,利用定点突变试剂扩增突变体。经核酸胶验证后,将pcr产物中加入1μldmt酶,混匀后于37℃孵育1h。取2
‑
5μldmt酶消化的pcr产物,热击转化至感受态细胞dmt。挑取阳性转化子进行dna测序,测序表明序列正确的转化子用于大量制备重组质粒。用限制性内切酶bglii进行线性化表达质粒载体dna,电击转化酵母gs115感受态细胞,30
°
c培养2
‑
3天,挑取在md平板上生长的转化子进行进一步的表达实验,具体操作请参考毕赤酵母表达操作手册。然后通过mm平板的显色反应筛选葡萄糖淀粉酶阳性克隆子菌株为gs115/m3、gs115/m5、gs115/m8。
40.实施例3重组葡萄糖淀粉酶的制备(1)葡萄糖淀粉酶在毕赤酵母中摇瓶水平的大量表达筛选出酶活较高的转化子,接种于300mlbmgy液体培养基的1l三角瓶中,30
°
c,220rpm摇床振荡培养48h;4500rpm离心5min,弃上清,再向菌体加入200ml含有0.5%甲醇的bmmy液体培养基,30
°
c,220rpm诱导培养48h。诱导培养期间,间隔24h补加一次甲醇溶液以补偿甲醇的损失,使甲醇浓度保持在0.5%左右;12,000
×
g离心10min,收集上清发酵液,检测酶活性并进行sds
‑
page蛋白电泳分析。
41.(2)重组葡萄糖淀粉酶的纯化收集摇瓶发酵培养的重组葡萄糖淀粉酶上清液,利用10kda膜包进行发酵液的浓
缩,同时用ph6.310mm磷酸氢二钠
‑
柠檬酸缓冲液置换其中的培养基,然后通过阴离子交换柱来进行纯化并使用sds
‑
page鉴定。如图1所示,在同样上样量为10微升时,突变体ga2无法看到蛋白条带,而突变体m3、m5、m8条带明显。由软件通过蛋白条带粗细分析葡萄糖淀粉酶淀粉突变体m3、m5、m8的表达量较突变体ga2的表达量提高4
‑
5倍。由于突变体m3、m5、m8与突变体ga2比活力同等水平,测定突变体m3、m5、m8酶活(即表达量)较突变体ga2提高4.1倍、4.2倍、4.0倍,与软件分析结果一致。
42.实施例4测定纯化的葡萄糖淀粉酶突变体的酶学性质采用dns法对本发明的葡萄糖淀粉酶进行活性分析。具体方法如下:在各突变体最适ph(ph4.5)和最适温度的条件下,1ml的反应体系包括l00
µ
l适当的稀释酶液,900
µ
l底物,反应30min,加入1.5mldns终止反应,沸水煮5min。冷却后540nm测定od值。葡萄糖淀粉酶活性单位定义:在对应最适温度、最适ph条件下,每分钟内催化水解底物释放出1
µ
mol还原糖所需的酶量为一个酶活单位(u)。
43.测定葡萄糖淀粉酶突变体m3、m5、m8的酶活性和动力学参数:(1)测定葡萄糖淀粉酶m3、m5、m8突变体的最适温度及热稳定性葡萄糖淀粉酶野生型、突变体ga2及突变体m3、m5、m8分别在20、30、40、50、55、60、65、70、80、85、90℃,ph4.5的条件下测定其酶活性性。如图2所示,葡萄糖淀粉酶野生型、突变体ga2及突变体m3、m5、m8的最适温度分别为65℃、75℃、75℃、75℃、70℃。
44.测定葡萄糖淀粉酶野生型、突变体ga2及突变体m3、m5、m8在70℃下的稳定性,在0.1mol/l柠檬酸
‑
磷酸氢二钠缓冲液(ph6.3)缓冲液体系中,葡萄糖淀粉酶野生型、突变体ga2及突变体m3、m5、m8分别于70℃下处理0、2、5、10、20、30、60min,再在分别对应的最适温度测定相对剩余酶活,突变体ga2及突变体m3、m5、m8在70℃下处理10分钟后,葡萄糖淀粉酶野生型的剩余酶活约为12
‑
15%,突变体ga2及突变体m3的剩余酶活基本相同,约为85
‑
90%,突变体m5、m8的剩余酶活分别为92%和22%。处理1h后,野生型仅有5
‑
8%的剩余酶活,而突变体ga2及突变体m3的剩余酶活为60
‑
70%,突变体m5、m8有62%和9%的剩余酶活,突变体m5的热稳定性较野生型有明显改善,虽然突变体m8分别与突变体m5和突变体m3有部分相同的突变位点,但是突变体m8的热稳定性较野生型未有改善。
45.(2)测定葡萄糖淀粉酶突变体m3、m5、m8的酶活性将本发明纯化的葡萄糖淀粉酶m3、m5突变体在ph4.5、75℃下进行酶促反应,m8突变体在ph4.5、70℃下进行酶促反应,以测定其酶活性。如图3所示,葡萄糖淀粉酶m3的比活力为1093.8u/mg,m5的比活力为1112.9u/mg,m8的比活力为1004.3u/mg,与葡萄糖淀粉突变体ga2的比活力1054.0u/mg相比,m3、m5的比活力比略高于ga2,m8的比活力略低于ga2。
46.(3)测定葡萄糖淀粉酶野生型、突变体ga2及突变体m3、m5、m8分别在最适ph及温度下进行动力学参数的测定用ph4.5的柠檬酸
‑
磷酸氢二钠缓冲溶液配制浓度为1~10mg/ml不等的可溶性淀粉,糊化后作为反应底物。然后分别在ph4.5、65℃、75℃和70℃条件下反应15min并测定不同底物浓度下的酶活。以可溶性淀粉为底物时,纯化的葡萄糖淀粉酶野生型k
m
值为0.77mg/ml,v
max
值为719.2μmol/(min
·
mg)。m3、m5突变体在75℃、ph4.5的条件下,k
m
值分别为0.72mg/ml、0.38mg/ml,v
max
值分别为1195.2μmol/(min
·
mg)、1226.8μmol/(min
·
mg);m8突变体在70℃、ph4.5的条件下,k
m
值为0.31mg/ml,v
max
值为
1004.4μmol/(min
·
mg), m3突变体较野生型的k
m 值未有所变化,m5、m8突变体较野生型的k
m 值下降明显,底物亲和力上升。突变体m3的催化效率(kcat /km)从982.3 ml/s/mg提升至1759.8 ml/s/mg,突变体m3的催化效率略低于突变体ga2的催化效率但是较野生型有所改善;突变体m5和m8的催化效率(kcat /km)分别从982.3 ml/s/mg提升至3378.2ml/s/mg和3412.9ml/s/mg,分别较野生型提高3.4倍和3.5倍。
47.(4)测定葡萄糖淀粉酶ga2及m3、m5、m8突变体转录水平ga2及m3、m5、m8突变体设置三个平行的生物学重复,每个生物学重复又进行三次技术重复,内参基因选择arg4、gap、re
‑
act三种,并最终确定arg4为使用内参基因。进行rt
‑
pcr实验,计算转录水平变化采用2
‑
δδct 计算。如图4所示,突变体m3、m5、m8的转录水平分别是突变体ga2的1.9倍、2.4倍、5.8倍,m5及m8转录水平提升非常显著。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1