重组表达的羊干扰素-τBB8基因及其制备方法
重组表达的羊干扰素-τ
bb8基因及其制备方法
技术领域
1.本发明属于基因工程技术领域,具体涉及一种重组表达的羊干扰素-τbb8(goat interferon tau bb8,goifn-τbb8)基因及其制备方法。
背景技术:
2.干扰素-τ(interferon-tau,ifn-τ)是反刍动物胚胎滋养层细胞分泌的一种酸性、低分子量蛋白质,最初称为胚胎滋养层细胞蛋白-i,在反刍动物母体与胚胎的妊娠识别过程中起着极其重要的作用
[1,2]
。尽管ifn-τ不由病毒感染诱导产生,但根据其氨基酸序列与ifn-α、ifn-ω的同源性,ifn-τ也被归为i型干扰素
[3]
,且具有与后两者相似的抗增殖、抗病毒活性,而在用于疾病治疗时,较前两者而言,几乎没有毒副作用
[4-6]。bazer等报道,在阻止人与猫免疫缺陷病毒在人与猫的淋巴细胞内的复制上,绵羊干扰素-τ具有与人干扰素-α相同的效果
[7]
。显然,ifn-τ在提高反刍动物的妊娠率以及预防治疗人以及动物病毒病上具有潜在的应用价值。
[0003]
为实现ifn-τ的规模应用,需要大量纯化的ifn-τ,利用现代技术制备ifn-τ备受关注。迄今为止,研究人员已尝试在昆虫细胞杆状病毒表达系统
[8]
、酿酒酵母表达系统
[9]
、毕赤酵母表达系统
[10]
、腺病毒表达系统
[11]
、丝蚕杆状病毒表达系统
[12]
等各种真核表达系统中表达ifn-τ,但应用上述表达系统生产ifn-τ存在产量低、成本高等问题,难以适应规模化生产和临床应用的需要。大肠杆菌表达系统由于生长快、成本低、表达水平高而成为应用最为广泛的表达系统,但外源蛋白由于不正确的折叠通常在大肠杆菌中以包涵体的形式表达。也有少数研究者利用原核表达系统表达ifn-τ,如grewal等
[13]
利用大肠杆菌表达带有gst标签的ifn-τ,作者没有报道所表达的ifn-τ的活性情况,至少需要切除gst标签才可能具有活性;kelmann等
[14]
以及付加雷等
[15]
利用大肠杆菌以包涵体的形式重组表达了ifn-τ,需要经过额外的变性复性操作,才能得到活性形式的ifn-τ,缺点是增加了操作步骤、拉长了生产周期以及降低了ifn-τ的回收率。kiemann等
[14]
(1990)首先将bifn-t基因克隆到表达载体ptrp2,转化大肠杆菌d112,诱导后获得重组的btp-1,btp-1以包涵体形式表达,表达产物经变性、复性和柱纯化,从每升菌液可获得约20mg的bifn-t,抗水泡性口炎病毒(vsv)的活性为4.2
×
107iu/mg。付加雷等
[15]
(2007)pcr扩增出ifn-tau orf,与原核表达载体pbv220重组后,成功地构建了ifn-tau的原核表达质粒pbv220/ifn-tau。重组质粒转化大肠杆菌bl21,该菌经过42℃温控诱导,目标蛋白以包涵体形式表达,ifn-tau经过透析复性后抗水泡性口炎病毒(vsv)的活性为2.35
×
106iu/mg。高方方等
[16]
(2008)采用pcr方法直接从牛早期胚胎细胞中扩增牛干扰素-tau基因(bifn-τ),克隆到原核表达载体pet-30a(+),iptg诱导表达。表达的bifn-τc端带6个his。目标蛋白以包涵体形式表达。变、复性纯化后重组bifn-τ蛋白的在mdbk细胞上抗vsv病毒活性为1
×
104iu/mg。kelmann等
[14]
、付加雷等
[15]
、高方方等
[16]
利用大肠杆菌以包涵体的形式重组表达了ifn-τ,需要经过额外的变性复性操作,才能得到活性形式的ifn-τ,缺点操作步骤繁琐、生产周期长、产量低。如kelmann等
[14]
从每升菌液可获得约20mg的bifn-t。
[0004]
saugandhika等
[17]
(2015)从水牛早期胚胎中克隆了ifn-τ基因,亚克隆入pet-22b表达载体,转化bl21(de3),诱导后以可溶有活性的形式表达,经his亲和层析、阴离子交换层析和凝胶过滤层析,从每升菌液可获得1.216mg纯化的水牛ifn-τ。通过pelb信号肽序列,将表达的水牛ifn-τ定位在细胞外周质腔,实现了水牛ifn-τ在大肠杆菌中的可溶性表达,但从每升菌液可获得1.216mg纯化的水牛ifn-τ,产量极低,难以满足工业化生产的需要。
[0005]
2018年青岛蔚蓝生物股份有限公司公布了“一种重组羊τ-干扰素、其制备方法及其应用”(专利申请号为cn201711444511.2),将绵羊ifn-τ基因进行密码子改造、rna二级结构优化及某些常见内切酶位点消除后克隆至pet-23b(+)载体上,转化大肠杆菌进行诱导表达,重组羊τ-干扰素以包涵体形式表达,需经包涵体分离、变性纯化、复性才获得目标蛋白。
[0006]
2015年安徽九川生物科技有限公司公布了“一种获取羊干扰素τ基因的引物、重组羊干扰素τ的制备方法”(专利申请号为cn201410799291.5),应用pcr方法克隆羊ifn-τ基因,然后亚克隆至pet-32a(+)载体上,转化大肠杆菌进行诱导表达,重组羊τ-干扰素与gst融合后,一部分以包涵体形式表达,一部分以可溶性形式表达,重组羊τ-干扰素在hep-2/vsv系统上的抗病毒活性为106iu/mg,需经包涵体分离、变性纯化、复性才获得目标蛋白。通过融合表达的方法实现了羊ifn-τ部分可溶性表达,纯化后的活性为1
×
106iu/mg,活性较低。
技术实现要素:
[0007]
针对现有技术中的不足,本发明的目的在于提供一种重组表达的羊干扰素-τbb8基因及高效制备方法。
[0008]
为达到上述目的,本发明的解决方案是:
[0009]
本发明的目的之一,提供了一种重组表达的羊干扰素-τbb8基因,其核苷酸序列如seq id no.1所示。
[0010]
优选地,重组表达的羊干扰素-τbb8基因对羊干扰素-τbb8天然基因序列的密码子进行优化。
[0011]
优选地,重组表达的羊干扰素-τbb8基因的dna分子与羊干扰素-τbb8天然的dna分子相比,全部优化替换为大肠杆菌偏爱的密码子。
[0012]
优选地,重组表达的羊干扰素-τbb8基因在羊干扰素-τbb8天然基因序列的5’端插入ndei位点,3’端插入终止密码子与hindiii位点设计得到。
[0013]
优选地,羊干扰素-τbb8天然基因序列如seq id no.2所示。
[0014]
其中,密码子没有优化前,羊干扰素-τbb8天然基因在大肠杆菌中密码子适应指数(cai)为0.59,通过密码子优化后,使得本发明的羊干扰素-τbb8基因在大肠杆菌中cai指数为0.86。
[0015]
密码子没有优化前,羊干扰素-τbb8天然基因在大肠杆菌中的低利用率密码子出现百分比为15%,通过密码子优化后,而本发明的羊干扰素-τbb8基因在大肠杆菌中低利用率密码子的出现百分比为0%。
[0016]
本发明的目的之二,提供了一种根据上述的重组表达的羊干扰素-τbb8基因的制备方法,其包括如下步骤:
[0017]
(1)、将羊干扰素-τbb8天然基因的密码子进行优化,得到设计的羊干扰素-τbb8基
因;
[0018]
(2)、将设计的羊干扰素-τbb8基因克隆导入表达载体中,并转化到宿主细胞内;
[0019]
(3)、根据表达载体的不同,从宿主细胞中筛选含有羊干扰素-τbb8基因的重组菌株;
[0020]
(4)、将重组菌株经过培养,离心,收集上清和沉淀;
[0021]
(5)、层析纯化,得到重组表达的羊干扰素-τbb8基因。
[0022]
优选地,步骤(1)中,优化的过程为:在羊干扰素-τbb8天然基因的5’端插入ndei位点,3’端插入终止密码子与hindiii位点。
[0023]
优选地,步骤(2)和步骤(3)中,表达载体包括pet28a、pet30a、pcoldii以及pmal-c2x,进一步优选为pcoldii。
[0024]
优选地,步骤(2)和步骤(3)中,宿主细胞包括e.coli rosetta(de3)和bl21(de3),进一步优选为e.coli rosetta(de3)。
[0025]
优选地,步骤(4)中,培养的条件为:16-37℃下,0.01-1.0mmol/l异苯基硫代半乳糖苷诱导4-24h,进一步优选为16℃下,0.02mmol/l异苯基硫代半乳糖苷诱导24h。
[0026]
优选地,步骤(5)中,纯化的过程为:在非变性条件下,使用ni
2+-柱进行纯化。
[0027]
由于采用上述方案,本发明的有益效果是:
[0028]
第一、本发明首次在大肠杆菌系统中表达出有活性的羊干扰素-τbb8蛋白,即人工设计合成的羊干扰素-τbb8基因选用大肠杆菌偏爱密码子,有利于密码子在大肠杆菌中的识别和表达,从而可达到高效表达的目的。
[0029]
第二、本发明的表达系统有利于重组蛋白的正确折叠,促进了羊干扰素-τbb8以可溶性形式表达,该蛋白在非变性条件下经一步纯化即可获得高纯度产品,工序少,生产效率高。
[0030]
第三、本发明获得的可溶性表达的羊干扰素-τbb8表达量高,能达到100mg/l,为后续规模化生产打下了良好的基础。
[0031]
第四、本发明的羊干扰素-τbb8蛋白具有较高的抗病毒活性,在mdbk细胞上的vsv的活性可达2.3
×
108u/mg,具有良好的产业应用前景。
附图说明
[0032]
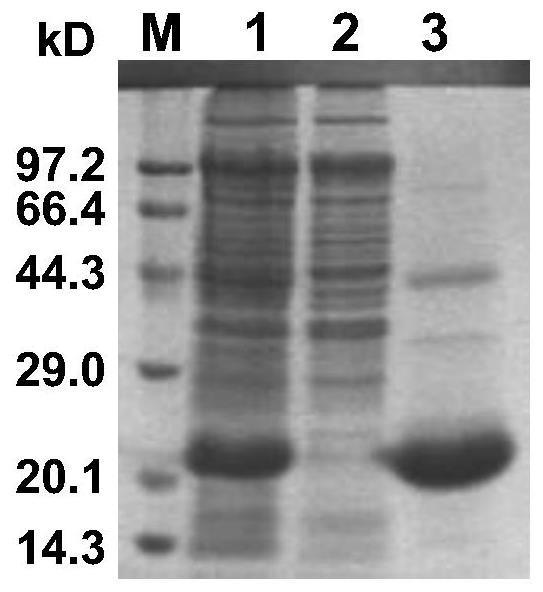
图1为本发明的重组蛋白表达的sds-page分析示意图。
[0033]
图2为本发明的rgoifn-τ表达后的纯化示意图。
具体实施方式
[0034]
本发明提供了一种重组表达的羊干扰素-τbb8基因及其制备方法。
[0035]
具体地,本发明的重组表达的羊干扰素-τbb8基因的制备方法包括如下步骤:
[0036]
(1)、根据genbank上(登录号:abl63466.1)羊干扰素-τbb8成熟蛋白的氨基酸序列(seq id no.3)和羊干扰素-τbb8天然基因序列(seq id no.2),对天然基因序列的密码子进行了优化、设计出编码羊干扰素-τbb8成熟蛋白的基因,在其5’端插入ndei位点,3’端插入终止密码子与hindiii位点,人工合成设计好的羊干扰素-τbb8基因。
[0037]
(2)、将羊干扰素-τbb8基因分别克隆入表达载体pet28a、pet30a、pcoldii以及
pmal-c2x,将表达载体分别转化到宿主细胞e.coli rosetta(de3)和bl21(de3)中。
[0038]
(3)、根据各载体抗性的不同,从宿主细胞中筛选含有羊干扰素-τbb8基因的重组细胞。
[0039]
(4)、培养重组细胞,表达得到含羊干扰素-τbb8蛋白的重组菌液。
[0040]
将重组菌株过夜培养物接种在含氨苄青霉素或卡那霉素的lb培养基中,37℃振荡培养至od
600
约0.4-1.0,加入终浓度为0.01-1.0mmol/l的异苯基硫代半乳糖苷(isopropylthio-β-d-galactoside,iptg),16-37℃振荡诱导培养4-24h,离心收集菌体,加入细菌裂解缓冲液,混悬后冰浴超声波裂解完全,离心,收集上清和沉淀,分别取样进行12%sds-page分析。
[0041]
结果,在16℃下,0.02mmol/l异苯基硫代半乳糖苷诱导24h条件下,未经iptg诱导的重组菌pcoldii-rgoifn-τ/rosetta(de3)总蛋白不存在目的蛋白,而经iptg诱导后,在总蛋白、上清、沉淀中均可见一分子量约22kda的目的蛋白条带,且上清中目的蛋白较多,说明rgoifn-τ蛋白在大肠杆菌中得到了表达,且目的蛋白主要以可溶形式存在(图1)。凝胶薄层扫描显示,表达的重组蛋白占菌体总蛋白的28.70%。
[0042]
(5)、层析纯化,得到重组表达的羊干扰素-τbb8。
[0043]
诱导表达足量重组菌液,离心收集菌体沉淀,用细菌裂解缓冲液重悬,冰浴超声波裂解,离心取上清,his-bind树脂纯化。分别在过柱前、过柱后、洗脱后取样,12%的sds-page分析蛋白纯化情况。将洗脱的目的蛋白,透析去除咪唑,每隔12h换液,共换液三次。透析好的蛋白液,离心收集上清,用0.22μm小滤器过滤除菌,-20℃保存备用。
[0044]
含重组蛋白的上清液,过镍柱前在目标位置有明显蛋白条带,过镍柱后在目标位置没有蛋白条带出现,说明rgoifn-τ完全结合到his-bind树脂上。洗脱后的蛋白液,在目标位置出现明显蛋白条带(图2),以及少量的其他非目的蛋白。利用条带分析软件显示,纯度超过90%。另外,根据最终纯化获得的蛋白量推算,每升菌液可获得约100mg纯化的rgoifn-τ。
[0045]
其中,使用的宿主细胞为e.coli rossetta(de3)。
[0046]
方法还包括在非变性条件下,使用ni
2+-柱对羊干扰素-τbb8蛋白进行纯化的步骤。
[0047]
其中,羊干扰素-τbb8成熟蛋白的氨基酸序列(seq id no.3):
[0048]
genbank:abl63466.1
[0049]
cylsrrlmldarenlrlldrmnrlsphsclqdrkdfglpqemvegdqlqkdqafsvlyemlqqtfnlfytehssaawdttlleqlrtglqqqledldtcrgpvmgekdselgkmdpivtvkkyfqgihdylqekeysdcaweivrvemmraltssttlqkrltkmggdlnsp。
[0050]
优化前羊干扰素-τbb8成熟蛋白的的核苷酸序列(seq id no.2):
[0051]
tgttacctatctcggagactcatgctggatgccagggagaacctcaggctcctggaccgaatgaacagactgtcccctcattcctgtctgcaggacagaaaagactttggtcttccccaggagatggtggagggcgaccagctccagaaggaccaggccttctctgtgctctatgagatgctccagcagaccttcaacctcttctacacagagcactcatctgctgcctgggacaccaccctcctggagcagctccgcactggactccaacagcagctggaggacctggacacctgcaggggtcccgtgatgggagagaaagactctgaactgggaaagatggaccccattgtgaccgtgaagaagtacttccagggcatccatgactacctgcaagagaaggaatacagcgactgcgcctgggaaatcgtcagagtggagatgatgagagccctcacttcatcaaccaccttgcaaaaaaggttaacaaagatgggtggagatctgaactcaccttga。
pastoris[j].journal of interferon&cytokine research,1996,16(2):119-126.
[0065]
[11]martin v,pascual e,avia m,et al.a recombinant adenovirus expressing ovine interferon-tau prevents influenza virus induced lethality in mice[j].journal of virology,2016:jvi.03258-15.
[0066]
[12]nagaya h,kanaya t,kaki h,et al.establishment of a large-scale purification procedure for purified recombinant bovine interferon-τproduced by a silkworm-baculovirus gene expression system[j].journal of veterinary medical science,2004,66(11):1395-1401.
[0067]
[13]grewal t s,jeacock m k,shepherd d a l,et al.expression and purification of bovine trophoblast protein-1(btp-1)in escherichia coli[j].annals of the new york academy of sciences,1996,782(1):264-271.
[0068]
[14]klemann s w,li j,imakawa k,et al.the production,purification,and bioactivity of recombinant bovine trophoblast protein-1(bovine trophoblast interferon)[j].molecular endocrinology,1990,4(10):1506-1514.
[0069]
[15]付加雷,宋长征,张更林.干扰素-tau的原核表达,纯化和活性测定[j].中国生物工程杂志,2007,27(3):6-11.
[0070]
[16]高方方,吴忠义,曾申明.牛干扰素-tau基因的原核表达及生物功能鉴定[j].农业生物技术学报,2008,16(2):208-213
[0071]
[17]saugandhika s,sharma v,malik h,et al.expression and purification of buffalo interferon-tau and efficacy of recombinant buffalo interferon-tau for in vitro embryo development[j].cytokine,2015,75(1):186-196.
[0072]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1