一株白蚁链霉菌N-15和微生态制剂及其制备方法与应用
一株白蚁链霉菌n-15和微生态制剂及其制备方法与应用
技术领域
1.本发明涉及一种微生物白蚁链霉菌,尤其涉及一株白蚁链霉菌n-15和用其发酵制成的微生态制剂及其制备方法与应用。
背景技术:
2.近几十年来,水产养殖产量持续快速增长,与此同时,由于精养鱼池放养密度的增加和病害防治措施的缺乏,导致爆发重大疾病,其中细菌性疾病为主要病害,极大地阻碍了水产养殖业的健康发展。目前为止,对于细菌性疾病,常常是选择快速有效且价格低廉的合成抗生素和各类化学药品进行治疗。但是由于这类药物的不合理使用,不仅导致养殖环境被破坏,许多致病菌产生抗药性,使得水产养殖动物免疫力下降或患病死亡,甚至残留在水产品中的药物可能会转移到人体中去,从而产生传染病,并对人类健康构成风险。为了克服抗生素在水产养殖中的滥用不断出现的耐药性病原菌,研发抗鱼类细菌性病害的新药物迫在眉睫。
3.益生菌可对抗病原体、促进生长和刺激宿主对感染的免疫反应,是预防和控制水产养殖中各类疾病的有效替代品。放线菌是多种结构新颖的活性分子的重要资源库,具有降解淀粉、蛋白质等大分子与分泌抑菌活性物质及可以产生耐热性孢子的优点,有望将其应用于水产养殖业中的病害防治。因此,放线菌具有成为水产养殖益生菌的巨大潜力。
4.li等人从湖南长沙洋湖湿地的泥土中获得的溶藻链霉菌(streptomyces amritsarensis n1-32)作为饲料添加剂能提高草鱼免疫组织中免疫相关基因的表达量,从而保护草鱼免受病原菌的感染(参见“li y,hu s,gong l,pan l,li d,cao l,khan t a,yang y,peng y,ding x,yi g,liu s,xia l.isolating a new streptomyces amritsarensis n1-32 against fish pathogens and determining its effects on disease resistance of grass carp[j].fish shellfish immunol,2020,98(632-640”)。sunish等人评估了放线菌作为免疫刺激剂饲养凡纳滨对虾,结果表明6种免疫因子(α-2巨球蛋白、对虾素3、转谷氨酰胺酶、丙氨酸、壳蛋白和过氧化物酶)在攻毒后明显上调(参见“sunish,k.s.,m.biji,p.rosamma,n.s.sudheer,k.sreedharan,a.mohandas,i.b.singh,et al.marine actinomycetes nocardiopsis alba mccb 110has immunomodulatory property in the tiger shrimp penaeus monodon[j].fish&shellfish immunology,2020,102:125-132”)。
[0005]
但迄今为止,尚未见有将白蚁链霉菌应用于水产养殖病害防治的报道。
技术实现要素:
[0006]
本发明要解决的技术问题是,克服现有技术存在的上述缺陷,提供一株对多种鱼类病原菌均具有很好拮抗作用的白蚁链霉菌n-15。
[0007]
本发明进一步要解决的技术问题是,提供一种适用于水产养殖,防治鱼类疾病微生态制剂。
[0008]
本发明更进一步要解决的技术问题是,提供一种操作简便的微生态制剂的制备方法。
[0009]
本发明解决其技术问题采用的技术方案是,一株白蚁链霉菌n-15(streptomyces termitum n-15),保藏于中国典型培养物保藏中心,菌种保藏号为cctcc no:m 2021726;分类命名为:白蚁链霉菌n-15。
[0010]
本发明之白蚁链霉菌n-15的16s rrna序列如序列表seq id
№
1所示。
[0011]
本发明白蚁链霉菌n-15自湖南张家界地区的鱼塘底泥中筛选得到。
[0012]
本发明进一步解决其技术问题采用的技术方案是,一种由菌种保藏号为cctcc no:m 2021726的白蚁链霉菌n-15发酵制成的微生态制剂。
[0013]
进一步,菌株发酵液中的抑菌活性物质为:查尔霉素(chalcomycin a),相对分子量为701.4。
[0014]
进一步,所述微生态制剂为液体制剂或固体制剂。
[0015]
研究表明,本发明之微生态制剂能抑制嗜水气单胞菌、维氏气单胞菌、迟缓爱德华氏菌等多种鱼类病原菌的生长,菌株发酵液中的抑菌活性物质的理化性质对高温、强酸强碱及蛋白酶均不敏感。
[0016]
本发明更进一步解决其技术问题采用的技术方案是,一种微生态制剂的制备方法,包括下列步骤:
[0017]
(1)将白蚁链霉菌n-15接种至培养基上,选取成熟孢子到am6摇瓶种子培养基中进行培养,得种子液;
[0018]
(2)将步骤(1)所得的种子液接种到装有发酵培养基的发酵罐中扩大培养,得扩大培养的种子液;
[0019]
(3)将步骤(2)所得的扩大培养的种子液接种到装有发酵培养基的发酵罐中,进行培养,培养时实时在线补加消泡剂,得发酵产物;
[0020]
(4)将步骤(3)所得的发酵产物浓缩,得微生态液体制剂;或者将微生态液体制剂用陶瓷膜过滤,收集滤液,将滤液喷雾干燥,得微生态粉剂制剂。
[0021]
进一步,步骤(2)中,所述种子液接种到发酵罐中的接种量为发酵培养基体积的1~1.5%;所述扩大培养的发酵培养基的配方为葡萄糖0.5~2.0g,caco30.2~0.5g,可溶性淀粉1~3g,酵母浸膏0.1~0.5g,细菌学蛋白胨0.2~0.6g。
[0022]
进一步,步骤(3)中,所述扩大培养的种子液的接种量为发酵培养基体积的8~10%;所述发酵培养基的配方为葡萄糖0.5~2.0g,caco
3 0.2~0.5g,可溶性淀粉1~3g,酵母浸膏0.1~0.5g,细菌学蛋白胨0.2~0.6g。
[0023]
进一步,步骤(3)中,所述培养的溶氧量35~55%;所述培养的温度30~40℃;所述培养的时间为48~60h。
[0024]
进一步,步骤(3)中,所述发酵罐中装有发酵培养基的量占发酵罐总体积的70~75%,发酵罐的体积为500~600l。
[0025]
本发明对白蚁链霉菌n-15作为鱼类病害防治的特点进行了研究,鉴定和研究方法如下:
[0026]
(一)白蚁链霉菌n-15的细菌形态学特征观察;
[0027]
(二)利用16s rrna基因进行鉴定;
[0028]
(三)白蚁链霉菌n-15对草鱼的安全性评估;
[0029]
(四)白蚁链霉菌n-15作为饲料添加剂投喂草鱼;
[0030]
(五)白蚁链霉菌n-15活性物质的分离及结构鉴定。
[0031]
利用本发明白蚁链霉菌n-15制成的微生态制剂适用水产养殖,特别是淡水鱼养殖,作用于草鱼肝脏细胞及草鱼体内均无毒害作用;通过将白蚁链霉菌n-15的微生态制剂作为饲料添加剂饲喂草鱼、鲫鱼等淡水鱼类,能提高草鱼的生长率、饵料效率,同时能增强淡水鱼类的免疫力,从而显著提高草鱼等淡水鱼类对鱼类病原菌的抵抗力。具有广谱的抑制鱼类病原菌的作用,保护率达到50%,作用鱼体后能有效对抗嗜水气单胞菌对草鱼、鲫鱼等淡水鱼类的感染,尤其是对草鱼的保护效果最好。
[0032]
与现有技术相比,本发明具有以下有益效果:
[0033]
(1)经16s rrna基因序列测定,鉴定的活性物质的分离鉴定对嗜水气单胞菌、维氏气单胞菌和迟缓爱德华氏菌等抑菌效果好;
[0034]
(2)使用本发明白蚁链霉菌n-15菌株发酵制备的微生态制剂在水产中应用具有较大的潜能,将其作为饲料添加剂饲喂草鱼后,对草鱼血清酸性磷酸酶和碱性磷酸酶的活性进行了测定,同时分析了肝脏、肾脏、脾脏和头肾等主要免疫器官的抗核因子相关因子2-kelch样环氧氯丙烷相关蛋白1(keap1))、免疫相关基因(toll样受体4基因、免疫球蛋白m基因、髓样分化因子88、补体c3、溶菌酶基因lsz),结果表明,喂食有白蚁链霉菌n-15菌株微生态制剂的草鱼,血清中碱性磷酸酶和酸性磷酸酶的活性会显著性升高,草鱼免疫相关基因的表达量也会在不同的免疫器官中上调,说明白蚁链霉菌n-15菌株微生态制剂能够增强草鱼对病原菌维氏气单胞菌的抵抗力,显著提高草鱼的存活率(50-60%),作用鱼体后能有效对抗维氏气单胞菌对草鱼、鲫鱼等淡水鱼类的感染;
[0035]
(3)活性物质的分离鉴定可以作为一种益生菌制剂在水产养殖中具有很大的开发潜力,分离并鉴定出白蚁链霉菌n-15发酵液中的抑菌活性物质为:chalcomycin a(查尔霉素),分子量大小为701.4,化学式为c
35h56o14
;本发明还首次检测了chalcomycin a对5种鱼类常见致病菌的抑菌活性,表明chalcomycin a具有很好的抑菌活性,有潜在的水产应用价值。
[0036]
微生物保藏情况说明:
[0037]
本发明之白蚁链霉菌n-15,于2021年6月15日保藏于中国典型培养物保藏中心(简称cctcc,地址:中国武汉武汉大学),菌种保藏号为cctcc no:m 2021726,分类命名:白蚁链霉菌n-15,拉丁学名streptomyces termitum n-15。
附图说明
[0038]
图1是本发明白蚁链霉菌n-15形态学特征观察图。
[0039]
图2是本发明白蚁链霉菌n-15的扫描电镜观察图。
[0040]
图3是本发明基于菌株n-15的16s rdna序列构建系统发育树。
[0041]
图4是本发明白蚁链霉菌n-15的生长曲线图。
[0042]
图5是本发明白蚁链霉菌n-15活性峰的分离鉴定图。
[0043]
图6是本发明白蚁链霉菌n-15代谢产物的hplc分离图。
[0044]
图7是本发明白蚁链霉菌n-15抑菌活性峰z3的一级质谱图。
[0045]
图8是本发明白蚁链霉菌n-15抑菌活性物质的碳谱图。
[0046]
图9是本发明白蚁链霉菌n-15抑菌活性物质的氢谱图。
[0047]
图10是本发明白蚁链霉菌n-15抑菌活性物质的结构式。
[0048]
图11是本发明白蚁链霉菌n-15抑菌活性物质的生物合成基因簇图。
[0049]
图12是本发明白蚁链霉菌n-15对草鱼体液免疫相关酶活性变化柱状图。
[0050]
图13是本发明白蚁链霉菌n-15对草鱼肝脏免疫相关基因表达变化柱状图。
[0051]
图14是本发明白蚁链霉菌n-15对草鱼肾脏免疫相关基因表达变化柱状图。
[0052]
图15是本发明白蚁链霉菌n-15对草鱼脾脏免疫相关基因表达变化柱状图。
[0053]
图16是本发明白蚁链霉菌n-15对草鱼头肾免疫相关基因表达变化柱状图。
[0054]
图17是本发明白蚁链霉菌n-15对维氏气单胞菌攻毒后草鱼的存活率折线图。
具体实施方式
[0055]
下面结合附图和具体实施例对本发明作进一步说明。
[0056]
本发明实施例所使用的化学试剂,如无特殊说明,均通过常规商业途径获得。
[0057]
(一)白蚁链霉菌n-15的采集分离纯化筛选过程
[0058]
采集国内不同省份的土壤样品,称取5g底泥加入45ml的无菌水中,用漩涡振荡器振荡摇匀,然后以10倍梯度稀释法稀释,选取10-4
、10-5
、10-6
三个稀释度的稀释液0.1ml分别涂布于加有重铬酸钾(浓度为30
×
10-6
g/ml)的高氏ⅰ号平板上,30℃培养5d,通过平板上菌落形状和颜色的差异,挑选不同的菌落于平板上划线纯化培养,重复该步骤3次,将纯化后的菌株于am6液体培养,然后保藏于-80℃超低温冰箱。
[0059]
(二)白蚁链霉菌n-15的细胞形态学特征
[0060]
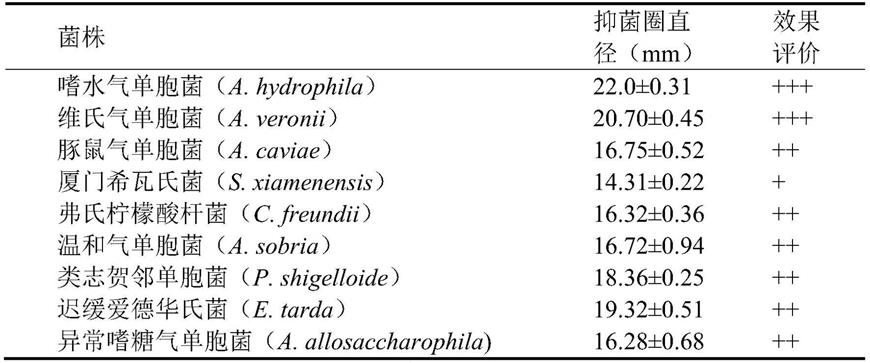
分离纯化得到140株菌,筛选其中一株对多种鱼类病原菌均具有很好的拮抗作用的的优良菌株(表1),命名为n-15。将放线菌n-15划线在高氏ⅰ号固体培养基上,30℃培养4d后,观察到菌落较大且质地紧密,并且产孢丰富,中间凸出,气生菌丝为乳白色,基内菌丝为淡黄色并伴有黄色可溶性色素产生(见图1),扫描电镜下观察n-15菌株为孢子丝有断裂,孢子呈圆柱状且表面呈褶皱状(见图2)。
[0061]
表1对多种鱼类病原菌均具有很好的拮抗作用的优良菌株
[0062][0063]
注:
“‑”
表示无拮抗效果;“+”表示有拮抗效果
[0064]
(三)n-15菌株16s rrna基因的同源序列分析
[0065]
将菌株n-15的孢子接种于高氏ⅰ号液体培养基中(30℃,125rpm)震荡培养4d,然后取新鲜菌液于ep管中离心收集菌体,使用购自上海生工生物公司的细菌基因组dna提取试剂盒提取菌株n-15的基因组,利用16s rrna基因扩增引物序列为:
[0066]
27f:5
′‑
agagtttgatcctggctcag-3
′
;
[0067]
1492r:5
′‑
acggctaccttgttacgactt-3
′
,
[0068]
以上述引物扩增菌株对应的基因序列,序列预期长度分别约1443bp。
[0069]
pcr反应体系(20μl):无菌双蒸水,12μl;5
×
buffer,4μl;dntp,1.6μl;bf-r(10μm),0.6μl;bf-f(10μm),0.6μl;基因组模板,1μl;primerstar dna polymerase(takara),0.2μl;
[0070]
pcr反应程序:95℃预变性5min;30个循环:95℃,45sec;55℃,45sec;72℃,1.5min;72℃,10min。
[0071]
16s rrna基因pcr产物经1.0%琼脂糖凝胶电泳检测并回收。然后将纯化后的pcr产物用pmd-18t vector进行连接,转化到大肠杆菌dh5α感受态细胞中,进行氨苄抗性筛选,挑取阳性转化子提取质粒,送至上海生工生物技术有限公司测序。
[0072]
菌株n-15的16s rdna序列经测序显示长度为1529bp,扩增测序结果在ncbi上经过blast比对分析,利用mega6.0的kimura-2-parameter模型,运用邻接(nj)构建系统发育树(见图3)。根据blast所得结果以及相差显微镜观察推测该菌株属于streptomyces termitum亚种,命名为streptomyces termitum n-15,白蚁链霉菌n-15。
[0073]
lb培养基(/l):10g氯化钠,10g蛋白胨,5g酵母粉,20g琼脂(液体培养基不加),ph 6.8-7.2;
[0074]
具体实施过程:挑取高氏平板上生长状态良好的n-15孢子至am6液体培养基中生长至对数期作为种子液,然后以1%的接种量将菌株n-15的种子液转接至多瓶装有20ml am6发酵培养基震荡培养,每12h取出3瓶,9000rpm离心10min收集菌体,将菌体用pbs洗2遍,然后用烘箱烘干水分,称取放线菌n-15的干重,记录平均值,重复该操作3次,绘制得到放线菌n-15的生物量曲线。
[0075]
白蚁链霉菌n-15菌株的生长曲线如图4所示,结果表明,发酵开始时,瓶内各养分充足菌体能快速的生长繁殖,在培养84h时达到生长对数期,菌株在84h-110h处于稳定生长状态,衰亡期出现在发酵120h后。
[0076]
(四)白蚁链霉菌n-15菌株抑菌活性物质的分离纯化
[0077]
将菌株n-15接种到am6发酵培养基中发酵4d,共发酵30l。然后将发酵好的链霉菌n-15培养液反复离心3次,收集发酵上清液,然后加入等体积的乙酸乙酯萃取,在分液漏斗中反复震荡,使其萃取充分,6h后将有机相收集,水相再萃取一次,然后将有机相全部收集到一起,37℃旋转蒸发有机溶剂,再加入20ml的甲醇溶解作为菌株n-15活性物质的粗提物。
[0078]
将粗提物使用dmso溶解,0.22μm有机相滤膜过滤,上样量为200μl注入resourcetm rpc色谱柱(3ml,15μm,6.4
×
100mm,ge healthcare,美国),利用生物分子快速纯化系统avant 25进行初次分离。流动相a相为20%体积分数的乙腈,b相为80%体积分数的乙腈,以2ml/min的流速执行线性梯度洗脱(0%~100%b相)12个柱体积,监测波长为190~640nm。洗脱程序如表2所示,收集方法为按峰收集,冷冻干燥收集的各个峰,并检测其对维氏气气单胞菌的抑菌活性,得到活性产物粗品。
[0079]
表2avant 25初次分离方法
[0080][0081]
将收集到的冷冻干燥的样品用甲醇复溶,过滤,使用tc-c18柱(15μm,4.6
×
250mm,agilent),进行高效液相色谱分离纯化(agilent 1290),监测波长为250nm。流动相:a相为5%体积分数的乙腈,b相为95%体积分数的乙腈,流速为1ml/min,分离的流动相a:b=5%:95%乙腈/超纯水;流速为1ml/min。洗脱程序如表3所示,收集活性峰(参见图5)于冷冻浓缩离心机中冻干。
[0082]
将鱼类病原菌嗜水气单胞菌、维氏气单胞菌、杀鲑气单胞菌、温和气单胞菌、类志贺邻单胞菌活化后,取100μl的菌液于固体lb培养基平板,用涂布器将其均匀涂布并在超净台中风干,将滤纸片置于平板表面。取活性峰10μl滴加在滤纸片上,30℃培养过夜,观察抑菌效果(参见图6)。将活性峰进行质谱鉴定(参见图7),结合核磁共振技术进一步确定其结构(参见图8-10)。最后通过全基因组测序挖掘到活性物质的生物合成基因簇(参见图11)。
[0083]
表3高效液相色谱分离纯化方法
[0084][0085]
(五)白蚁链霉菌n-15发酵菌剂(微生态制剂)的制备
[0086]
(1)将白蚁链霉菌n-15斜面种子在高氏一号摇瓶种子培养基(可溶性淀粉20g/l;nacl 0.5g/l;kno
3 1g/l;k2hpo4·
3h2o 0.5g/l;mgso4·
7h2o 0.5g/l;feso4·
7h2o 0.01g/l)中活培养72h,培养条件为28℃,180rpm,得种子液;
[0087]
(2)将步骤(1)所得的种子液按1%的接种量接种到20l发酵罐中扩大培养,发酵培养基配方为(1l):葡萄糖1g,caco
3 0.5g,可溶性淀粉2g,酵母浸膏0.5g,细菌学蛋白胨0.5g;发酵培养基装液量为70%,整个培养过程在线监控,控制溶氧浓度为45%,控制温度为28℃,培养84h,实时在线补加消泡剂,od600为4.0,得扩大培养的种子液;
[0088]
(3)将步骤(2)所得的扩大培养的种子液按10%接种量接种到装液量为70%的100l发酵罐中,发酵培养基配方同步骤(2)步所述发酵培养基配方,在溶氧量为45%,温度为28℃培养84h,实时在线补加消泡剂,得发酵产物;
[0089]
(4)将步骤(3)所得的发酵产物浓缩,得微生态液体制剂;或者将微生态液体制剂用陶瓷膜过滤,收集滤液,将滤液喷雾干燥,得微生态粉剂制剂。
[0090]
将所得白蚁链霉菌n-15菌株发酵微生态制剂直接泼洒在养殖水体或拌入饲料中等方式进行应用。
[0091]
(六)白蚁链霉菌n-15微生态制剂在水产应用
[0092]
例1:将10
10
cfu白蚁链霉菌n-15微生态粉末制剂拌入100g饲料喂食草鱼之后,对鱼类病原维氏气单胞菌病的抵抗
[0093]
供试健康草鱼(7-12g)120条,随机分为6组,饲养于实验室圆柱形养殖箱(直径1m,
水体积300l)内,每天投喂相当于鱼体重2%的饲料,饲喂2周,确保草鱼健康,停食24h后进行试验。试验期间,光照周期为12l/12d,水温25
±
2℃,水体ph为7.2
±
0.5,饲料为通威156颗粒膨化料购自通威股份有限公司。
[0094]
试验设计:对照组(ck):喂食灭菌的鱼饲料,添加组(n-15):喂食添加了浓度为1
×
108cfu/g的白蚁链霉菌n-15菌株活菌饲料;每组设置三个重复,喂养28d后,将鱼进行24h饥饿处理,每个组随机取5尾草鱼,进行称重后,用ms-222麻醉断尾取血,使用试剂盒(碱性磷酸酶活性测定试剂盒、酸性磷酸酶活性测定试剂盒购自南京建成生物有限公司)测定血清中碱性磷酸酶和酸性磷酸酶的活性(参见图12),发现草鱼血清中的碱性磷酸酶活性显著升高。无菌环境下在冰盘中快速解剖,取肝脏、肾脏、脾脏、头肾组织,分别提取各组织的总rna,设计引物(参见表5),利用qrt-pcr检测各组织免疫相关基因表达变化(参见图13、图14、图15和图16),草鱼脾脏和尾肾中添加组均能显着上调igm,c3,tlr-4,keap1,myd-88和lsz的基因表达。igm基因在肝脏以外的免疫器官中表达量都显著上调。向鱼体内注射1
×
108cfu/ml的维氏气单胞菌,每尾0.2ml,观察统计鱼死亡数(参见图17),对草鱼的保护率达到50%-60%。
[0095]
表4饲料添加白蚁链霉菌n-15微生态制剂后对草鱼生长性能的影响
[0096][0097]
表5 qrt-pcr引物序列
[0098][0099]
例2:白蚁链霉菌微生态制剂通过饲料添加方式对鱼类维氏气单胞菌病的防治
[0100]
供试健康草鱼(7-12g)120条,随机分为6组,饲养于实验室圆柱形养殖箱(直径1m,水体积300l)内,每天投喂相当于鱼体重2%的饲料,饲喂2周,确保草鱼健康,停食24h后进行试验。试验期间,光照周期为12l/12d,水温25
±
2℃,水体ph为7.2
±
0.5,饲料为通威156
颗粒膨化料购自通威股份有限公司。
[0101]
试验设计:对照组:喂食灭菌的鱼饲料,添加组:喂食添加了浓度为1
×
108cfu/g的白蚁链霉菌n-15菌株活菌饲料;每组设置三个重复,喂养28d后,喂养28d后,向草鱼体内注射浓度为1
×
108cfu/ml的维氏气单胞菌,注射剂量为0.2ml/尾。连续观察2周并统计鱼死亡数(参见图17),对草鱼的保护率达到50%-60%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1