重组T4连接酶突变体、编码DNA及NGS建库方法与流程
重组t4连接酶突变体、编码dna及ngs建库方法
技术领域
1.本发明涉及一种重组t4连接酶突变体、编码dna及ngs建库方法,属于生物技术领域。
背景技术:
2.t4 dna连接酶(t4 dna ligase, t4dl)由t4嗜菌体30基因编码的一类双链dna连接酶。从1979年被murray n e、bruce s a和murray k发现以来,t4dl广泛被应用在基因工程和诊断的各个领域,包括基因克隆、高通量测序和高通量筛选等。因此,t4dl的功能改造一直是酶改造领域的重点关注点,具有重要的商业和科研价值。
3.尽管现有的t4dl及突变体在基因工程和诊断领域具有广泛的应用,但目前的t4dl及突变体仍具有很大的缺陷。这些t4 dl的粘性末端连接效率只有60%,平末端连接效率低于30%。连接效率的缺陷极大地限制了t4dl的应用价值,因此,市面上一直急需一款可以进行高效率dna连接的t4dl,尤其是平末端接头的连接。
4.ngs诊断技术是基因诊断的热门技术之一,是dna和rna诊断的关键。ngs建库指的是将dna或rna模板转换成具有测序仪识别的特定序列结构,是ngs诊断的关键环节。不论是dna建库还是rna建库,末端修复、接头连接都是必不可少的步骤。末端修复包括外切酶将3’端突出末端切平、5’端突出末端补平、5’端磷酸化、3’端去磷酸化,这个步骤都依赖于3
’‑5’ꢀ
dna外切酶、t4 dna聚合酶和t4磷酸激酶来介导,反应温度在30℃左右。此外,末端修复过程还需要利用taq酶在72℃进行3’端末端加a,以保证下游t4dl介导的接头和底物的ta连接顺利进行。这种建库流程不仅受到t4dl连接效率的限制,也受到3’端末端加a效率的限制(taq酶的加a效率只有70%),最终影响整个ngs建库过程的效率。使用平末端连接不仅可以省去加a的步骤和时长,也可以避免加a效率过低对建库整体效率的影响。因此,探寻高效率的平末端连接方式,是ngs建库领域的重要关注点。
5.近年来,为了提升t4dl的平末端连接,研究者们对t4dl的活性位点进行了一系列的改造,其中k159是t4dl的关键活性位点,介导双链dna连接过程中中间产物的形成。k159l和k159c都会造成连接酶活性缺失。意外的是,k159l和k159c改变了t4dl的连接酶识别底物类型,对传统的5’磷酸底物没有连接活性,但对5’端预腺苷酰化的底物具有很强的亲和力和连接效率(平末端连接效率高达70%以上),这与连接酶的反应动力学机制是紧密相连的。因此,最近也有公司试图利用t4dl k159突变体的连接底物特异性这个特点来进行ngs平末端建库,但由于不是粘性末端能够通过碱基互补配对来稳定两端dna底物,平末端连接效率存在显著的偏好性和差异性,不同末端的连接效率存在极大的差异,这导致了严重的建库偏好性,因此难以应用在ngs建库上。
技术实现要素:
6.本发明的目的是提供一种重组t4连接酶突变体,系在野生型t4dl进行点突变而成。突变位点为:k159s、q19k、l63t、e88r、p127k、k225a、f233a、a237r、d371w、e440k、t451k
和d452p,重组t4连接酶突变体的氨基酸序列如seq id no. 8所示,对平末端的dna底物有良好的连接效率。在突变体一端或两端通过多肽桥重组双链dna结合域,可以显著降低重组t4连接酶对底物dna末端序列识别偏好性。其中的多肽桥从ggggs多肽、papapapa多肽、gqgqgqgq多肽、aaaaa多肽中选择,双链dna结合域从p50、ctf、dsba、h6、hns或hth中选择。
7.本发明还公开了上述重组t4连接酶突变体的编码dna,其核酸序列如seq id no.26
‑
42所示。
8.本发明还公开了一种ngs建库方法,其特征在于其步骤包括:(1)采用平末端双链dna片段化酶将dna片段化;(2)上述的重组t4连接酶突变体介导的腺苷酰化接头连接;(3)磁珠回收dna;(4)缺口修复;(5)文库扩增及回收。
9.优选的,步骤(1)中的平末端双链dna片段化酶为脱氧核糖核酸i、创伤弧菌核酸酶、全能核酸酶、微球菌核酸酶、热敏感性碱性磷酸酶或t4 dna聚合酶中的一种或数种的混合物。
10.优选的,步骤(1)的dna片段化反应温度为37℃,反应时间为3
‑
15 min。
11.优选的,步骤(2)中采用的接头为接头a和接头b的退火产物,所述接头a的序列为:/app/agatcggaagagcacacgtctgaactccagt/ddc/,接头b的序列为:acactctttccctacacgacgctcttccgatct
‑
p。
12.优选的,步骤(2)中接头反应的反应温度为20℃,反应时间为15 min。
13.优选的,步骤(4)中采用t4磷酸激酶和e.coli连接酶进行缺口修复。
14.本发明在野生型t4dl的基础上,进行了q19k、l63t、e88r、p127k、k159s、k225a、f233a、a237r、d371w、e440k、t451k、d452p等多个点突变;在突变体的两端包含两个双链dna结合域;双链dna结合域与t4dl之间的连接使用多肽桥。最终获得了一系列低偏好性和高效率的重组dna连接酶突变体t4dlm。t4dlm在平末端连接上具有显著的优势,连接效率高达95%,且偏好性极低。利用t4dlm开发了高效简便的新型ngs建库技术,具有耗时短、文库产量更高、均一性更好、文库自连更低、捕获测序数据覆盖深度更好等明显的优势,非常适用于临床样本的ngs检测,尤其是肿瘤样本的检测。
附图说明
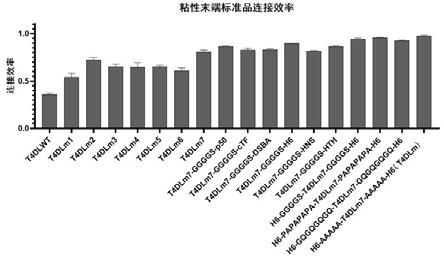
15.图1 t4连接酶重组突变体对粘性末端连接效率的测定。
16.图2 t4连接酶重组突变体对平末端连接效率的测定。
17.图3 t4连接酶重组突变体进行平末端连接建库的文库产量。
18.图4 t4连接酶重组突变体进行平末端连接建库的接头末端序列占比。
19.图5 t4连接酶重组突变体进行平末端连接建库的接头末端序列均一性。
20.图6 t4连接酶重组突变体进行平末端连接建库的dna末端序列占比。
21.图7 t4连接酶重组突变体进行平末端连接建库的dna末端序列均一性。
22.图8 基于t4dlm的简便高效的新型ngs建库流程及原理示意图。
23.图9 基于t4dlm的简便高效的新型ngs建库的凝胶电泳图。
24.图10 基于t4dlm的简便高效的新型ngs建库的文库产量。
25.图11 基于t4dlm的简便高效的新型ngs建库与传统ngs建库的文库产量比较。
26.图12 基于t4dlm的简便高效的新型ngs建库与传统ngs建库测序结果与理论值相关性比较。
27.图13 基于t4dlm的简便高效的新型ngs建库与传统ngs建库在捕获测序中的测序深度比较。
28.图14 基于t4dlm的简便高效的新型ngs建库与传统ngs建库在捕获测序中的捕获效率比较。
29.图15 基于t4dlm的简便高效的新型ngs建库与传统ngs建库在捕获测序中的捕获均一性比较。
具体实施方式
30.通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。本实施例所使用的探针和引物序列及修饰如表1所示,n为随机碱基,即a、t、c、g中任意一种碱基。
31.表1
序号序列名称5
’‑3’
修饰类型1p5
‑
conhensiveacactctttccctacacgacgctcttccgatcttcga5’端nh2c6修饰2p5
‑
bluntacactctttccctacacgacgctcttccgatct5’端nh2c6修饰3p
‑
p7agatcggaagagcacacgtctgaactccagtc5’端磷酸化修饰,3’端nh2c6修饰4app
‑
p7agatcggaagagcacacgtctgaactccagtc5’端app修饰,3’端nh2c6修饰5qpcr
‑
facactctttccctacacgacgctcttccgatct 6qpcr
‑
rgtgactggagttcagacgtgtgctcttccgatc 7umi
‑
adapotor
‑
f1acactctttccctacacgacgctcttccgatctaa3’端磷酸化修饰8umi
‑
adapotor
‑
f2acactctttccctacacgacgctcttccgatctag3’端磷酸化修饰9umi
‑
adapotor
‑
f3acactctttccctacacgacgctcttccgatctac3’端磷酸化修饰10umi
‑
adapotor
‑
f4acactctttccctacacgacgctcttccgatctat3’端磷酸化修饰11umi
‑
adapotor
‑
f5acactctttccctacacgacgctcttccgatctga3’端磷酸化修饰12umi
‑
adapotor
‑
f6acactctttccctacacgacgctcttccgatctgg3’端磷酸化修饰13umi
‑
adapotor
‑
f7acactctttccctacacgacgctcttccgatctgc3’端磷酸化修饰14umi
‑
adapotor
‑
f8acactctttccctacacgacgctcttccgatctgt3’端磷酸化修饰15umi
‑
adapotor
‑
f9acactctttccctacacgacgctcttccgatctca3’端磷酸化修饰16umi
‑
adapotor
‑
f10acactctttccctacacgacgctcttccgatctcg3’端磷酸化修饰17umi
‑
adapotor
‑
f11acactctttccctacacgacgctcttccgatctcc3’端磷酸化修饰18umi
‑
adapotor
‑
f12acactctttccctacacgacgctcttccgatctct3’端磷酸化修饰19umi
‑
adapotor
‑
f13acactctttccctacacgacgctcttccgatctta3’端磷酸化修饰20umi
‑
adapotor
‑
f14acactctttccctacacgacgctcttccgatcttg3’端磷酸化修饰21umi
‑
adapotor
‑
f15acactctttccctacacgacgctcttccgatcttc3’端磷酸化修饰22umi
‑
adapotor
‑
f16acactctttccctacacgacgctcttccgatcttt3’端磷酸化修饰23umi
‑
adapotor
‑
r1ttagatcggaagagcacacgtctgaactccagtc5’端app修饰,3’端nh2c6修饰24umi
‑
adapotor
‑
r2ctagatcggaagagcacacgtctgaactccagtc5’端app修饰,3’端nh2c6修饰25umi
‑
adapotor
‑
r3gtagatcggaagagcacacgtctgaactccagtc5’端app修饰,3’端nh2c6修饰26umi
‑
adapotor
‑
r4atagatcggaagagcacacgtctgaactccagtc5’端app修饰,3’端nh2c6修饰27umi
‑
adapotor
‑
r5tcagatcggaagagcacacgtctgaactccagtc5’端app修饰,3’端nh2c6修饰
76pcr
‑
f38cgggacgaactgtttcaaggcttct 77pcr
‑
f39cgcgacgaactgtttcaaggcttct 78pcr
‑
f40cgtgacgaactgtttcaaggcttct 79pcr
‑
f41ccagacgaactgtttcaaggcttct 80pcr
‑
f42ccggacgaactgtttcaaggcttct 81pcr
‑
f43cccgacgaactgtttcaaggcttct 82pcr
‑
f44cctgacgaactgtttcaaggcttct 83pcr
‑
f45ctagacgaactgtttcaaggcttct 84pcr
‑
f46ctggacgaactgtttcaaggcttct 85pcr
‑
f47ctcgacgaactgtttcaaggcttct 86pcr
‑
f48cttgacgaactgtttcaaggcttct 87pcr
‑
f49taagacgaactgtttcaaggcttct 88pcr
‑
f50taggacgaactgtttcaaggcttct 89pcr
‑
f51tacgacgaactgtttcaaggcttct 90pcr
‑
f52tatgacgaactgtttcaaggcttct 91pcr
‑
f53tgagacgaactgtttcaaggcttct 92pcr
‑
f54tgggacgaactgtttcaaggcttct 94pcr
‑
f55tgcgacgaactgtttcaaggcttct 95pcr
‑
f56tgtgacgaactgtttcaaggcttct 96pcr
‑
f57tcagacgaactgtttcaaggcttct 97pcr
‑
f58tcggacgaactgtttcaaggcttct 98pcr
‑
f59tccgacgaactgtttcaaggcttct 99pcr
‑
f60tctgacgaactgtttcaaggcttct 100pcr
‑
f61ttagacgaactgtttcaaggcttct 101pcr
‑
f62ttggacgaactgtttcaaggcttct 102pcr
‑
f63ttcgacgaactgtttcaaggcttct 103pcr
‑
f64tttgacgaactgtttcaaggcttct 104pcr
‑
rtggaatggagagccattcaac 实施例1:重组连接酶突变体的设计。
32.在本实施例中,我们利用大肠杆菌表达系统纯化了野生型t4 dna连接酶和重组突变体,包括:(1)野生型t4 dna连接酶t4dlwt,蛋白序列见seq no: 1,cdna序列见seq no: 25;(2)t4 dna连接酶突变体t4dlm1(q19k、l63t、e88r、p127k、k225a、f233a、a237r、d371w、e440k、t451k、d452p),蛋白序列见seq no: 2,cdna序列见seq no: 26;(3)t4 dna连接酶突变体t4dlm2(k159s),蛋白序列见seq no: 3,cdna序列见seq no: 27;(4)t4 dna连接酶突变体t4dlm3(k159l),蛋白序列见seq no: 4,cdna序列见seq no: 28;(5)t4 dna连接酶突变体t4dlm4(k159c),蛋白序列见seq no: 5,cdna序列见seq no: 29;(6)t4 dna连接酶突变体t4dlm5(k159a),蛋白序列见seq no: 6,cdna序列见seq no: 30;(7)t4 dna连接酶突变体t4dlm6(k159w),蛋白序列见seq no: 7,cdna序列见seq no: 31;
(8)t4 dna连接酶突变体t4dlm7(k159s、q19k、l63t、e88r、p127k、k225a、f233a、a237r、d371w、e440k、t451k、d452p),蛋白序列见seq no: 8,cdna序列见seq no: 32;(9)t4 dna连接酶重组突变体t4dlm7
‑
ggggs
‑
p50,蛋白序列见seq no: 15,cdna序列见seq no: 33;(10)t4 dna连接酶重组突变体t4dlm7
‑
ggggs
‑
ctf,蛋白序列见seq no: 16,cdna序列见seq no: 34;(11)t4 dna连接酶重组突变体t4dlm7
‑
ggggs
‑
dsba,蛋白序列见seq no: 17,cdna序列见seq no: 35;(12)t4 dna连接酶重组突变体t4dlm7
‑
ggggs
‑
h6,蛋白序列见seq no: 18,cdna序列见seq no: 36;(13)t4 dna连接酶重组突变体t4dlm7
‑
ggggs
‑
hns,蛋白序列见seq no: 19,cdna序列见seq no: 37;(14)t4 dna连接酶重组突变体t4dlm7
‑
ggggs
‑
hth,蛋白序列见seq no: 20,cdna序列见seq no: 38;(15)t4 dna连接酶重组突变体h6
‑
ggggs
‑
t4dlm7
‑
ggggs
‑
h6,蛋白序列见seq no: 21,cdna序列见seq no: 39;(16)t4 dna连接酶重组突变体h6
‑
papapapa
‑
t4dlm7
‑
papapapa
‑
h6,蛋白序列见seq no: 22,cdna序列见seq no: 40;(17)t4 dna连接酶重组突变体h6
‑
gqgqgqgq
‑
t4dlm7
‑
gqgqgqgq
‑
h6,蛋白序列见seq no: 23,cdna序列见seq no: 41;(18)t4 dna连接酶重组突变体h6
‑
aaaaa
‑
t4dlm7
‑
aaaaa
‑
h6(即为t4dlm),蛋白序列见seq no: 24,cdna序列见seq no: 42。
33.实施例2:粘性末端和平末端标准品的制备,在本实施例中,我们制备了用于t4 dna 连接酶连接效率测试的双链dna标准品片段。具体实施方式如下:用1
×
退火缓冲液(10 mm tris
‑
hcl(ph7.9),50 mm nacl)溶解各引物(表1的序号1
‑
4)。
34.磷酸化粘性末端:取50 ul 200 um p5
‑
conhensive和50 ul 200 um p
‑
p7。 85℃ 2 min,85
‑
15℃ 0.1℃/s,保存于15℃。
35.腺苷酰化粘性末端:取50 ul 200 um p5
‑
conhensive和50 ul 200 um app
‑
p7。 85℃ 2 min,85
‑
15℃ 0.1℃/s,保存于15℃。
36.磷酸化平末端:取50 ul 200 um p5
‑
blunt和50 ul 200 um p
‑
p7。 85℃ 2 min,85
‑
15℃ 0.1℃/s,保存于15℃。
37.腺苷酰化平末端:取50 ul 200 um p5
‑
blunt和50 ul 200 um app
‑
p7。 85℃ 2 min,85
‑
15℃ 0.1℃/s,保存于15℃。
38.其中磷酸化的粘性末端和平末端标准品主要应用于t4dlwt和t4dlm1的活性测试,其他腺苷酰化的粘性末端和平末端标准品主要用于其他重组t4 dna连接酶突变体的活性测试。
39.实施例3:重组连接酶突变体对粘性末端的连接效率测试。
40.在本实施例中,我们利用qpcr验证了重组连接酶突变体在粘性末端上的连接效率。具体实施方式如下:取10 ng退火好的磷酸化粘性末端dna标准品,在1
×
磷酸化接头连接酶缓冲液(50 mm tris
‑
hcl(ph 8.0),50 mm nacl,10 mm mgcl2,10 mm dtt,1 mm atp,6% peg8000)和1 ug t4dlwt或t4dlm1,20℃反应15 min。加水稀释100倍后,用qpcr
‑
f和qpcr
‑
r进行qpcr检测。
41.取10 ng退火好的腺苷酰化粘性末端dna标准品,在1
×
腺苷酰化接头连接酶缓冲液(50 mm tris
‑
hcl(ph 8.0),50 mm nacl,10 mm mgcl2,10 mm dtt,6% peg8000)和1 ug t4dlm2—6以及实施例1中(9
‑
18,seq id no:15
‑
24)的重组融合蛋白中的一种,20℃反应15 min。加水稀释100倍后,用qpcr
‑
f和qpcr
‑
r进行qpcr检测。
42.结果如图1所述,t4 dna连接酶突变体t4dlm1能够显著增强t4 dna连接酶对5’端磷酸化dna粘性末端底物的连接效率。当对k159位点进行突变后,t4 dna连接酶突变体能够显著增强5’端app修饰dna粘性末端底物的连接效率(t4dlm2
‑
6),其中k159s突变体(t4dlm2)效果最明显。组合t4dlm1和t4dlm2突变位点的t4dlm7突变体能够进一步提高t4dl对5’端app修饰dna粘性末端底物的连接效率。
43.在5’端app修饰dna粘性末端底物的连接效率上,融合双端双链dna结合域的重组t4dl突变体>融合单端双链dna结合域的重组t4dl突变体>未融合的t4dl突变体。双链dna结合域包括p50、ctf、dsba、h6、hns和hth,其中h6的效果最好。h6与t4dl中间的多肽桥可以使用ggggs多肽、papapapa多肽、gqgqgqgq多肽和aaaaa多肽,其中aaaaa多肽的效果最佳。
44.实施例4:重组连接酶突变体对平末端的连接效率测试。
45.在本实施例中,我们利用qpcr验证了重组连接酶突变体在平末端上的连接效率。具体实施方式如下:取10 ng退火好的磷酸化平末端dna标准品,在1
×
磷酸化接头连接酶缓冲液(50 mm tris
‑
hcl(ph 8.0),50 mm nacl,10 mm mgcl2,10 mm dtt,1 mm atp,6% peg8000)和1 ug t4dlwt或t4dlm1,20℃反应15 min。加水稀释100倍后,用qpcr
‑
f和qpcr
‑
r进行qpcr检测。
46.取10 ng退火好的腺苷酰化平末端dna标准品,在1
×
腺苷酰化接头连接酶缓冲液(50 mm tris
‑
hcl(ph 8.0),50 mm nacl,10 mm mgcl2,10 mm dtt,6% peg8000)和1 ug t4dlm2—6以及实施例1中(9
‑
18,seq id no:15
‑
24)的重组融合蛋白中的一种,20℃反应15 min。加水稀释100倍后,用qpcr
‑
f和qpcr
‑
r进行qpcr检测。
47.结果如图2所述,t4 dna连接酶突变体t4dlm1能够显著增强t4 dna连接酶对5’端磷酸化dna平末端底物的连接效率。当对k159位点进行突变后,t4 dna连接酶突变体能够非常显著增强5’端app修饰dna平末端底物的连接效率(t4dlm2
‑
6),其中k159s突变体(t4dlm2)效果最明显。组合t4dlm1和t4dlm2突变位点的t4dlm7突变体能够进一步提高t4dl对5’端app修饰dna平末端底物的连接效率。
48.在5’端app修饰dna平末端底物的连接效率上,融合双端双链dna结合域的重组t4dl突变体>融合单端双链dna结合域的重组t4dl突变体>未融合的t4dl突变体。双链dna结合域包括p50、ctf、dsba、h6、hns和hth,其中h6的效果最好。h6与t4dl中间的多肽桥可以使用ggggs多肽、papapapa多肽、gqgqgqgq多肽和aaaaa多肽,其中aaaaa多肽的效果最佳。
49.如图1和图2所示,融合双端双链dna结合域的重组t4dl突变体对平末端连接效率的增强效果要显著高于对粘性末端的连接效率。尽管野生型t4dl对粘性末端的连接效率(0.361)要明显高于平末端(0.115),改造后的t4dlm对平末端的连接效率(0.962)与粘性末端(0.971)差异不大。这说明经我们改造后的t4dlm对平末端接头的连接具有最佳的增强效果,能够有效解决平末端连接效率低的问题。
50.实施例5:平末端连接偏好性测试。
51.在本实施中,我们公布了基于t4dlm的简便高效的新型ngs建库技术,并用此方法测定了t4dlm2、t4dlm7和h6
‑
aaaaa
‑
t4dlm7
‑
aaaaa
‑
h6(t4dlm)的连接序列偏好性。具体实施方式如下:(1)制备具有多样化等分子量末端序列的pcr混合物dna标准品。我们设计了末端含有3个多样性碱基的pcr正向引物,共64种正向引物(见表1的pcr
‑
f1
‑
f64)。将64种pcr
‑
f分别与pcr
‑
r一一配对,扩增lambdadna。使用翌圣生物的高保真dna聚合酶预混液进行pcr扩增。将扩增产物使用0.6倍体积翌圣生物的dnaselectbeads进行pcr产物回收,回收后产物在qubit上测定回收dna产物浓度。并按照等质量混匀,获得具有相同分子数的64种不同3碱基末端的dna标准品。
52.(2)制备具有多样化等分子量末端序列的腺苷酰化双链dna接头。我们设计了末端含有2个多样性碱基的一一配对腺苷酰化接头,共16对引物(见表1的umi
‑
adaptor
‑
f1
‑
f16和umi
‑
adaptor
‑
r1
‑
r16)。将16种umi
‑
adaptor
‑
f分别与umi
‑
adaptor
‑
r一一配对,用1
×
退火缓冲液(10mmtris
‑
hcl(ph7.9),50mmnacl)溶解各引物至100um,将对应的umi
‑
adaptor
‑
f分别与umi
‑
adaptor
‑
r等体积混匀,85℃2min,85
‑
15℃0.1℃/s,保存于15℃。将退火好的接头使用1
×
退火缓冲液稀释成10um备用。
53.(3)t4dl突变体介导的腺苷酰化接头连接。取步骤(1)中制备好的具有多样化末端的dna标准品20ng,加入步骤(2)中制备好的具有多样化末端的腺苷酰化接头5ul,在1
×
腺苷酰化接头连接酶缓冲液(50mmtris
‑
hcl(ph8.0),50mmnacl,10mmmgcl2,10mmdtt,6%peg8000)和1ugt4dlm2—6以及实施例1中(9
‑
18,seqidno:15
‑
24)的重组融合蛋白中的一种,20℃反应15min。
54.(4)磁珠回收dna。在反应体系中加入0.6倍体积的翌圣生物dna回收磁珠,混匀后置于室温孵育5min。将pcr管置于磁力架上,待溶液澄清后,吸去上清,加入200ul新鲜配制的70%乙醇清洗2次后,室温晾3min。
55.(5)缺口修复。使用10ul缺口修复反应液(20mm三羟甲基氨基甲烷、5mm氯化镁、0.2mm烟酰胺腺嘌呤二核苷酸(氧化型)、10mm三磷酸腺苷、10ut4pnk和10ue.coli连接酶)悬浮磁珠,37℃反应15min后,98℃2min,离心取上清。
56.(6)文库扩增及回收。使用翌圣生物的dna建库试剂盒中的2
×
高保真酶预混液和illuminaindex引物进行文库扩增。扩增程序见说明书,7个扩增循环。扩增结束后,在反应体系中加入0.8倍体积的翌圣生物dna回收磁珠,混匀后置于室温孵育5min。将pcr管置于磁力架上,待溶液澄清后,吸去上清,加入200ul新鲜配制的70%乙醇清洗2次后,室温晾3min。使用22ulddh2o悬浮磁珠,室温静置5min后,将pcr管置于磁力架上,待溶液澄清后,吸取20ul上清。qubit测定文库浓度后,在novaseq6000进行文库测序。
57.文库产量如图3所述,融合了双链dna结合域的t4dl重组突变体能够显著提高dna
文库的产量。我们分析了t4dl对腺苷酰化接头的平末端序列偏好性,发现t4dl k159突变体均具有极严重的gc偏好性,连接gc末端接头的效率和占比是at末端接头效率的10倍以上,这极大了限制了t4dl k159均突变体在dna平末端连接建库上的使用(图4)。我们将t4dl突变体两端融合上双链dna结合域后,偏好性得到了明显的改善,尤其是h6结构域最佳,且结构域与t4dl 突变体的连接多肽桥aaaaa使用时效果最好,连接gc末端接头的效率和占比与at末端接头效率变化波动不超过2倍(图4)。我们对接头连接偏好性用均一性进行量化分析,结果见图5,我们改造后的t4dl重组突变体能够将连接均一性提高10倍以上。这证明我们的改造方向既可以提高连接效率和文库产量,又可以显著改善连接均一性,有效降低由连接造成的建库偏好性。
58.此外,我们也分析了t4dl重组突变体对dna平末端序列的偏好性,结果显示与t4dl突变体对接头末端序列的偏好性类似,t4dl突变体对dna平末端也表现出很明显的gc偏好性,改造后的t4dlm能够有效去除这种gc偏好性(图6)。我们同样对dna末端偏好性用均一性进行量化分析,结果见图7,我们改造后的t4dl重组突变体能够将连接均一性提高10倍以上。这证明我们的改造方向能够显著降低连接酶对底物dna末端序列识别偏好性。
59.实施例6:基于t4dlm的简便高效的新型ngs建库技术在本实施中,我们公布了基于t4dlm的简便高效的新型ngs建库技术(示意图8),整个过程低于2 h,操作简便、连接效率和建库产量更高。具体实施方式如下:(1)dna片段化。使用表2的片段化酶反应体系:20 ng dna在60 ul体系中进行片段化。
60.表2 片段化体系组成。
61.片段化体系1:50 mm tris
‑
hcl,50 mm nacl,2 mm mgcl2,0.5 u脱氧核糖核酸i (neb),1 u热敏感性碱性磷酸酶(thermofisher)和1 u t4 dna聚合酶(neb)。
62.片段化体系2:50 mm tris
‑
hcl,50 mm nacl,2 mm mgcl2,0.5 u创伤弧菌核酸酶(neb),1 u热敏感性碱性磷酸酶(thermofisher)和1 u t4 dna聚合酶(neb)。
63.片段化体系3:50 mm tris
‑
hcl,50 mm nacl,2 mm mgcl2,0.5 u全能核酸酶(neb),1 u热敏感性碱性磷酸酶(thermofisher)和1 u t4 dna聚合酶(neb)。
64.片段化体系4:50 mm tris
‑
hcl,50 mm nacl,2 mm mgcl2,0.5 u微球菌核酸酶(neb),1 u热敏感性碱性磷酸酶(thermofisher)和1 u t4 dna聚合酶(neb)。
65.(2)t4dl突变体介导的腺苷酰化接头连接。加入实施例5步骤(2)中制备好的具有多样化末端的腺苷酰化接头 5 ul,在30 ul腺苷酰化接头连接酶缓冲液(66.7 mm tris
‑
hcl(ph 8.0),66.7 mm nacl,30 mm mgcl2,30 mm dtt,20% peg8000)和1 ug t4dlm2—6以及实施例1中(9
‑
18,seq id no:15
‑
24)的重组融合蛋白中的一种,20℃反应15 min。
66.(3)磁珠回收dna。在反应体系中加入0.6倍体积的翌圣生物dna回收磁珠,混匀后置于室温孵育5 min。将pcr管置于磁力架上,待溶液澄清后,吸去上清,加入200 ul新鲜配制的70%乙醇清洗2次后,室温晾3 min。
67.(4)缺口修复。使用10 ul 缺口修复反应液(20 mm三羟甲基氨基甲烷、5 mm氯化镁、0.2 mm烟酰胺腺嘌呤二核苷酸(氧化型)、10 mm三磷酸腺苷、10 u t4 pnk和10 u e.coli连接酶)悬浮磁珠,37℃反应15 min后,98℃ 2 min,离心取上清。
68.(5)文库扩增及回收。使用翌圣生物的dna建库试剂盒中的2
×
高保真酶预混液和
illumina index引物进行文库扩增。扩增程序见说明书,7个扩增循环。扩增结束后,在反应体系中加入0.8倍体积的翌圣生物dna回收磁珠,混匀后置于室温孵育5 min。将pcr管置于磁力架上,待溶液澄清后,吸去上清,加入200 ul新鲜配制的70%乙醇清洗2次后,室温晾3 min。使用22 ul ddh2o悬浮磁珠,室温静置5 min后,将pcr管置于磁力架上,待溶液澄清后,吸取20 ul上清。qubit测定文库浓度后,在novaseq 6000进行文库测序。
69.结果如图9
‑
图10所示,使用片段化酶体系4具有更好的片段化效果和文库产量。
70.实施例7:基于t4dlm的简便高效的新型ngs建库技术与传统dna建库性能对比在本实施例中,我们对比了不同dna投入量的两种建库方法性能对比。我们将人类基因组dna、酵母基因组dna和大肠杆菌基因组dna按照10:3:1的质量比例进行混合,获得具有复杂物种的dna标准品。基于t4dlm的简便高效的新型ngs建库技术具体实施方式见实施例6,传统dna建库具体实施方式按照neb的酶切法dna建库试剂盒进行建库。获得的文库经qubit测定dna浓度后,在illumina novaseq 6000测序平台上进行测序。同时,将获得的文库利用idt的杂交基因捕获试剂盒进行xgen inherited diseases panel的捕获测序,分析不同建库方法获得文库的捕获特异性、深度、均一性和效率。
71.文库产量如图11所示,基于t4dlm的新型ngs建库技术比传统dna建库具有更高的文库产量,这说明基于t4dlm的新型ngs建库技术对dna模板的利用率更高。图12的相关性结果表明基于t4dlm的新型ngs建库技术获得的数据与dna模板中的理论各dna投入比具有更好的相关性。我们利用基因捕获测序验证了模板利用率效果,结果显示基于t4dlm的新型ngs建库技术在基因捕获测序结果上具有更好的测序深度、捕获效率和均一性(图13
‑
图15)。这些结果表明基于t4dlm的新型ngs建库技术具有更低的建库偏好性和更高的建库效率。
72.综上,我们开发了一款新型的重组t4 dna连接酶突变体,在野生型t4dl(seq no: 1)上,进行了q19k、l63t、e88r、p127k、k159s、k225a、f233a、a237r、d371w、e440k、t451k、d452p等多个点突变;在突变体的两端包含两个双链dna结合域;双链dna结合域与t4dl之间的连接使用多肽桥。最终获得了一种低偏好性和高效率的重组dna连接酶突变体t4dlm。t4dlm在平末端连接上具有显著的优势,连接效率高达95%,且偏好性极低。我们利用t4dlm开发了高效简便的新型ngs建库技术,具有耗时短、文库产量更高、均一性更好、文库自连更低、捕获测序数据覆盖深度更好等明显的优势,非常适用于临床样本的ngs检测,尤其是肿瘤样本的检测。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1