一种具有高免疫调节能力的外泌体的培养方法与流程
1.本发明属于生物医药技术领域,尤其涉及一种具有高免疫调节能力的外泌体的培养方法。
背景技术:
2.外泌体是细胞分泌到胞外的一种囊泡,其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物,包括核酸、蛋白和脂质等,参与细胞间的分子传递。外泌体广泛存在于细胞培养上清以及各种体液中,包括血液、淋巴液、唾液、尿液、精液、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。外泌体可通过细胞膜受体直接激活受体细胞,也可运输蛋白质、mrna、mirna、lncrna,甚至细胞器进入受体细胞,参与细胞间通讯。
3.外泌体具有免疫调节的能力主要是因为外泌体内部富含众多的生物活性分子,如趋化因子、炎症 因子、信号转导因子、热休克蛋白、细胞特异性抗原、mrna、mirna、lncrna 等,且表面携带有特殊功能的蛋白,如黏附分子、共刺激分子、配体、受体等,外泌体将以上这些成分作为信号分子,以表面信号分子的直接作用、膜融合时信号分子的胞内调节以及生物活性成分的胞外释放三种方式传递给靶细胞,从而改变靶细胞的功能或基因表达,实现免疫抑制或免疫激活的作用。研究发现间充质干细胞起源的外泌体具有调节免疫因子的作用,一方面可以抑制il-1β和tnf-β等促炎症因子的分泌,另一方面也能够提高抗炎因子tgf-β的分泌。同时间充质干细胞起源的外泌体还可以促进效应t细胞向treg细胞转化,提高treg细胞的比例,并提高treg细胞中ctla-4的表达水平。但是由于不同组织来源、不同个体来源、不同批次的间充质干细胞质量差异较大,使得获得的外泌体的免疫调节能力不同。
技术实现要素:
4.针对现有技术中存在的问题,本发明提供了一种具有高免疫调节能力的外泌体的培养方法。
5.为实现上述发明目的,本发明采用下述技术方案予以实现:一种具有高免疫调节能力的外泌体的培养方法,包括如下步骤:(1)将分离获得的间充质干细胞接种于含有10%胎牛血清的α-mem培养基中培养12-24h;(2)将上述步骤(1)中的培养基更换为含有10%胎牛血清和蛋白因子组合体的α-mem培养基中培养48-72h;所述蛋白因子组合体为前列腺素 e2、肿瘤坏死因子-α和干扰素-γ;所述α-mem培养基于37℃,浓度为5 %的co2培养箱中培养;(3)待上述步骤(2)中间充质干细胞的细胞融合度达到80%时,更换为不含血清的α-mem培养基,收集细胞培养液上清,离心后弃上清,所得沉淀为外泌体,用pbs重悬外泌体。
6.优选地,所述间充质干细胞选自骨髓间充质干细胞、脂肪间充质干细胞、滑膜间充
质干细胞或脐带间充质干细胞中的任一种。
7.优选地,所述步骤(1)中间充质干细胞的培养方法为将分离获得的原代间充质干细胞接种于含有10%胎牛血清的α-mem,于37℃,浓度为5 %的co2培养箱中培养,待细胞融合度为80-85%时,用0.20%胰酶消化传代。
8.优选地,所述步骤(1)中间充质干细胞为p5代。
9.优选地,所述步骤(2)中前列腺素 e2的浓度为1-5μg/ml;肿瘤坏死因子-α的浓度为10-20ng/ml;干扰素-γ的浓度为10-20ng/ml。间充质干细胞可以产生一些可溶性因子介导免疫应答,这些因子包括前列腺素 e2,肿瘤坏死因子,干扰素-γ等,并且以协同作用的方式发挥作用。此外,低浓度的因子对间充质干细胞的影响显著,高浓度的因子会诱导细胞衰老和死亡。
10.优选地,所述步骤(3)中间充质干细胞在不含血清的α-mem培养基于37℃,浓度为5 %的co2培养箱中培养,孵箱中孵育72小时。
11.优选地,所述步骤(3)中离心步骤为:上清在4℃离心机进行以下梯度离心,800
×
g离心5分钟;2000
×
g离心10分钟;16000
×
g离心30分钟;150000
×
g离心90分钟,弃上清,加入pbs洗一次,150000
×
g再次离心90分钟。
12.一种有高免疫调节能力的外泌体,所述外泌体由上述培养方法培养而成。
13.一种上述具有高免疫调节能力的外泌体在提高免疫调节能力的药物中的应用。
14.相对于现有技术,本发明的有益效果在于:本发明提供一种具有高免疫调节能力的外泌体的培养方法,通过前列腺素 e2、肿瘤坏死因子-α和干扰素-γ蛋白因子组合体预处理间充质干细胞,增强间充质干细胞的免疫调节能力,克服由于来源不同、细胞分离扩增的不同,细胞质量存在差异,然后由该间充质干细胞细胞提取外泌体,增强外泌体的免疫调节能力。
附图说明
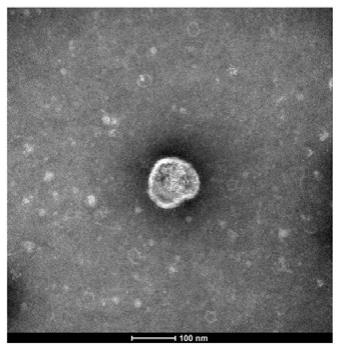
15.图1为本发明实施例1中制备的外泌体的电镜图片;图2为不同条件下treg细胞的表达情况。
具体实施方式
16.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
17.实施例1:具有高免疫调节能力的外泌体的培养方法一、间充质干细胞的分离培养将脐带组织从采集瓶取出,置于酒精中清洗 2 次转入无菌 pbs 去除结缔组织、淤血等,之后充分清洗,去除血污。将脐带转入大号培养皿中,剪断成 3-4cm 长度之后沿纵向进行分离,是脐带组织管状变为片状。将片状脐带组织进行进一步的分离,切割为 2-3mm3大小的组织块,将组织块逐一种植到预先以含10 %胎牛血清的α-mem培养基包被的培养皿中,置于37 ℃,体积分数为5 % co2饱和湿度培养箱中,每24小时补加0.5 ml培养基,72小时后全量换液,每周换液 2 次,细胞生长融合至80-85%时,用0.20%胰蛋白酶消化传代。
18.二、预处理间充质干细胞取上述传代至p5代的间充质干细胞以105个/ml接种至含有10%胎牛血清的α-mem培养基中,置于37 ℃,体积分数为5 % co2饱和湿度培养箱中培养12小时,然后将培养基更换为含有10%胎牛血清和1μg/ml前列腺素 e2,10ng/ml肿瘤坏死因子-α,10ng/ml干扰素-γ的α-mem培养液进行培养,置于37 ℃,体积分数为5 % co2饱和湿度培养箱中培养48-72小时。
19.三、提取外泌体待上述的间充质干细胞的细胞融合度为达到约80%时,更换为不含血清的α-mem培养基,在37℃孵箱中孵育72小时后收集细胞培养液上清;上清在4℃离心机进行以下梯度离心,800
×
g离心5分钟;2000
×
g离心10分钟;16000
×
g离心30分钟;150000
×
g离心90分钟,弃上清,加入pbs洗一次,150000
×
g再次离心90分钟,弃上清,所获的沉淀为具有高免疫调节能力的外泌体,用pbs重悬外泌体。
20.图1为制备的外泌体的电镜图片,将提取的外泌体按照1:20倍稀释后去10ul,滴加在电镜铜网上,放入65℃烤箱,30分钟,烤干后标记磷钨酸,自然晾干后进行透射电镜观察,如图所示外泌体呈现类似于圆形,可见明显的双层膜结构,直径为100 纳米。
21.实施例2:外泌体处理cd4+t细胞后对treg细胞的影响分离外周血淋巴细胞,磁珠分选cd4+t细胞。分为三组,空白对照组为单独的t细胞,对照组将未加组合蛋白因子的间充质干细胞来源的外泌体与t细胞共培养,实验组将实施例1中外泌体与t细胞共培养。72h后流失细胞数检测treg细胞的百分比。
22.图2为treg细胞的表达情况,由图可知实验组和对照组的外泌体均可以促进t细胞向treg细胞的转化,但是实验组促进作用增加明显。
23.以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,任何在本技术揭露的技术范围内的变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1