一种微生物制剂、其制备方法及应用与流程
1.本发明属于微生物制剂技术领域,具体涉及一种降解霉菌毒素的制剂、制备方法、应用。
背景技术:
2.霉菌毒素主要是指霉菌在其所污染的食品中产生的有毒代谢产物,它们可通过饲料进入动物体内,是一种存在饲料和原料中的抗营养因子,是毒素很强的霉菌次生代谢产物。在饲料的加工、运输和贮存过程中都会产生霉菌毒素,引起动物的急性或慢性毒性,损害机体的肝脏、肾脏、神经组织、造血组织及皮肤组织等。据统计,己知的霉菌毒素有300多种,其中以黄曲霉毒素、玉米赤霉烯酮、t-2毒素、赭曲霉毒素、呕吐毒素、伏马菌素毒性最大、分布最广、产毒量最高。
3.迄今为止,脱除黄曲霉毒素的方法主要是化学脱毒、物理脱毒和生物脱毒(生物吸附法、生物降解法)。其中,化学脱毒的方法主要采用氧化剂或强碱进行脱毒。物理脱毒方法主要包括吸附剂水洗法、吸附法、溶剂提取法、加热去毒法、紫外线去毒法、脱胚去毒法等,其中最常用的是吸附剂吸附法。然而,上述两种方法存在脱毒效果不稳定、不完全的缺陷,而且会导致营养物质和微量元素的流失、适口性差等缺点。生物吸附法主要是微生物通过细胞壁吸附毒素,是一个可逆的过程,虽然能有效吸附毒素,但随着培养时间的延长,部分毒素会重新释放。生物降解法脱毒是以微生物产生的次级代谢产物分解破坏霉菌毒素,并产生低毒或者无毒的降解产物。
4.因此,研制一种有效脱除霉菌毒素,且有助于牲畜消化吸收的饲用微生物制剂显得尤为重要。
技术实现要素:
5.本发明为解决上述技术问题,提供了一种有效降解霉菌毒素的制剂、饲料、及其制备方法。
6.本发明首先提供一种微生物制剂,包括枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、干酪乳杆菌、地衣芽孢杆菌、长双歧杆菌。
7.优选地,所述微生物制剂中,所述枯草芽孢杆菌活菌数为5-10
×
10
10
cfu/g,所述凝结芽孢杆菌活菌数为4-10
×
10
10
cfu/g,所述产朊假丝酵母活菌数为1-10
×
10
10
cfu/g,所述产朊假丝酵母活菌数为1-10
×
10
10
cfu/g,所述干酪乳杆菌活菌数为1-10
×
10
10
cfu/g,所述地衣芽孢杆菌活菌数为1-10
×
10
10
cfu/g,所述长双歧杆菌活菌数为1-10
×
10
10
cfu/g。
8.优选地,所述微生物制剂中枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重百分比为:(10%-50%):(10%-50%):(10%-50%):(10%-50%):(10%-50%):(10%-50%);优选地,凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重百分比为:(20%-50%):(20%-50%):(10%-30%):(10%-30%):(10%-30%):(10%-30%)。
9.优选地,在微生物制剂中至少还包括两歧双歧杆菌、粪肠球菌、屎肠球菌、乳酸肠球菌、嗜酸乳杆菌、干酪乳杆菌、德式乳杆菌乳酸亚种、植物乳杆菌、乳酸片球菌、戊糖片球菌、酿酒酵母、沼泽红假单胞菌、婴儿双歧杆菌、短双歧杆菌、青春双歧杆菌、嗜热链球菌、罗伊氏乳杆菌、动物双歧杆菌、黑曲霉、米曲霉、迟缓芽孢杆菌、短小芽孢杆菌、纤维二糖乳杆菌、发酵乳杆菌、德氏乳杆菌保加利亚亚种中的一种。
10.本发明还提出一种微生物制剂的制备方法,包括以下步骤:步骤一、分别将枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、干酪乳杆菌、地衣芽孢杆菌、长双歧杆菌接种于已灭菌处理过的平板培养基上,其中,用于接种枯草芽孢杆菌的平板培养基中加入香豆素、赭曲霉毒素、玉米赤霉烯酮;步骤二、分别将枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、干酪乳杆菌、地衣芽孢杆菌、长双歧杆菌接种于已灭菌处理的液体培养基中;步骤三、分别将枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、地衣芽孢杆菌、干酪乳杆菌、长双歧杆菌进行发酵罐扩大培养;步骤四、将步骤三中获得的菌离心,取菌泥,低温悬浮烘干或冷冻干燥,得到菌粉;步骤五、将步骤四所得菌粉分别与生理上可接受的载体混合均匀,菌粉与生理上可接受的载体的重量比为1:1-1:10;优选地,所述生理上可接受的载体为麦芽糖糊精、环糊精、淀粉、滑石粉、蒙脱石中的一种或两种以上;步骤六、将步骤五所得菌粉混和物进行混合,按照枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重百分比为:(10%-50%):(10%-50%):(10%-50%):(10%-50%):(10%-50%):(10%-50%);优选地,凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重百分比为:(20%-50%):(20%-50%):(10%-30%):(10%-30%):(10%-30%):(10%-30%)。
11.优选地,所述微生物制剂的制备方法步骤一中,香豆素、赭曲霉毒素、玉米赤霉烯酮的用量分别为每千克平板培养基中加入1-20μg,1-20μg,1-20μg;优选地,香豆素、赭曲霉毒素、玉米赤霉烯酮的用量分别为每千克平板培养基中加入5-15μg,5-15μg,5-15μg。
12.优选地,所述微生物制剂的制备方法步骤二中:枯草芽孢杆菌的培养条件为:培养基:淀粉5-15 g/l,牛肉膏 1-5g/l,蛋白胨 5-15 g/l,nacl 1-8 g/l,海藻粉10-200 g/l,ph7.0;25-40℃ 培养10-30h;凝结芽孢杆菌的培养条件为:培养基:葡萄糖10-20 g/l,蛋白胨10-20 g/l,酵母粉5-15 g/l,硫酸镁2-10 g/l,海藻粉10-200 g/l,ph 7.5;30-40℃ 培养10-30h;产朊假丝酵母的培养条件为:培养基:葡萄糖10-25 g/l,蛋白胨5-15 g/l,酵母浸膏1-10 g/l,海藻粉10-200 g/l ,ph 4.5~6.5; 25-30℃培养10-30h;干酪乳杆菌的培养条件为:培养基:脱脂乳60-120 g/l ,乳清粉10-30 g/l ,酵母膏5-20 g/l ,磷酸氢二胺1-10 g/l ,ph在 6. 0~7.0;30-40℃ 培养20-50h;地衣芽孢杆菌的培养基为:牛肉膏1-10g/l,蛋白胨5-15 g/l ,nac1 1-10g/l,ph7.0-8.0,海藻粉10-200 g/l, 30-40℃ 培养20-40h;长双歧杆菌的培养基为:蛋白胨5-15g/l,酪蛋白胨1-10 g/l,乳糖1-6 g/l,酵母浸膏1-10g/l,低聚糖1-6 g/l,海藻粉10-200 g/l,ph 6~7,30-40℃ 培养20-40h;优选地,所述微生物制剂的制备方法步骤三中:
枯草芽孢杆菌的发酵条件为:培养基:葡萄糖15-25g/l,蛋白胨5-15g/l,氯化钠1-8g/l,海藻粉10-200 g/l,ph=7.2~7.5;25-40℃ 培养20-50h;凝结芽孢杆菌的发酵条件为:培养基:淀粉5-15g/l,玉米浆1-10g/l,蛋白胨5-15g/l,k2hpo41-5 g/l,mgso40.1-1 g/l,海藻粉10-200 g/l,ph 7.5;30-40℃ 培养20-50h;产朊假丝酵母的发酵条件为:培养基:葡萄糖15-25g/l,蛋白胨5-15g/l,酵母浸膏1-10g/l,海藻粉10-200 g/l,ph 4.5~6.5;25-30℃培养20-50h;干酪乳杆菌的发酵条件为:培养基:脱脂乳60-120 g/l ,乳清粉10-30 g/l ,酵母膏5-20 g/l ,磷酸氢二胺1-10 g/l ,ph在 6. 3~6. 6;30-40℃ 培养40-80h;地衣芽孢杆菌的发酵条件为:培养基:蛋白胨1-10 g/l,酵母浸膏5-15 g/l,氯化钠1-10 g/l,淀粉1-10 g/l,海藻粉10-200 g/l,ph7.5;30-40℃ 培养20-40h;长双歧杆菌的发酵条件为:培养基:蛋白胨5-15 g/l,酪蛋白胨1-10 g/l,乳糖1-6 g/l,酵母浸膏1-10 g/l,低聚糖1-6 g/l,海藻粉10-200 g/l,ph 6~7,30-40℃ 培养20-40h。
13.优选地,所述微生物制剂的制备方法步骤三中:枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、地衣芽孢杆菌、干酪乳杆菌、长双歧杆菌的接种量分别为1-10%、1-10%、1-10%、1-10%、1-10%、1-10%。
14.本发明还提供一种饲料或添加剂,在该饲料或添加剂添加上述微生物制剂。
15.本发明提供了上述微生物制剂在脱除霉菌毒素中的应用,优选地,在脱除黄曲霉毒素、玉米赤霉烯酮、t-2毒素、赭曲霉毒素、呕吐毒素、伏马菌素中的应用。
16.本发明还提供一种脱除霉菌毒素的方法,该方法包括:向待处理样品中加入上述降解黄曲霉毒素的微生物制剂或添加剂,在ph值为6-7.5,25-40℃下进行发酵10-100h;所述降解黄曲霉毒素的微生物制剂或添加剂用量为每千克样品中加入0.01-30g所述降解黄曲霉毒素的微生物制剂或添加剂。
17.本发明采用复合益生菌组合,降解法及吸附法协同脱除霉菌毒素,尤其是黄曲霉毒素、玉米赤霉烯酮、t-2毒素、赭曲霉毒素、呕吐毒素、伏马菌素。且能够满足在促进动物肠道菌群平衡和降解饲料中的霉菌毒素两个方面保障养殖生产的要求。
具体实施方式
18.以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
19.实施例1 菌粉的制备步骤一、分别将枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、干酪乳杆菌、地衣芽孢杆菌、长双歧杆菌接种于已灭菌处理过的平板培养基上,其中,用于接种枯草芽孢杆菌的平板培养基中加入香豆素、赭曲霉毒素、玉米赤霉烯酮的用量分别为每千克平板培养基中加入5μg,5μg,5μg;步骤二、分别将枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、干酪乳杆菌、地衣芽孢杆菌、长双歧杆菌接种于已灭菌处理的液体培养基中;枯草芽孢杆菌的培养条件为:培养基:淀粉10.0 g/l,牛肉膏3.0g/l,蛋白胨10 g/
l,nacl 5.0g/l,海藻粉50g/l,ph7.0;37℃ 培养28h;凝结芽孢杆菌的培养条件为:培养基:葡萄糖15 g/l,蛋白胨15 g/l,酵母粉10 g/l,硫酸镁3.0g/l,海藻粉50 g/l,ph 7.5;37℃ 培养28h;产朊假丝酵母的培养条件为:培养基:葡萄糖20 g/l,蛋白胨10 g/l,酵母浸膏5 g/l,海藻粉50 g/l ,ph 6.0; 37℃培养28h;干酪乳杆菌的培养条件为:培养基:脱脂乳100 g/l ,乳清粉20g/l ,酵母膏10g/l ,磷酸氢二胺5.0 g/l ,ph在 6.0;37℃ 培养37h;地衣芽孢杆菌的培养基为:牛肉膏5.0g/l,蛋白胨10.0g/l ,nac15.0g/l,海藻粉50 g/l,ph8.0,30℃ 培养28h;长双歧杆菌的培养基为:蛋白胨10.0g/l,酪蛋白胨5.0 g/l,乳糖3.0g/l,酵母浸膏5.0g/l,低聚糖3.0g/l,海藻粉50 g/l,ph 6.5,37℃ 培养28h;步骤三、分别将枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、地衣芽孢杆菌、干酪乳杆菌、长双歧杆菌进行发酵罐扩大培养;枯草芽孢杆菌、凝结芽孢杆菌、产朊假丝酵母、地衣芽孢杆菌、干酪乳杆菌、长双歧杆菌的接种量分别为8%、8%、6%、8%、8%、8%;枯草芽孢杆菌的发酵条件为:培养基:葡萄糖20.0g/l,蛋白胨10.0g/l,氯化钠4.0g/l,海藻粉60g/l,ph=7.0;37℃ 培养50h;凝结芽孢杆菌的发酵条件为:培养基:淀粉10.0g/l,玉米浆5.0g/l,蛋白胨10.0g/l,k2hpo43.0 g/l,mgso40.5 g/l,海藻粉60 g/l,ph 7.5,37℃ 培养50h;产朊假丝酵母的发酵条件为:培养基:葡萄糖20.0g/l,蛋白胨10.0g/l,酵母浸膏5.0g/l,海藻粉60g/l, ph 4.5~6.5;25℃培养48h;干酪乳杆菌的发酵条件为:培养基:脱脂乳100.0 g/l ,乳清粉20.0 g/l ,酵母膏10.0g/l ,磷酸氢二胺5.0 g/l ,ph在 6. 5;37℃ 培养72h;地衣芽孢杆菌的发酵条件为:培养基:蛋白胨10.0g/l,酵母浸膏10.0 g/l,氯化钠5.0g/l,淀粉5.0 g/l,海藻粉60 g/l,ph7.5;37℃ 培养25h;长双歧杆菌的发酵条件为:培养基:蛋白胨10.0 g/l,酪蛋白胨5.0 g/l,乳糖3.0g/l,酵母浸膏5.0g/l,低聚糖3.0 g/l,海藻粉60.0g/l,ph 6.5,37℃ 培养32h。
20.步骤四、将步骤三中获得的菌离心,取菌泥,低温悬浮烘干,得到菌粉;步骤五、将步骤四所得菌粉分别与麦芽糖糊精和环糊精混合均匀,重量比例为:1:0.5:0.5。
21.实施例2 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:50%:10%:10%:10%:10%:10%。
22.实施例3 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:10%:50%:10%:10%:10%:10%。
23.实施例4 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:10%:10%:50%:10%:10%:10%。
24.实施例5 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:10%:10%:10%:50%:10%:10%。
25.实施例6 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:10%:10%:10%:10%:50%:10%。
26.实施例7 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:10%:10%:10%:10%:10%:50%。
27.实施例8 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:30%:30%:10%:10%:10%:10%。
28.实施例9 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:30%:10%:30%:10%:10%:10%。
29.实施例10 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:30%:10%:10%:30%:10%:10%。
30.实施例11 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:30%:10%:10%:10%:30%:10%。
31.实施例12 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:30%:10%:10%:10%:10%:30%。
32.实施例13 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:20%:20%:30%:10%:10%:10%。
33.实施例14 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:20%:20%:10%:30%:10%:10%。
34.实施例15 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:20%:20%:10%:10%:30%:10%。
35.实施例16 微生物制剂的制备将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:20%:20%:10%:10%:10%:30%。
36.对比例1将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:75%:5%:5%:5%:5%:5%。
37.对比例2将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:5%:75%:5%:5%:5%:5%。
38.对比例3将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:5%:5%:75%:5%:5%:5%。
39.对比例4将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:5%:5%:5%:75%:5%:5%。
40.对比例5将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:5%:5%:5%:5%:75%:5%。
41.对比例6将实施例1所得菌粉进行混合,枯草芽孢杆菌:凝结芽孢杆菌:产朊假丝酵母:干酪乳杆菌:地衣芽孢杆菌:长双歧杆菌干重比为:5%:5%:5%:5%:5%:75%。
42.应用实施例1 脱除霉菌毒素分别向培养基(葡萄糖15 g/l,蛋白胨15 g/l,硫酸镁3.0g/l,牛肉膏3.0g/l)中加入实施例2-16、对比例1-6所制备的微生物制剂(微生物制剂用量均为2g每1kg培养基);分别将黄曲霉毒素b1、玉米赤霉烯酮、呕吐毒素、t-2毒素、伏马菌素b1、赭曲霉毒素a溶解后加入上述培养基中,使黄曲霉毒素b1、玉米赤霉烯酮、呕吐毒素、赭t-2毒素、伏马菌素b1、赭曲霉毒素a的最终浓度分别为20μg/kg。在ph值为7.0, 37℃条件下发酵72h后,用高效液相色谱法检测发酵液中黄曲霉毒素b 1、玉米赤霉烯酮、呕吐毒素、赭曲霉毒素、t-2毒素、伏马菌素b1、赭曲霉毒素a的浓度,计算霉菌毒素脱除率。
43.霉菌毒素脱除率=(样品中毒素初始浓度-处理后样品中毒素浓度)/样品中毒素初始 浓度
×
100% 式。
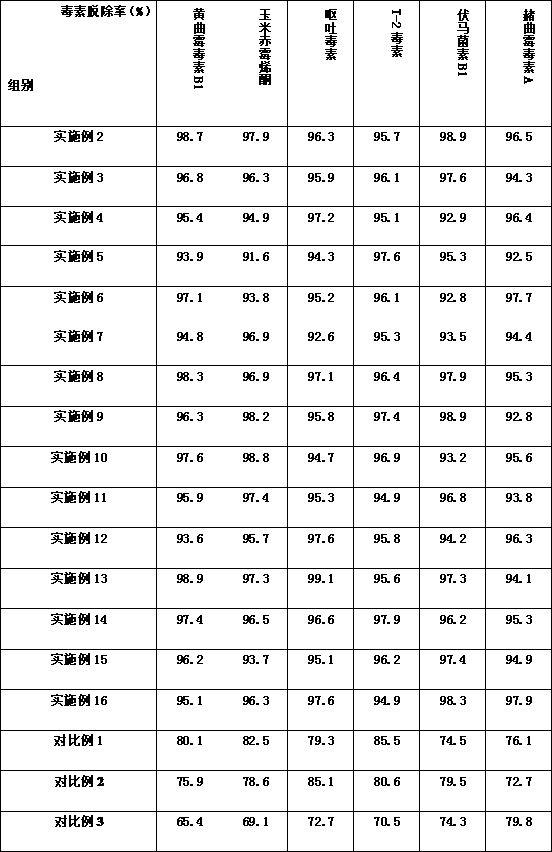
44.表1实施例2-16、对比例1-6所制备的微生物制剂脱出霉菌毒素效果
通过上述霉菌毒素对比可以看出,实施例2-16制备的微生物制剂霉菌毒素脱除率均高于90%,霉菌毒素脱除率高于对比例1-6制备的微生物制剂。
45.应用实施例2 对仔猪生长性能及表观消化率的影响
选取日龄一致、体重相近的28日龄断奶健康商品阉公猪220只,分为22组,每组10只。以“玉米-豆粕-鱼粉”型基础日粮,喂养30天,每天定时喂养三次。其中,抗生素组,添加吉他霉素 50 mg
·
kg-1
、土霉素 50 mg
·
kg-1
、金霉素 75 mg
·
kg-1
;实验组将“玉米-豆粕-鱼粉”型基础日粮中的玉米、豆粕、乳清粉、鱼粉中分别加入2g/kg实施例2-16、对比例1-6所制备的微生物制剂,加入适量水,室温发酵4小时后,按照抗生素组微量元素配比后喂养30天,每天定时喂养三次。
46.检测指标1、生长性能测定猪体重、采食量,计算平均日增重、平均日采食量、料肉比。
47.2、饲料表观消化率试验采用内源指示剂法测定仔猪对饲料主要营养组分的表观消化率。试验从第14天开始,连续4天收集粪样,-20℃保存。收集完毕后统一解冻,于60℃烘干、粉碎后检测分析干物质、粗蛋白质、粗脂肪、粗纤维表观消化率。
48.表2. 对仔猪生长性能的影响通过上述对比可以看出,用实施例2-16所制备的微生物制剂发酵饲料喂养仔猪,
平均日增重均高于抗生素组和对比例1-6所制备的微生物制剂组,料肉比和腹泻率均低于抗生素组和对比例1-6所制备的微生物制剂组,且料肉比较对抗生素组降低5.8%-12.8%;平均日采食量均高于抗生素组和对比例1-6所制备的微生物制剂组。
49.表3饲料表观消化率试验通过上述对比可以看出,用实施例2-16所制备的微生物制剂发酵饲料喂养仔猪,干物质、粗蛋白质、粗脂肪、粗纤维均明显高于高于抗生素组和对比例1-6所制备的微生物制剂组。
50.发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1