一种丹参饮刺激的骨髓间充质干细胞外泌体及其制备方法和应用与流程
1.本发明属于中药以及生物技术领域,具体涉及一种丹参饮刺激的骨髓间充质干细胞外泌体及其制备方法和应用,具体的为在制备治疗心肌梗死药物中的应用。
背景技术:
2.急性心肌梗死(acute myocardial infarction, ami)主要是由于血栓或栓子堵塞冠状动脉,心肌血液灌注减少、供氧降低,心肌氧耗增加,导致的一种贫血性坏死的病理状态[1]。ami是冠心病最严重的一种临床类型,占发达国家每年死亡人数的1/3以上,是全球范围内致死致残的首要病因[2]。
[0003]
间充质干细胞(mesenchymal stem cells, mscs)来源于发育早期中胚层,可从骨髓、脂肪、脐带、肝脏、牙髓等多种组织中获得。具有多向分化潜能和旁分泌作用,研究发现mscs移植能减少心肌梗死面积、改善心功能,在心肌梗死治疗中显示出一定的作用。但是,干细胞移植的低存活率、低分化率、低归巢率以及免疫排斥等问题,提示干细胞主要通过旁分泌机制发挥修复作用。
[0004]
外泌体(exosomes)被认为是干细胞发挥主要作用的旁分泌因子之一。exosomes是细胞在生理或病理状态下释放的被有脂质双分子层的微小囊泡结构,直径30~150nm,包裹大量蛋白质、脂质、mrna、dna和micrornas等。exosomes一旦被受体细胞吸收,从亲代细胞携带的蛋白质、脂质和rna等就会释放到受体细胞,对受体细胞进行活性和功能的调节。研究发现,不同来源的mscs外泌体具有抑制心功能不全、心肌细胞凋亡、心肌纤维化和多种炎症反应的作用,进而缓解mi引起的心脏损伤[2, 3, 4]。
[0005]
当mscs所处微环境变化时,mscs外泌体内容物也会随之改变,导致其疗效提高或降低[5]。因此,通过改变微环境以提高mscs外泌体的治疗效果有待进一步研究。
[0006]
丹参饮出自清代
·
陈修园《时方歌括》,方中丹参活血祛瘀,檀香、砂仁行气宽中而止痛,三药合用,使气血通畅,则疼痛自止,为治疗气滞血淤胃痛有效之方。现代药理学研究表明丹参饮具有改善心肌病理形态、减轻心肌细胞超微结构损伤及减少心肌细胞坏死和凋亡等作用,在治疗心肌梗死方面有很好的疗效。
技术实现要素:
[0007]
本发明提供了一种丹参饮刺激的骨髓间充质干细胞外泌体及其制备方法和应用,具体的为在制备治疗心肌梗死药物中的应用。
[0008]
本发明由如下技术方案实现的:一种丹参饮刺激的骨髓间充质干细胞外泌体,所述外泌体为丹参饮水提取物诱导处理的骨髓间充质干细胞外泌体。
[0009]
具体制备方法为:(1)制备丹参饮水提取物即dys提取物:丹参30g、檀香5g、砂仁5g加8倍水浸泡30min,先将丹参煎煮50min,后加入檀香、砂仁,再煎煮10min,过滤,药渣继续加6倍水煎煮,
共煮3次,收取煎煮液,浓缩蒸干,密封后4℃备用;(2)收集骨髓间充质干细胞bm-mscs:利用dmem:f12完全培养基培养大鼠骨髓间充质干细胞bm-mscs,bm-mscs接种于培养瓶内,37℃、5%co2培养,24h后首次换液,弃去红细胞及未贴壁细胞,7~10d后传代,得到间充质干细胞bm-mscs;(3)制备丹参饮刺激的骨髓间充质干细胞外泌体bm-mscs
dsy-exos:步骤(2)所制备的bm-mscs用含有浓度0.16/l dsy提取物的dmem:f12完全培养基诱导3d,弃去培养基,pbs清洗3次,然后加入dsy提取物浓度为0.16g/l的dmem:f12无血清培养基,37℃、5%co2培养24h后收集上清;将上清液2000g
×
10min、12000g
×
30min离心后,0.22um滤器滤去细胞碎片,滤液110000g
×
1h超高速离心,弃去上清、pbs重悬,重复110000g
×
1h超高速离心,弃去上清,保留bm-mscs-exos,pbs重悬,-80℃保存备用。
[0010]
所述骨髓间充质干细胞为p3-p10代。
[0011]
所述丹参饮刺激的骨髓间充质干细胞外泌体在制备治疗心肌梗死药物中的应用。
[0012]
本发明通过制备sd大鼠心肌梗死模型,从宏观和微观水平评价bm-mscs
dsy-exos对心肌梗死的治疗效果。通过bm-mscs
dsy-exos心肌注射治疗,心电图显示bm-mscs
dsy-exos心肌注射治疗心肌梗死模型组7d、14d、28d心率平稳,bm-mscs
dsy-exos通过恢复qrs波群形态,降低心率,改善心肌梗死大鼠心电图;检测血清心肌酶谱含量显示显著提高了心肌梗死大鼠血清心肌酶谱ck、ldh、α-hbdh、alt、ast含量;处理7d后心肌颜色呈红紫色,28d心肌颜色发白,但明显优于模型组,心脏形态无显著改变,显然,bm-mscs
dsy-exos能够改善心肌颜色,且能够恢复心脏形态以及大小。ttc染色结果显示bm-mscs
dsy-exos心肌注射治疗可显著缩小心肌梗死大鼠的心梗面积。而心肌组织病理形态也得到了明显的改善,同时还具有明显的抗心肌纤维增生的作用。通过显微检测心肌细胞超微结构显示,治疗组肌原纤维排列情况、线粒体肿胀与膜破裂程度、线粒体嵴排列情况等均有显著改善,充分说明了本发明所述治疗方法能够显著改善心肌梗死大鼠心肌细胞内肌原纤维排列情况、线粒体形态及数量等的作用。通过对心肌细胞进行tunel染色显示,心肌细胞凋亡数目显著减少,也就是说,本发明所述bm-mscs
dsy-exos具有抑制心肌细胞凋亡的作用。
[0013]
通过对其基因表达进行检测显示:real time pcr结果分析说明bm-mscs
dsy-exos通过降低促凋亡基因p53、bak1表达,抑制心肌细胞凋亡。通过对p53、bak1基因表达的检测显示,bm-mscs
dsy-exos通过降低促凋亡基因p53、bak1表达,抑制心肌细胞凋亡;对bcl-2、bax、cleaved caspase-3、p-gsk-3β表达的检测显示:bm-mscs
dsy-exos通过降低凋亡蛋白bax、cleaved caspase-3、p-gsk-3β表达水平、提高抗凋亡蛋白bcl-2表达水平,发挥抗心肌细胞凋亡的作用;对p62、lc3基因表达的检测显示:bm-mscs
dsy-exos通过提高自噬基因p62、lc3表达,提高心肌细胞自噬水平;提高自噬相关蛋白p62、lc3表达水平,发挥促进心肌细胞自噬的作用。
[0014]
血清心肌酶含量升高;心肌梗死面积显著降低;细胞排列紊乱、心肌细胞坏死、炎细胞浸润及纤维增生明显减轻;心肌细胞内线粒体肿胀减轻,线粒体嵴数量明显增加;cleaved caspase-3表达、p-gsk-3β表达及bax/bcl-2比值降低;p62、lc3表达提高,提示bm-mscs
dsy-exo可通过抑制心肌细胞凋亡、提高自噬水平,发挥抗心肌梗死的作用。
[0015]
丹参饮处理的骨髓间充质干细胞外泌体(dsy-bone marrow mesenchymal stem cells-exosomes, bm-mscs
dsy-exos)较未处理组有(bm-mscs-exos)显著改善的抗心肌细胞
凋亡的效果,实验也充分验证了,丹参饮处理可以通过改变bm-mscs-exos内含的蛋白质、脂质、核酸等内容物,进而提高bm-mscs-exos抗mi的治疗效果。
[0016]
本发明利用中药经典方剂dsy诱导提高bm-mscs-exos抗心肌梗死的疗效,并对作用机制进行深入研究,拟将传统中医治疗与现代医学有机结合,探寻一种对慢性重大疾病心肌梗死更为精准的治疗方法。
附图说明
[0017]
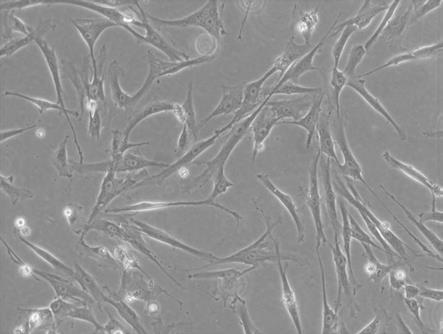
图1为传代bm-mscs生长状况,
×
400;图2为bm-mscs exosomes电镜及粒径分析结果;图中:a.电镜分析结果(放大倍数100nm); b. 粒径分析结果;图3为bm-mscs exosomes cd9表达鉴定;图中:1为bm-mscs;2为bm-mscs-exos;3为bm-mscs
dsy
;4为bm-mscs
dsy-exos;图4为各组大鼠不同时间节点心电图;图中:a:假手术组7d;b:假手术组14d;c:假手术组28d;d:模型组7d;e:模型组14d;f:模型组28d;g:bm-mscs-exos组7d;h:bm-mscs-exos组14d;i:bm-mscs-exos组28d;j:bm-mscs
dsy-exos组7d; k:bm-mscs
dsy-exos组14d;l:bm-mscs
dsy-exos组28d;图5为心肌酶谱酶含量表达水平;图中:a为ck表达改变;b为ldh表达改变;c为α-hbdh 表达改变;d为alt表达改变;e为ast表达改变;注:与模型组7d、14d、28d比较,* p《0.05,** p《0.01;图6为各组大鼠不同时间节点心脏大体情况;图7为大鼠心脏ttc染色结果;图8为心肌组织he染色结果(
×
200);图9为心肌组织masson染色结果(
×
200);图10为心肌细胞超微结构改变;图11为心肌细胞tunel染色结果(
×
200);图12为p53、bak1表达改变;图中:a为p53表达改变;b为bak1表达改变;注:与模型组7d、14d、28d比较,* p《0.05,** p《0.01;图13为bcl-2、bax、p-gsk-3β、cleaved caspase-3表达改变;图中:a为bax/bcl-2表达改变结果;b为cleaved caspase-3表达结果;c为p-gsk-3β表达结果;d为电泳图;d图中:1:假手术组7d;2:假手术组14d;3:假手术组28d;4:模型组7d;5:模型组14d;6:模型组28d;7:bm-mscs-exos组7d;8:bm-mscs-exos组14d;9:bm-mscs-exos组28d;10:bm-mscs
dsy-exos组7d; 11:bm-mscs
dsy-exos组14d;12:bm-mscs
dsy-exos组28d;图14为p62、lc3基因表达改变;图中a为p62基因表达改变;b为lc3基因表达改变;注:与模型组7d、14d、28d比较,* p《0.05,** p《0.01;图15为p62、lc3蛋白表达改变;图中a为p62蛋白表达改变;b为lc3蛋白表达改变;c为电泳图;c中:1:假手术组7d;2:假手术组14d;3:假手术组28d;4:模型组7d;5:模型组14d;6:模型组28d;7:bm-mscs-exos组7d;8:bm-mscs-exos组14d;9:bm-mscs-exos组28d;10:bm-mscs
dsy-exos组7d; 11:bm-mscs
dsy-exos组14d;12:bm-mscs
dsy-exos组28d。
具体实施方式
[0018]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0019]
一、实验材料:1、sd大鼠,雄性,280
±
20g,spf级,购自北京华阜康生物科技股份有限公司,生产许可证:scxk(京)2019-0008。饲养于山西省中医药研究院中心实验室动物房,室温:22
±
1℃,相对湿度40%~60%;自由饮水摄食;新生sd大鼠,1~3d,饲养于屏障环境,自由饮水摄食,室温:22
±
1℃,相对湿度40%~60%。
[0020]
2、丹参饮水提取物:丹参30g、檀香5g、砂仁5g加8倍水浸泡30min,先将丹参煎煮50min,后下檀香、砂仁,再煎煮10min,药渣继续加6倍水煎煮,共煮3次,收取煎煮液,浓缩蒸干,密封后存放于4℃备用。
[0021]
3、工作液用dmem:f12完全培养基或dmem:f12无血清培养基溶解提取物,浓度为0.16g/l,现用现配。
[0022]
4、sd大鼠骨髓间充质干细胞bm-mscs的获取方法:取出生1~3d的sd大鼠乳鼠3只,75%酒精体表消毒,无菌条件下取脊柱,用dmem:f12完全培养基缓慢冲洗脊柱,接种于培养瓶内,37℃、5%co2培养,24h后首次换液,弃去红细胞等未贴壁细胞,7~10d后传代至p3-p10代。
[0023]
5、sd大鼠骨髓间充质干细胞外泌体bm-mscs-exos的获取方法:当bm-mscs融合至80%时,弃去dmem:f12完全培养基,pbs清洗3次,加入无血清dmem:f12培养基,培养24h后收集细胞培养液。将细胞培养液2000g
×
10min、12000g
×
30min离心后,0.22um滤器滤去细胞碎片,滤液110000g
×
1h超高速离心,弃去上清、pbs重悬,重复110000g
×
1h超高速离心,弃去上清,保留bm-mscs-exos,pbs重悬,-80℃保存备用。bca定量后,western blot检测exosomes表面特异性标志物cd9,透射电镜观察并拍照。
[0024]
6、丹参饮处理的骨髓间充质干细胞外泌体bm-mscs
dsy-exos的获得:bm-mscs用dsy提取物浓度为0.16/l的dmem:f12完全培养基诱导3d后,弃去,pbs清洗3次,加入dsy提取物浓度为0.16g/l的dmem:f12无血清培养基,37℃、5%co2培养24h后收集上清。外泌体提取、浓度测定及鉴定方法同bm-mscs-exos。
[0025]
二、实验方法1、急性心肌梗死mi模型的建立:sd大鼠称重后用2%戊巴比妥钠溶液(10ml/kg)腹腔注射麻醉,仰卧位固定,头部后仰,行气管插管,连接呼吸机,呼吸频率80次/分,呼吸比1:1,潮气量4.0ml。稳定后,左胸碘伏消毒,在胸骨左侧3~4肋间斜20
º
~30
º
作1cm纵行切口,逐层钝性分离胸肌,在第3~4肋骨间隙最宽处用眼睑器撑开并固定,挤出心脏。模型组大鼠在平左心耳下缘处迅速以6-0号线结扎左前降支近端(进针深度0.5mm,宽度2mm),假手术组只穿线不结扎。bm-mscs-exos组与bm-mscs
dsy-exos组结扎后分别用bm-mscs-exos、bm-mscs
dsy-exos 40ug心肌注射治疗。闭合胸腔,缝合肌肉层,同时将胸腔内空气挤出,完成后棉签蘸取注射用青霉素钠浸润手术区防止感染,最后缝合皮肤。观察3-5分钟,拔除呼吸管,待大鼠恢复自主呼吸后放回饲养框内,左侧卧位并适当垫高头部。术后连续肌注青霉素钠
3d(200000u/d),预防术后感染。取术后7d、14d、28d作为观测时间点。
[0026]
2、心电图监测:将bl-420s生物机能实验系统的黑色、红色、白色电极分别连接于sd大鼠右后肢、左后肢及右前肢皮下,分别于术后第7d、14d、28d记录假手术组、模型组、bm-mscs-exos组以及bm-mscs
dsy-exos组心电图并观察ii导联st段改变情况。
[0027]
3、心肌酶谱含量测定:各组大鼠称重、麻醉后,下腔静脉取血,3000rpm、20min离心后分离血清,利用血清生化分析仪检测血清心肌酶谱含量:肌酸激酶(ck)、α-羟丁酸 (α-hbdh)、乳酸脱氢酶(ldh)、谷丙转氨酶(alt)、天门冬氨酸氨基转移酶(ast)。
[0028]
4、心脏大体变化观察:分别于术后第7d、14d、28d麻醉各组大鼠,开胸观察心脏大体变化情况。
[0029]
5、心肌梗死面积测定:剔除大血管及心脏外结缔组织后摘取心脏,pbs洗涤,放入-20℃冰箱速冻30min,从心底部开始每间隔1~2mm切一片,取3片置于2%ttc磷酸缓冲液(ph=7.4)中,37℃避光孵育,每隔3min翻动一次,15min后取出组织,观察并记录染色情况。正常组织呈红色,梗死组织呈苍白色,采用image-j图像分析软件计算心肌梗死面积。
[0030]
6、心肌病理形态观察:于术后第7d、14d、28d,取各组大鼠心脏,剔除心包膜后,取结扎线0.5mm以下心肌组织浸于10%甲醛溶液中固定,脱水、石蜡包埋、切片(厚度为5
µ
m),行he(苏木素-伊红)和masson染色,光学显微镜下观察心肌组织病理改变和纤维化程度。
[0031]
7、心肌细胞超微结构观察:对各组大鼠心脏组织,2.5%戊二醛固定后,0.1m pbs 15min漂洗3次,1%锇酸固定液固定2-3h后,梯度酒精脱水,epon812渗透、包埋。首先制备半薄切片,1%甲苯胺蓝染色,olympus bx-光学显微镜观察,记录心肌缺血显微结构变化,同时定位。根据半薄定位进行超薄切片,固定在铜网上,3%醋酸铀-枸橼酸铅双染色,jem-1200ex 透射电镜(jeol ltd. japan)观察心肌细胞超微结构的改变。
[0032]
8、心肌细胞凋亡观察:将心脏组织石蜡切片脱蜡至水,用proteinase k处理组织15-30min,滴加tunel反应混合液避光反应,终止、封闭后,dab显色,苏木素复染,光学显微镜下观察心肌细胞凋亡情况。
[0033]
9、real time pcr检测:trizol法提取心脏组织总rna;rna定量后,根据第一链cdna合成试剂盒说明书,逆转录cdna,反应体系:20ul,反应条件:25℃ 10min、55℃ 30min、85℃ 5min,-20℃保存;sybr green法进行real time pcr扩增,反应体系:25ul,反应条件:95℃ 5min (1 cycle),95℃ 10s、60℃ 35s(40 cycle)。p53、bak1、p62、lc3ii引物序列见表1。
[0034]
表1 p53、bak1、p62、lc3ii引物序列
10、western blot检测:提取心脏组织总蛋白,bca法定量;根据蛋白定量结果,取50μg总蛋白、彩色预染marker 3μl进行电泳,浓缩胶80v、分离胶120v,待目标分子量展开时停止电泳;0.22um pvdf膜半干转印15v 55min;5%bsa 4℃过夜封闭后,一抗4℃过夜孵育(bax 1:1000; bcl-2 1:1000; cleaved caspase-3 1:500; gsk-3β 1:500; lc3ii 1:500; p62 1:500),tbst漂洗10min
×
3次,二抗(1:10000)室温孵育1h,tbst漂洗10min
×
3次,ecl显色,alphaview-fluorchem hd2系统检测。采用image-j图像分析软件计算条带灰度值,进行半定量分析。
[0035]
三、统计分析:采用graphpad prism 6.0统计软件进行处理,结果以表示,组间比较采用单因素方差分析(one-way analysis of variance, anova),p《0.05视 为具有统计学意义。
[0036]
四、结果以及分析1、bm-mscs体外分离培养及exosomes鉴定:传代bm-mscs 24h完全贴壁,细胞形态均一,呈长梭形、鱼群样生长,生长旺盛,见图1。bm-mscs exosomes粒径30~200nm,平均粒径75.73nm,形态完整、球形、大小均一,有典型的“杯盘”形态,见图2。wb鉴定cd9阳性,结果见图3。经鉴定,从sd大鼠乳鼠脊柱中获取的传代细胞为bm-mscs,为p3-p10代,且从bm-mscs培养液中提取的物质为exosomes。
[0037]
2、心电图改变:表2为各组大鼠不同时间节点j点位置,如表2、图4所示,假手术组大鼠心电图平稳,j点始终位于基线下方。模型组大鼠不同时间节点心电图j点位置表现出不同程度的抬高:7d时j点轻度抬高、t波高耸,14d、28d时j点均显著抬高;q波、r波波形和振幅发生不同程度的改变:7d时改变不明显,14d时q波、r波波形增宽、振幅增大,二者振幅接近,28d时q波、r波波形增宽,q波振幅大于r波。
[0038]
与模型组比较,bm-mscs-exos组、bm-mscs
dsy-exos组j点位置3个时间节点均降低,且后者7d、14d降低更显著,28d时二组j点位置基本相当。此外,假手术组大鼠7d、14d、28d时
心率平稳,未见明显波动;与假手术组比较,模型组大鼠术后7d心率加快、14d心率较快、28d心率降低,bm-mscs-exos组7d、14d心率加快、28d心率恢复,bm-mscs
dsy-exos组7d、14d、28d心率平稳。
[0039]
心电图分析显示,bm-mscs
dsy-exos通过恢复qrs波群形态,降低心率,改善心肌梗死大鼠心电图。
[0040]
表2:各组大鼠不同时间节点j点位置与模型组7d、14d、28比较,*p《0.05,**p《0.013、血清心肌酶谱含量改变:与模型组比较,bm-mscs-exos、bm-mscs
dsy-exos心肌注射治疗7d、14d、28d后,ck、ldh、α-hbdh、alt、ast表达量均增高。由图5可见,与模型7d组比较,bm-mscs
dsy-exos 7d组ldh、α-hbdh、ast含量显著增高,bm-mscs-exos 7d组α-hbdh含量显著增高;与模型28d组比较,bm-mscs
dsy-exos 28d组ck、ldh、α-hbdh、alt、ast含量显著增高,bm-mscs-exos 28d组ldh含量显著增高。因此,bm-mscs
dsy-exos心肌注射治疗可以显著提高心肌梗死大鼠血清心肌酶谱ck、ldh、α-hbdh、alt、ast含量。
[0041]
4、心脏大体改变:图6为各组大鼠不同时间节点心脏大体情况,如图6所示,假手术组大鼠7d、14d、28d后均可见左心室前臂及心尖部心肌呈红色,心肌颜色、心脏形态均未发生明显变化。模型组大鼠7d后结扎位置及以下可见心肌颜色发白、左心室肥大,14d后心肌发白程度、左心室肥大程度加剧,28d后心肌呈现暗灰色、心脏萎缩。bm-mscs-exos组大鼠7d后可见心肌呈紫色、心脏形态未发生显著改变,14d后心肌颜色略发白、心脏形态未发生显著改变,28d后心肌呈灰白色、心脏萎缩。bm-mscs
dsy-exos组大鼠7d后心肌呈红紫色、心脏形态未发生显著改变,14d后心肌颜色略发白、心脏形态未发生显著改变,28d后结扎区心肌颜色发白、心脏形态未发生显著改变。通过28d实验观察,bm-mscs
dsy-exos具有改善心肌颜色、恢复心脏形态及大小的作用。
[0042]
5、心肌梗死面积:各组大鼠不同时间节点心肌梗死面积结果如表3、图7所示,结果显示:随观察时间延长,模型组大鼠心梗面积呈显著增加趋势,左心腔扩张程度、心室壁变薄程度亦呈增加趋势;假手术组大鼠3个观测时间节点均未见梗死灶;bm-mscs-exos组大鼠心梗面积呈增加趋势,但与模型组比较,范围显著缩小(14dp《0.01,28dp《0.05);bm-mscs
dsy-exos组大鼠心脏可见小范围梗死灶,与模型组比较,范围显著缩小(14d、28d p《0.01)。ttc染色结果显示,bm-mscs
dsy-exos心肌注射治疗可显著缩小心肌梗死大鼠心梗面积。
[0043]
表3 各组大鼠不同时间节点心肌梗死面积
注:与模型组7d、14d、28d比较,*p《0.05,**p《0.01.6、心肌组织病理改变:he染色结果见图8,如图8可见:假手术组7d、14d、28d心肌组织纤维排列整齐、横纹清晰,心肌细胞排列规则、细胞完整,未见炎性细胞浸润;模型7d组,心肌细胞、心肌纤维轻度排列紊乱,心肌细胞肿胀;模型14d组,心肌细胞、心肌纤维中度排列紊乱,心肌细胞坏死、心肌纤维溶解、间质多量炎细胞浸润;模型28d组,心肌细胞坏死、溶解,纤维、毛细血管增生,间质大量炎细胞浸润,形成瘢痕组织;与模型组比较,bm-mscs-exos组、bm-mscs
dsy-exos组对应时间节点心肌细胞坏死、心肌纤维溶解、间质多量炎细胞浸润程度均有不同程度减轻,且bm-mscs
dsy-exos组心肌组织病理改变更轻。见图8。通过he染色结果分析,bm-mscs
dsy-exos具有明显改善心肌组织病理形态的作用。
[0044]
masson染色可见:心肌组织masson染色结果如图9所示,结果显示:假手术组7d、14d、28d均未见明显病理学改变;模型组7d、14d、28d,胶原纤维增生程度显著增加;与模型组对应时间节点比较,bm-mscs-exos组和bm-mscs
dsy-exos组7d、14d、28d纤维增生程度明显减轻,且bm-mscs
dsy-exos组更轻。通过masson染色结果分析,bm-mscs
dsy-exos具有明显抗心肌纤维增生的作用。
[0045]
7、心肌细胞超微结构改变:心肌细胞超微结构改变结果如图10所示,由图10可见:假手术组7d、14d、28d均可见心肌细胞超微结构完整,肌原纤维纵向平行排列,肌丝分布均匀,肌节的位置和长度相当,线粒体排列密集,嵴丰富且排列有序,无断裂现象,核膜完整;模型7d组,肌原纤维纵向平行排列,肌丝分布均匀,肌节的位置和长度相当,线粒体轻度肿胀,嵴间隙扩张,嵴稀少或排列混乱;模型14d组,肌原纤维排列紊乱,肌丝断裂、溶解,线粒体肿胀、膜破裂,嵴断裂、溶解;模型28d组,肌原纤维排列紊乱,肌丝断裂、溶解,线粒体极度肿胀、膜破裂,基质物质丢失,嵴移向周围,变短及数量减少,可见基质内空泡形成;与模型组比较,bm-mscs-exos组、bm-mscs
dsy-exos组对应时间点肌原纤维排列情况、线粒体肿胀与膜破裂程度、线粒体嵴排列情况等均有不同程度改善,且bm-mscs
dsy-exos改善更为显著。
[0046]
透射电镜观察结果显示,bm-mscs
dsy-exos具有显著改善心肌梗死大鼠心肌细胞内肌原纤维排列情况、线粒体形态及数量等的作用。
[0047]
8、心肌细胞凋亡a、tunel染色结果:心肌细胞tunel染色结果如图11所示,结果显示:假手术组7d、
doi: 10.1016/j.biocel.2019.105564.[4] teng x, chen l, chen w, yang j, yang z, shen z. mesenchymal stem cell-derived exosomes improve the microenvironment of infarcted myocardium contributing to angiogenesis and anti-inflammation [j]. cell physiol biochem. 2015, 37: 2415-24.[5] liu l, jin x, hu cf, li r, zhou z, shen cx. exosomes derived from mesenchymal stem cells rescue myocardial ischaemia/reperfusion injury by inducing cardiomyocyte autophagy via ampk and akt pathways [j]. cell physiol biochem. 2017. 43: 52-68。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1