筛选提高恶唑霉素类化合物产量的共培养体系的方法及其应用
本发明涉及微生物,具体来说,涉及通过微生物共培养偶联报告系统高通量筛选的方法发现能促进龙胜链霉菌cgmcc 4.1101中恶唑霉素类化合物产量提高的链霉菌-枯草芽孢杆菌共培养体系,及其在所获得的结构新颖恶唑霉素类化合物制备中的应用。
背景技术:
1、链霉菌作为一种丝状细菌,不仅具有复杂的发育分化过程,还能产生丰富的次级代谢产物,如具有治疗寄生虫病活性的阿维菌素(campbell wc.history of avermectinand ivermectin,with notes on the history of other macrocyclic lactoneantiparasitic agents[j].current pharmaceutical biotechnology,2012,13:853-865)、具有抗癌活性的盐霉素(naujokat c,steinhart r.salinomycin as a drug fortargeting human cancer stem cells[j].journal of biomedicine andbiotechnology,2012,2012:950658)、具有新型冠状病毒蛋白酶抑制活性的亮肽素(fu l,shao s,feng y,et al.mechanism of microbial metabolite leupeptin in thetreatment of covid-19 by traditional chinese medicine herbs[j].mbio,2021:e0222021)以及具有抑菌或抗癌等多种活性的恶唑霉素(oleksak p,gonda j,nepovimovae,et al.the oxazolomycin family:a review of current knowledge[j].rscadvances,2020,10:40745-40794)等,是活性天然产物最重要的来源之一(selim msm,abdelhamid sa,mohamed ss.secondary metabolites and biodiversity ofactinomycetes[j].journal,genetic engineering&biotechnology,2021,19:72)。同时,链霉菌中丰富的次级代谢过程又受到复杂而严格的分子调控(liu g,chater kf,chandrag,et al.molecular regulation of antibiotic biosynthesis in streptomyces[j].microbiology and molecular biology reviews,2013,77:112-143),自然条件下,链霉菌抗生素的产生具有一定的时空依赖性,产量往往维持在相对较低水平,因此需要通过多种方式提高其产量,才能进行大规模生产和应用(parekh s,vinci va,strobelrj.improvement of microbial strains and fermentation processes[j].appliedmicrobiology and biotechnology,2000,54:287-301)。
技术实现思路
1、发明人基于革兰氏阴性菌的酰基高丝氨酸内酯(acyl-homoserine lactone,简称ahl)信号分子群感效应构建了适用于链霉菌的可视化基因表达报告系统—vrs-bahl(visualization reporter system based on acyl-homoserine lactone),其特征为利用革兰氏阴性菌的ahl信号分子合酶基因cvii作为报告基因,利用ahl指示菌对报告基因的表达情况进行检测,具有背景干净、灵敏度高、易操作、适用范围广及可进行可视化高通量筛选等特点。
2、基于vrs-bahl的上述优点,本发明将其与微生物共培养偶联,建立了新的链霉菌抗生素增产的方法,并筛选到了能促进龙胜链霉菌cgmcc4.1101中恶唑霉素类化合物产量显著提高的链霉菌-枯草芽孢杆菌共培养体系,其中8种恶唑霉素相关化合物的产量提高至链霉菌单独培养时的3.3至9.5倍。此外,本发明还分离、鉴定到具有抑制革兰氏阳性菌和革兰氏阴性菌活性的结构新颖的恶唑霉素类化合物。
3、具体而言,本发明提供以下技术方案:
4、一方面,本发明提供筛选提高恶唑霉素类化合物产量的共培养体系的方法,其特征在于,所述方法采用的基础菌为链霉菌a,所述方法包括以下步骤:
5、a.构建链霉菌a报告菌株,所述链霉菌a报告菌株包含报告基因ahl信号分子合酶基因cvii;
6、b.用ahl指示菌筛选与链霉菌a报告菌株共培养后,链霉菌a报告菌株目的基因表达增加的共培养菌。
7、在一些实施方案中,所述链霉菌a为龙胜链霉菌cgmcc 4.1101。
8、在一些实施方案中,所述报告基因包含核糖体结合位点对应dna序列,其核苷酸序列如seq id no.3所示。
9、在一些实施方案中,所述目的基因为结构基因oxag,其核苷酸序列如seq id no.5所示。
10、在一些实施方案中,所述ahl指示菌为cv026。
11、在一些实施方案中,所述包含自身核糖体结合位点对应dna序列的ahl信号分子合酶基因cvii与包含自身启动子的卡那霉素抗性基因kanr1相连,进而通过同源双交换的策略替换所述oxa簇中结构基因oxag编码区中的一部分,使结构基因oxag得到破坏,但保留所述结构基因oxag的启动子区域用于驱动cvii的表达,使用引入的卡那霉素抗性基因作为重组菌株的筛选标记,筛选获得链霉菌a报告菌株。
12、在一些实施方案中,通过同源双交换的策略替换所述oxa簇中结构基因oxag编码区中的一部分,使结构基因oxag得到破坏的步骤包括:扩增包含自身核糖体结合位点对应序列的cvii,扩增包含自身启动子的卡那霉素抗性基因kanr1,扩增oxa簇中结构基因oxag编码区的上游同源臂,扩增oxag编码区的下游同源臂,通过gibson组装的方式将所述oxag编码区的上游同源臂、cvii、kanr1、oxag编码区的下游同源臂按顺序与ecorv酶切的pkc1139质粒连接,获得重组质粒pkdroxag,然后导入链霉菌a,筛选获得链霉菌a报告菌株。
13、在一些实施方案中,用引物rbsi532f和rbsi532r(seq id no.13和seq id no.14)扩增包含自身核糖体结合位点对应序列的cvii,任选地,所述包含自身核糖体结合位点对应序列的cvii的核苷酸序列如seq id no.3所示。
14、在一些实施方案中,用引物pkanrf和pkanrr(seq id no.15和seq id no.16)扩增包含自身启动子的卡那霉素抗性基因kanr1,任选地,所述包含自身启动子的卡那霉素抗性基因的核苷酸序列如seq id no.4所示。
15、在一些实施方案中,用引物droxaglf和droxaglr(seq id no.17和seq id no.18)扩增oxa簇中结构基因oxag(任选地,其核苷酸序列如seq id no.5所示)编码区的上游同源臂(任选地,其核苷酸序列如seq id no.19所示)。
16、在一些实施方案中,用引物droxagrf和droxagrr(seq id no.20和seq id no.21)扩增oxag编码区的下游同源臂(任选地,其核苷酸序列如seq id no.22所示)。
17、在一些实施方案中,将任意可获取微生物例如细菌或真菌分别与链霉菌a报告菌株共培养,之后(例如通过琼脂块法)比较各体系中报告基因的表达,筛选获得提高链霉菌中恶唑霉素类化合物产量的共培养体系。
18、在一些实施方案中,与所述链霉菌a报告菌株共培养所用链霉菌选自天蓝色链霉菌m1146(streptomyces coelicolor m1146)、白色链霉菌cgmcc 4.5716(streptomycesalbus cgmcc 4.5716)、维吉尼亚链霉菌atcc 13161(streptomyces virginiae atcc13161)、灰色链霉菌ifo 13350(streptomyces griseus ifo 13350)、委内瑞拉链霉菌isp5230(streptomyces venezuelae isp 5230)、弗氏链霉菌fxj 1.408(streptomycesfradiae fxj1.408)、橄榄色链霉菌fxj 8.021(streptomyces olivaceus fxj 8.021)、链霉菌fxj 1.088(streptomyces sp.fxj 1.088)、变铅青链霉菌tk23(streptomyceslividans tk23)、圈卷产色链霉菌7100(streptomyces ansochromogenes 7100)和苍黄链霉菌cgmcc 4.1115(streptomyces luridus cgmcc 4.1115)。
19、在一些实施方案中,与所述链霉菌a报告菌株共培养所用链霉菌之外的其他细菌选自枯草芽孢杆菌cgmcc 1.1630(bacillus subtilis cgmcc1.1630)、金黄色葡萄球菌cgmcc 1.89(staphylococcus aureus cgmcc1.89)、蜡样芽孢杆菌cgmcc1.1626(bacilluscereus cgmcc1.1626)、表皮葡萄球菌atcc 35984(staphylococcus epidermidis atcc35984)、肺炎链球菌010(streptococcus pneumoniae 010)、酿脓链球菌#2(streptococcuspyogenes#2)、大肠杆菌jm109(escherichia coli jm109)、海洋棒杆菌cgmcc 1.6998(corynebacterium marinum cgmcc 1.6998)、谷氨酸棒杆菌cgmcc 1.299(corynebacterium glutamicum cgmcc 1.299)、生芽红细菌cgmcc 1.3365(rhodobacterblasticus cgmcc 1.3365)以及嗜粪红球菌cgmcc 4.1813(rhodococcus coprophiluscgmcc 4.1813)。
20、在一些实施方案中,与所述链霉菌a报告菌株共培养所用真菌选自毛壳菌tan01(chaetomium sp.tan01)、正青霉菌tan02(eupenicillium sp.tan02)、曲霉菌tan03(aspergillus sp.tan03)、曲霉菌tan04(aspergillus sp.tan04)、曲霉菌tan05(aspergillus sp.tan05)、青霉菌tan06(penicillium sp.tan06)、枝孢菌tan07(cladosporium sp.tan07)、青霉菌tan08(penicillium sp.tan08)、鬼伞菌tan09(coprinellus sp.tan09)、茎点霉菌tan10(phoma sp.tan10)以及曲霉菌tan11(aspergillus sp.tan11)。
21、另一方面,本发明提供提高链霉菌中恶唑霉素类化合物产量的共培养体系,其特征在于,所述共培养体系包括链霉菌和枯草芽孢杆菌。
22、在一些实施方案中,所述链霉菌为龙胜链霉菌cgmcc 4.1101,所述枯草芽孢杆菌为枯草芽孢杆菌cgmcc 1.1630。
23、另一方面,本发明提供通过上述共培养体系提高产量进而分离到的恶唑霉素类化合物。
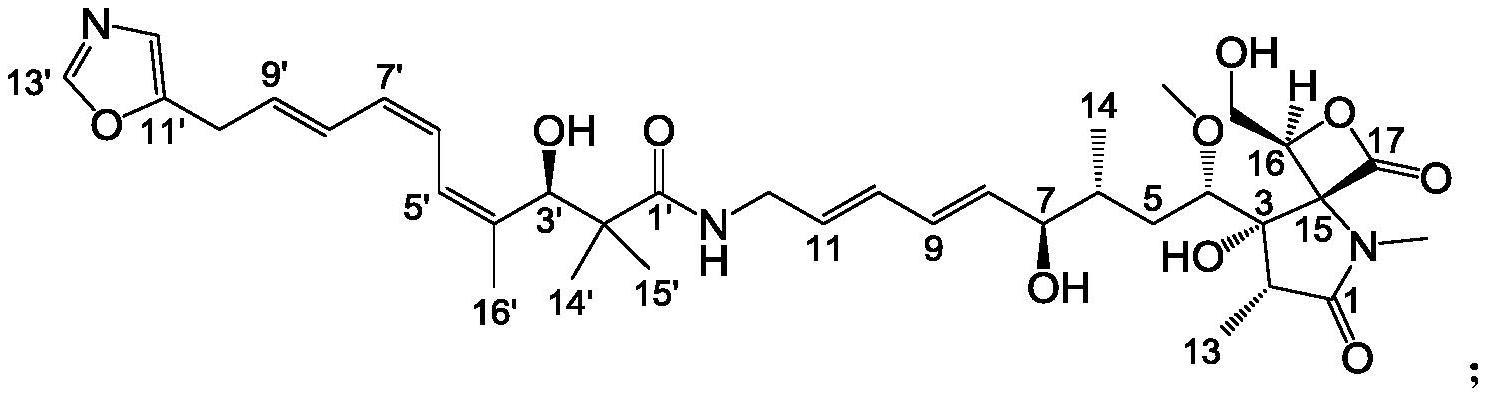
24、在一些实施方案中,所述恶唑霉素类化合物包括:
25、toxa1(c36h51n3o10):
26、
27、toxa5(c36h51n3o9):
28、
29、toxa7(c36h51n3o9):
30、
31、定义
32、cv026:通过对紫色色杆菌cv31532进行转座突变获得的突变株,cv026中的cvii基因和紫色杆菌素生物合成的阻遏基因被破坏,导致ahl无法合成,但是当外源c6-hsl或结构相近的其他ahl存在时,便能激活其紫色杆菌素的产生,因此cv026被广泛应用于c6-hsl或其结构相近的其他ahl的检测。
33、cvii:本发明共用到两种cvii,实施例1中构建质粒pphrdb-cvii用的cvii不包含自身核糖体结合位点对应序列,编号为seq id no.2;实施例2中构建质粒pkdroxag用的包含自身核糖体结合位点对应序列,编号为seq id no.3。
34、核糖体结合位点(rbs):指dna转录出的mrna上起始密码子前很短的一段核糖体结合的位点,但是为了表述直观,有文献直接将rbs对应的dna序列称为核糖体结合位点,此处为了表述更准确,使用“核糖体结合位点对应序列”的表述。
35、卡那霉素抗性基因:本发明用到两个卡那霉素抗性基因,都是从质粒pcs26-pac上扩增,但长度略有不同,分别命名为kanr1和kanr2,kanr1用来构建质粒pkdroxag,kanr2用来构建整合型质粒pij10500k。
36、有益效果
37、本发明所涉及的增产策略得益于本实验室所构建的新型可视化报告系统vrs-bahl的低背景干扰、高灵敏度和广泛适用性,特别适合于对微生物共培养体系的筛选,进而方便、快捷且高通量地实现目的宿主中特定基因簇的增强表达;不同微生物共同存在时彼此之间通常发生相互抑制或促进,传统的生境重叠共培养方法往往会导致具有生存优势的一方逐渐淘汰另一方,而本发明所建立的微孔板固体培养基临近接种共培养法能使不同微生物分布在临近但不重叠的区域,尽可能使其均能获得生长,进而产生相互影响;本发明所筛选到的微生物共培养体系能显著提高龙胜链霉菌cgmcc 4.1101中恶唑霉素类化合物的产量,为恶唑霉素类化合物大规模制备及结构鉴定提供了基础,文献报道制备与toxa5结构一致的ksm-2690b时,从22升链霉菌ksm-2690的液体培养基发酵产物中制备了26.2mg单体,而本发明从2.5升龙胜链霉菌cgmcc 4.1101与枯草芽孢杆菌cgmcc 1.1630的固体培养基发酵产物中获得了约20mg toxa5单体,高效液相色谱(high performance liquidchromatography,hplc)分析表明该化合物在培养基中的浓度达约17.4mg/l,是目前产量最高的恶唑霉素ksm-2690b(toxa5)的链霉菌培养体系;获得的结构新颖的恶唑霉素类化合物toxa1可望成为一个新的广谱抗菌药物先导化合物;本发明测定了toxa1、toxa5和toxa7的生物活性,发现三者均具有抑制革兰氏阳性菌-金黄色葡萄球菌、枯草芽孢杆菌和蜡样芽孢杆菌的活性,而且toxa1和toxa5还具有良好的抑制革兰氏阴性植物致病菌-野油菜黄单胞菌的活性,最小抑菌浓度(minimal inhibitory concentration,mic)分别是50μg/ml和12.5μg/ml。此外,toxa5还具有抑制革兰氏阴性菌铜绿假单胞菌和洋葱伯克霍尔德菌的活性。
38、本发明增产策略适用范围不仅局限于龙胜链霉菌cgmcc 4.1101的恶唑霉素类化合物生物合成基因簇oxa,而且也适用于vrs-bahl能适用的其他微生物或高等动植物中不同类型的目的基因簇或基因;本发明所述微生物共培养体系不仅局限于上述培养条件,还适用于其他可行的培养基或培养方式,比如液体培养基中共培养;本发明所述恶唑霉素类化合物toxa1潜在的适用领域不局限于对病原微生物的抑制,还适用于其他潜在的应用领域,比如抗癌和抗病毒等。
- 还没有人留言评论。精彩留言会获得点赞!