一种深海细菌来源的α-葡萄糖苷酶QsGH97a及其编码基因与应用
一种深海细菌来源的
α-葡萄糖苷酶qsgh97a及其编码基因与应用
技术领域
1.本发明涉及一种α-葡萄糖苷酶,具体涉及一种深海细菌来源的α-葡萄糖苷酶qsgh97a、其编码基因及其在糖类水解生产葡萄糖中的应用,属于基因工程技术领域。
背景技术:
2.α-葡萄糖苷酶广泛存在于动物、植物和微生物中,它不仅能够水解多糖的非还原性末端的α-葡萄糖苷键产生葡萄糖,而且还具有转糖苷作用产生低聚异麦芽糖。根据α-葡萄糖苷酶氨基酸序列,其主要分布在gh家族4、13、31、63、97和122中。此酶的应用非常广泛,在医学领域,α-葡萄糖苷酶在不同生命体内参与多种生理功能包括糖代谢,因此可用于治疗一些因缺乏分解麦芽糖和糖原的酶而引发的疾病;在工业生产领域中,α-葡萄糖苷酶的不同特性使其应用前景良好,比如具有水解糖类生成葡萄糖的性质,可用于葡萄糖的生产,进而可以生产更有价值的产品如乙醇。此外,α-葡萄糖苷酶具有的转糖苷性质使其可以用于生产低聚异麦芽糖(imos)等。
3.目前研究的α-葡萄糖苷酶主要来自于微生物,工业上应用的α-葡萄糖苷酶大多都来源于黑曲霉,但其酶活性不高、热稳定性差的缺点限制其在工业上的应用,且对于α-葡萄糖苷酶的应用探索依旧不够广泛。不同生物体来源的α-葡萄糖苷酶具有不同方面的特性,使其应用范围更具特色,因而不断地开发具有良好特性的α-葡萄糖苷酶以满足工业需要是至关重要的。来自于海洋微生物的α-葡萄糖苷酶具有温度稳定性、耐金属性、耐盐性和冷适应能力等新特性,因此,从海洋微生物中挖掘出能更好应用于工业生产的α-葡萄糖苷酶是良好的策略,不仅可以获得新酶以此更好地了解α-葡萄糖苷酶的生化特性,而且为工业上改造有其他应用价值的酶提供了参考。
技术实现要素:
4.本发明的目的是为克服上述现有技术的不足,提供一种深海细菌来源的α-葡萄糖苷酶qsgh97a及其编码基因与应用。
5.为实现上述目的,本发明采用下述技术方案:
6.1、α-葡萄糖苷酶qsgh97a的编码基因,所述基因具有以下任意一种核苷酸序列:
7.(1)与seq id no.1所示序列一致;
8.(2)对seq id no.1所示序列进行取代、添加和/或缺失一个或两个以上核苷酸但能获得编码保留α-葡萄糖苷酶qsgh97a蛋白生物学特性的突变基因。
9.优选的,所述突变基因至少与seq id no.1所示序列具有90%以上的同源性。
10.进一步优选的,所述突变基因至少与seq id no.1所示序列具有95%以上的同源性。
11.更进一步优选的,所述突变基因至少与seq id no.1所示序列具有99%以上的同源性。
12.2、携带上述编码基因的载体。
13.3、利用上述载体转化或转染原核生物或真核生物宿主。
14.优选的,宿主包括微生物或真核生物细胞。
15.进一步优选的,宿主为大肠杆菌、酿酒酵母或中国仓鼠卵巢细胞。
16.更进一步优选的,宿主为e.coli细菌。
17.4、经上述编码基因表达得到的α-葡萄糖苷酶qsgh97a,其氨基酸序列如seq id no.2所示;或者对seq id no.2所示的序列,远离459位谷氨酸残基(glu 459)、483位谷氨酸残基(glu 483)及378位谷氨酸残基(glu 378)(催化活性中心);远离174位谷氨酸残基(glu174)和477位谷氨酸残基(glu 477)(金属离子结合位点)氨基酸序列进行替换、添加和/或缺失一个或两个以上氨基酸但能获得具有α-葡萄糖苷酶qsgh97a特性的突变体蛋白质。
18.优选的,所述突变体蛋白质至少与seq id no.2所示的氨基酸序列具有90%以上的同源性。
19.进一步优选的,所述突变体蛋白质至少与seq id no.2所示的氨基酸序列具有95%以上的同源性。
20.更进一步优选的,所述突变体蛋白质至少与seq id no.2所示的氨基酸序列具有99%以上的同源性。
21.5、上述载体、宿主或α-葡萄糖苷酶qsgh97a在分解糖类生产葡萄糖及其它工业生产中的应用。
22.优选的,所述糖类为最终水解产物为葡萄糖的物质。
23.本发明的有益效果:
24.本发明从国家海洋局第二海洋研究所提供的太平洋海山深海沉积物宏基因组文库中筛选获得α-葡萄糖苷酶qsgh97a基因,来源于深海细菌qipengyuania seohaensis sp.sw-135。通过表达纯化α-葡萄糖苷酶qsgh97a发现其具有较好的酶学性质,可用于葡萄糖的生产,可应用于糖类水解相关的食品加工和化学工业中。获得的α-葡萄糖苷酶基因可克隆到合适的宿主中实现异源表达,且纯化方法简单,可实现工业化生产α-葡萄糖苷酶,应用于大量生产葡萄糖的化学工业中,此外,其优良的耐碱性和耐盐性使其在特殊的工业生产中具有前景。
25.α-葡萄糖苷酶基因qsgh97a,其具有如seq id no.1所示的核苷酸序列。α-葡萄糖苷酶基因qsgh97a大小为2037bp,碱基组成为:411a(20.18%)、354t(17.38%)、648c(31.81%)和624g(30.63%),其氨基酸序列如seq id no.2所示,编码的蛋白质有678个氨基酸,大小为75.57kd。通过blast比对发现与来源于qipengyuania sp.1ndw3的gh97家族的酶的同源性最高,为83.13%。α-葡萄糖苷酶qsgh97a的氨基酸序列分析显示,α-葡萄糖苷酶qsgh97a具有glu 459、glu 483与glu 378组成的催化结构域,说明qsgh97a属于α-葡萄糖苷酶gh 97家族。综上所述,qsgh97a应为gh 97家族中的一名新成员。
26.根据分子克隆技术,首先将扩增的α-葡萄糖苷酶qsgh97a基因通过dna连接酶连接到目标载体上,然后将重组载体转化或转染到原核生物或真核生物宿主中,诱导表达产生重组α-葡萄糖苷酶qsgh97a,最后酶切得到不含标签的α-葡萄糖苷酶qsgh97a。所述的宿主包括微生物如大肠杆菌e.coli等,酵母(酿酒酵母)及哺乳动物细胞(中国仓鼠卵巢细胞)
等。
27.本发明的载体为本领域研究人员所熟知的并且经过实验验证可行的原核或真核表达载体。本发明使用的表达载体是psmt3(li,j.et al.(2012).the rip1/rip3 necrosome forms a functional amyloid signaling complex required for programmed necrosis.cell 150(2),339-350.),将α-葡萄糖苷酶qsgh97a基因插入到载体psmt3的多克隆位点中从而获得重组质粒,并转化到大肠杆菌e.coli bl21(de3)plus中,经iptg诱导表达出具有高活性的α-葡萄糖苷酶qsgh97a。通过酶活实验结果显示,α-葡萄糖苷酶qsgh97a可以水解α-葡萄糖苷键和β-半乳糖苷键,即可以水解多糖生成葡萄糖或半乳糖,其中底物为对硝基苯酚α-d-吡喃葡萄糖苷(pnpαglu)时催化活性最高,不加金属离子时的酶活vmax为0.64u/mg,米氏常数km=0.21mm。
28.α-葡萄糖苷酶qsgh97a发挥50%以上催化作用的温度范围为20℃-50℃,最适温度为45℃;所述ph范围为ph 6.0-ph 11.0,最适ph为ph 8.0。添加不同浓度的金属离子ba
2+
或sr
2+
时能促进3-7倍酶活性,5%吐温20和80条件下,能轻微增强酶活性。添加1mm ba
2+
或sr
2+
后,酶在高浓度的去垢剂,有机溶剂和nacl中耐受性大大加强。
附图说明
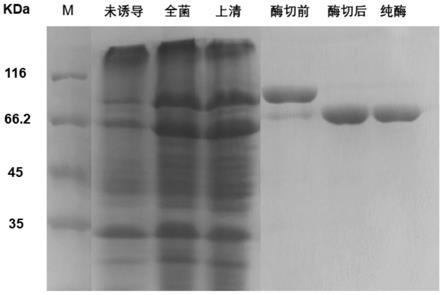
29.图1为纯化α-葡萄糖苷酶qsgh97a的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析图。
30.图2为α-葡萄糖苷酶qsgh97a的底物特异性图。pnpβglu:对硝基苯β-d-葡萄糖苷;pnpαglu:对硝基苯α-d-葡萄糖苷、pnpαarap:对硝基苯α-l-阿拉伯吡喃糖苷;pnpβlac:对硝基苯β-d-乳糖苷;pnpαgal:对硝基苯α-d-半乳糖苷;pnpβgal:对硝基苯β-d-半乳糖苷;pnpβman:对硝基苯α-d-甘露糖苷;pnpβxyl:对硝基苯β-d-木糖苷;pnpβfuc:对硝基苯β-d-岩藻糖苷;pnpβcel:对硝基苯β-d-纤维二糖苷。定义底物为pnpαglu时测定值为100%。
31.图3为α-葡萄糖苷酶qsgh97a最适反应温度图。
32.图4为α-葡萄糖苷酶qsgh97a最适反应ph图。
33.图5为金属离子对α-葡萄糖苷酶qsgh97a活性影响图。
34.图6为有机溶剂对α-葡萄糖苷酶qsgh97a活性影响图,其中,a为常见有机溶剂对酶活性的影响,b为加入1mm ba
2+
或sr
2+
的有机溶剂对酶活性的影响(空白为标准反应体系,对照为标准反应体系加入1mm ba
2+
或sr
2+
,其它为对照体系中分别加入不同的有机溶剂)。
35.图7为去垢剂对α-葡萄糖苷酶qsgh97a活性影响图,其中,a为去垢剂对酶活性的影响,b为加入1mm ba
2+
或sr
2+
后去垢剂对酶活性的影响(空白为标准反应体系,对照为标准反应体系加入1mm ba
2+
或sr
2+
,其它为对照体系中分别加入不同的去垢剂)。
36.图8为α-葡萄糖苷酶qsgh97a对nacl的耐受性影响图,其中,a为nacl水溶液对酶活性的影响,b为加入1mm ba
2+
或sr
2+
的nacl水溶液对酶活性的影响(空白为标准反应体系,对照为标准反应体系加入1mm ba
2+
或sr
2+
,其它为对照体系中分别加入不同浓度的nacl)。
具体实施方式
37.下面结合附图和实施例对本发明进行进一步的阐述,应该说明的是,下述说明仅是为了解释本发明,并不对其内容进行限定。
38.实施例1
39.α-葡萄糖苷酶基因qsgh97a的克隆和重组质粒的构建
40.深海沉积物样品采集自太平洋海山边缘区域。细菌基因组文库由合作单位国家海洋局第二海洋研究所提供。
41.构建重组原核表达载体所用引物包括:
42.上游引物:5
’‑
ggcggatgatccgccatatcgccctcttcatc-3’,如seq id no.3所示;
43.下游引物:5
’‑
aaactcgagtcacccctgcggcacgaactcg-3’,如seq id no.4所示。
44.酶切位点分别为bamhi和xhoi,选取的表达载体为psmt3载体,将克隆的目的基因片段和载体经琼脂糖电泳确定条带大小正确后进行限制性双酶切,酶切位点分别为bamhi和xhoi,然后分别将酶切产物割胶回收。使用t4 dna连接酶并按照片段与载体摩尔比为7:1的比例置于16℃过夜,将获得的重组载体转化入大肠杆菌e.coli dh5α(全式金,中国),然后涂布于含有50μg/ml卡那霉素抗性的lb琼脂培养基平板筛选阳性克隆菌。经测序验证准确后,保存至-80℃冰箱。通过blastx(http://blast.ncbi.nlm.nih.gov/)比对插入的目的基因序列与数据库中已知α-葡萄糖苷酶基因序列的同源性,发现与来源于qipengyuania sp.1ndw3的gh97家族的酶的同源性最高,为83.13%,其在genbank数据库中的注册号为qzd92199.1。α-葡萄糖苷酶基因qsgh97a大小为2037bp(核苷酸序列如seq id no.1所示),碱基组成为:411a(20.18%)、354t(17.38%)、648c(31.81%)和624g(30.63%),其氨基酸序列如seq id no.2所示,编码的蛋白质包含678个氨基酸残基,大小为75.57kda。α-葡萄糖苷酶qsgh97a属于gh 97家族,其氨基酸序列分析显示,具有glu 459,glu 483与glu 378组成的催化结构域,构成α-葡萄糖苷酶qsgh97a催化中心,说明qsgh97a属于α-葡萄糖苷酶gh 97家族。
45.综上所述,qsgh97a应为gh 97家族中的一名新成员。
46.实施例2
47.α-葡萄糖苷酶基因qsgh97a的重组质粒的转化
48.将测序正确的阳性克隆菌置于lb液体培基中于37℃培养,然后使用质粒抽提试剂盒(axygen,美国)抽提质粒,得到重组质粒。将从-80℃冰箱拿出的e.coli strain bl21(de3)plus(全式金,中国)感受态细胞分装30μl到ep管中,加入1μl质粒,在冰上孵育30min后,42℃下热激1min,冰上孵育2min,然后加入500μl lb培养基,37℃摇床培养1小时后离心去除200μl上清,取剩余菌液均匀涂在含有50μg/ml卡那霉素抗性的lb琼脂平板上。
49.实施例3
50.α-葡萄糖苷酶qsgh97a的表达和纯化
51.挑取转化到e.coli strain bl21(de3)plus感受态细胞中平板上的阳性克隆,在含有50μg/ml卡那霉素抗性的500ml lb液体培养基中37℃培养至od
600
达到0.8-1.0,在16℃条件下加入终浓度为0.5mm的iptg(异丙基-β-d-硫代半乳糖苷)置于200rpm的摇床培养20h后,低温离心收集菌体,并重悬于buffer a溶液(50mm tris-盐酸,ph 8.0,500mm氯化钠,10mm咪唑,体积浓度1%甘油)中,将重悬液置于冰上使用超声波破碎仪破碎菌体。低温离心收集上清,将上清与ni-nta介质一起孵育0.5h后采用重力柱将其纯化。由于所表达的重组蛋白含有his标签,可亲和吸附到镍柱上,经过不同浓度的咪唑溶液(10mm、20mm、250mm)梯度洗脱,收集洗脱液可得到重组蛋白,然后通过sds-page检测蛋白大小。将经过sds-page检
测蛋白大小正确的样品测定浓度后,以蛋白样品与ulp1酶(切断重组蛋白的sumo标签)质量比为500:1的比例进行酶切,在4℃透析过夜降低咪唑浓度。将酶切后的样品再次过镍柱,收集流出的样品,再次通过sds-page验证蛋白大小,最后得到纯的α-葡萄糖苷酶qsgh97a,分子量约75.6kda,与预测大小一致(图1)。用考马斯亮蓝染料法测定蛋白质浓度,得到10mg蛋白。
52.实施例4
53.α-葡萄糖苷酶qsgh97a的酶活性质
54.α-葡萄糖苷酶qsgh97a的酶动力学检测
55.qsgh97a的酶活性用对硝基苯酚法检测。100μl的体系包括5μl质量浓度为0.6mg/ml的酶液、5μl终浓度分别为0.01mm,0.02mm,0.05mm,0.1mm,0.2mm,0.5mm,1.0mm,1.5mm,2.0mm的对硝基苯酚-α-d-葡萄糖苷(源叶生物,上海)和90μl的20mm tris-盐酸缓冲液(ph 8.0),使用酶标仪(thermo scientific multiskan fc,美国)在45℃下连续测定吸光值od
405 2分钟,使用失活的酶液作为对照用于调零。用软件graphpad对数据进行拟合,获得的α-葡萄糖苷酶活性vmax为0.64u/mg,米氏常数km=0.21mm。pnp的标准曲线用于计算产生的pnp量。一个酶活性单位定义为每分钟催化产生1μmol pnp所需要的酶量。
56.实施例5
57.α-葡萄糖苷酶qsgh97a的最适底物测定
58.反应体系同上,包括:90μl的20mm tris-盐酸缓冲液(ph 8.0),5μl终浓度为1mm的不同底物,以及5μl质量浓度为0.6mg/ml的纯酶,在45℃下测定反应2min的od
405
。测定底物为:对硝基苯酚-β-d-葡萄糖苷,对硝基苯酚-α-d-葡萄糖苷,对硝基苯酚-α-l-阿拉伯吡喃糖苷,对硝基苯酚-β-d-乳糖苷,对硝基苯酚-β-d-半乳糖苷,对硝基苯酚-α-d-半乳糖苷,对硝基苯酚-β-d-甘露糖苷,对硝基苯酚-β-d-木糖苷,对硝基苯酚-β-d-岩藻糖苷,对硝基苯酚-β-d-纤维二糖苷。经测定结果显示,α-葡萄糖苷酶qsgh97a对对硝基苯酚-α-d-葡萄糖苷具有最大催化活性,对对硝基苯酚-β-d-半乳糖苷有12.5%的催化活性,对其余底物无催化活性(图2)。综上,α-葡萄糖苷酶qsgh97a的最适底物是对硝基苯酚-α-d-葡萄糖苷。
59.实施例6
60.α-葡萄糖苷酶qsgh97a最适反应条件分析
61.α-葡萄糖苷酶qsgh97a的最适反应温度在4℃-70℃范围内测定。体系为:5μl质量浓度为0.6mg/ml的酶液、5μl终浓度为1mm的对硝基苯酚-α-d-葡萄糖苷和90μl的20mm tris-盐酸缓冲液(ph 8.0),分别在20℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃和70℃条件下测定反应2min后的od
405
。测定结果显示qsgh97a在20-60℃的反应温度范围内均有活性,最适反应温度为45℃(图3)。
62.α-葡萄糖苷酶qsgh97a最适反应ph在ph 3.0-ph 12.0范围内测定。体系为:5μl质量浓度为0.6mg/ml的酶液、5μl终浓度为1mm的对硝基苯酚-α-d-葡萄糖苷和90μl不同ph的20mm缓冲液。使用的缓冲液为:20mm柠檬酸-柠檬酸钠缓冲液(ph 3.0-ph 6.0),20mm磷酸氢二钠-磷酸二氢钾缓冲液(ph 6.0-ph 8.0),20mm tris-盐酸缓冲液(ph 7.5-ph9.0)和20mm甘氨酸-氢氧化钠缓冲液(ph 9.0-ph 12.0)。测定结果显示,α-葡萄糖苷酶qsgh97a在ph 6.0-ph 11.0范围内均有活性,最适反应ph为ph 8.0(图4)。
63.实施例7
64.α-葡萄糖苷酶qsgh97a的酶学稳定性分析
65.分析金属离子对α-葡萄糖苷酶qsgh97a活性的影响的反应体系为:5μl质量浓度为0.6mg/ml的酶液、5μl终浓度为1mm的对硝基苯酚-α-d-葡萄糖苷和90μl的20mm tris-盐酸缓冲液(ph 8.0),分别加入1mm或10mm含金属离子co
2+
、cu
2+
、ca
2+
、mg
2+
、zn
2+
、sr
2+
、mn
2+
、ni
2+
、ba
2+
、k
+
、na
+
的盐溶液或乙二胺四乙酸(edta),在45℃下测定反应2min后的od
405
,以对照组的酶活性为100%,计算不同金属离子中酶的相对活性。测定结果显示,ba
2+
和sr
2+
能强烈提高qsgh97a的活性,co
2+
、cu
2+
、zn
2+
、mn
2+
和edta能强烈抑制qsgh97a的活性,ca
2+
、mg
2+
、ni
2+
、k
+
和na
+
对酶的活性影响不大(图5)。
66.分析有机溶剂对α-葡萄糖苷酶qsgh97a的活性影响的反应体系为:5μl质量浓度为0.6mg/ml的酶液、5μl终浓度为1mm的对硝基苯酚-α-d-葡萄糖苷和20mm tris-盐酸缓冲液(ph 8.0),加入体积百分数5%或15%的有机溶剂(异丙醇、乙腈、乙醇、甲醇、丙酮、二甲基亚砜和丙三醇),在45℃下测定反应2min后的od
405
,以对照组的酶活性为100%,计算不同有机溶剂中酶的相对活性。测定结果显示丙三醇和二甲基亚砜能抑制酶的活性,15%的丙三醇和二甲基亚砜能完全抑制酶的活性,甲醇和乙醇能抑制部分酶活性,说明α-葡萄糖苷酶qsgh97a在常见的有机溶剂中稳定性较差(图6中a),但当在反应体系中加入1mm ba
2+
或sr
2+
后,酶在15%的有机溶剂中普遍能保持200%以上的活性(图6中b)。
67.分析去垢剂对α-葡萄糖苷酶qsgh97a的活性影响的反应体系为:5μl质量浓度为0.6mg/ml的酶液、5μl终浓度为1mm的对硝基苯酚-α-d-葡萄糖苷和20mm tris-盐酸缓冲液(ph 8.0),分别加入体积百分数为1%或5%的去垢剂,包括:sds、吐温20、吐温80、triton x-114或triton x-100),在45℃下测定反应2min后的od
405
,以对照组的酶活性为100%,计算不同去垢剂中酶的相对活性。测定结果显示,triton x-114会轻微抑制酶活性,而吐温20和吐温80可增强其活性,triton x-100对酶活性几乎没有影响(图7中a),同样是加入1mm ba
2+
或sr
2+
后,qsgh97a更能耐受5%的去垢剂(图7中b)。
68.分析nacl浓度对α-葡萄糖苷酶qsgh97a的活性影响的反应体系为:5μl质量浓度为0.6mg/ml的酶液、5μl终浓度为1mm的对硝基苯酚-α-d-葡萄糖苷和90μl的20mm tris-盐酸缓冲液(ph 8.0),加入一系列浓度的nacl溶液(1m、2m、3m、4m和5m),在45℃下测定反应2min后的od
405
,以对照组的酶活性为100%,计算不同浓度nacl中酶的相对活性。测定结果显示,α-葡萄糖苷酶qsgh97a具有一定的耐盐性,在5m的nacl水溶液中还能保持大约20%的酶活性(图8中a),1mm ba
2+
或sr
2+
的加入使酶在5m的nacl水溶液中仍能保持约50%活性(图8中b)。
69.上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1