一种人血白蛋白的纯化方法与流程
adachi在专利us7001885b2中使用阴离子交换层析去除人血白蛋白多聚体,我们在同样的条件下进行了试验,不能完全去除多聚体,在多聚体有一个拖尾峰一直延伸至二聚体。因此,亟需开发一种能够充分去除人血白蛋白中的多聚体的纯化方法,以提升人血白蛋白制品的质量、有效性以及安全性,并同时保证人血白蛋白的提取纯化效率。
技术实现要素:
7.本发明意在提供一种人血白蛋白的纯化方法,以解决经巴氏灭活的人血白蛋白制品中的多聚体难以充分去除的技术问题。
8.为达到上述目的,本发明采用如下技术方案:
9.一种人血白蛋白的纯化方法,包括以下依次进行的步骤:
10.s1获取含有人血白蛋白的滤液;
11.s2第一次超滤和第一次巴氏灭活:所述滤液依次经过超滤和巴氏灭活后,获得蛋白制品b;
12.s3离子交换层析:对蛋白制品b依次进行阴离子交换层析和阳离子交换层析,获得流穿液b;或者对蛋白制品b依次进行阳离子交换层析和阴离子交换层析,获得流穿液a;
13.s4第二次超滤:对流穿液a或者流穿液b进行超滤处理,获得蛋白制品c。
14.本方案的原理及优点是:本方案采用现有技术中常规的低温乙醇法提取人血白蛋白(s1),且由于血液制品的特殊性,需要在生产过程中对蛋白进行病毒灭活(s2),病毒灭活采用经典的巴氏灭活法,巴氏灭活时,损失的蛋白和杂蛋白等形成多聚体。为了减少由于巴氏灭活等操作手段带来的多聚体,本技术方案采用了阴离子交换层析和阳离子交换层析的方式,成功实现对多聚体的去除,并同时保证了较为理想的蛋白质收率。
15.本方案发明人通过对人血白蛋白中杂质成分进行分析,根据杂蛋白和白蛋白多聚体成分的差异,其等电点也有差异,分别采用阴离子交换层析和阳离子交换层析对多聚体峰和拖尾峰进行去除。离子交换层析原理是依靠离子间相互作用实现蛋白质分离纯化。当目的蛋白和杂质蛋白所处的溶液环境介于两者等电点之间时,不同蛋白分子表面净电荷将呈现相反电性,其在特定离子交换层析介质表面表现出一类蛋白分子与介质表面离子交换基团结合,而另一类蛋白分子游离于水相中的行为差异。根据这一差异可以通过离子交换层析的方法,实现目的蛋白和杂质蛋白的有效分离。
16.在本技术方案中,人血白蛋白的提取方法为现有技术中的常规方法。大致为:原料血浆经过乙醇沉淀处理,除去组分i、组分ii+iii、组分iv,再经精制获得含有组分v的滤液,含有组分v的滤液即为含有人血白蛋白的滤液。
17.进一步,还包括s5第二次巴氏灭活:对蛋白制品c进行巴氏灭活,获得蛋白制品d。通过进一步巴氏灭活,保证产品的无菌性。
18.进一步,在s3中,阴离子交换层析的填料为q、tmae或deae。
19.经试验研究发现阴离子交换层析的填料的选择对人血白蛋白的纯化以及二聚体的去除有关键影响。q和deae、tmae阴离子交换层析介质都能达到效果,层析介质颗粒大小为50~80μm,其中人血白蛋白多聚体去除效果的排序tmae>q>deae,蛋白收率tmae<q=deae。
20.进一步,在s3中,阳离子交换层析的填料为sp。通过填料为sp的阳离子交换层析,
可以充分除去人血白蛋白中的多聚体杂质。
21.进一步,在s3中,当对蛋白制品b依次进行阴离子交换层析和阳离子交换层析时,调整蛋白制品b的ph值为4.40~5.00,电导率≤2.5ms/cm,蛋白质浓度≤100g/l;将调整后的蛋白制品b以≤3.0cm/min的流速上样于阴离子交换层析柱,收集流穿液a;调整流穿液a的ph值为5.10~5.50,电导率为2.0~6.0ms/cm;将调整后的流穿液a以≤3.0cm/min的流速上样于阳离子交换层析柱,收集流穿液b。流穿液b即为本方案制备获得的层析后制品。
22.经研究发现,在阴离子交换层析和阳离子交换层析中,ph的选择和电导率的选择,对于纯化效果非常关键。将ph值和电导率调整至上述水平,可实现对人血白蛋白中的多聚体的充分清除,并保证较为理想的蛋白质收率。
23.进一步,在s3中,当对蛋白制品b依次进行阴离子交换层析和阳离子交换层析时,调整蛋白制品b的ph值为4.60~4.80,电导率为1.0~1.5ms/cm,蛋白质浓度≤100g/l;将调整后的蛋白制品b以≤3.0cm/min的流速上样于阴离子交换层析柱,收集流穿液a;调整流穿液a的ph值为5.10~5.50,电导率为4.0~6.0ms/cm;将调整后的流穿液a以≤3.0cm/min的流速上样于阳离子交换层析柱,收集流穿液b。流穿液b即为本方案制备获得的层析后制品。
24.实验证明,将进行阴离子交换层析柱的样品的ph值调整至4.60~4.80,导电率调整至1.0~1.5ms/cm,获得的流穿液a的蛋白质收率高于90%,获得的多聚体含量低于0.33%。在使用阳离子交换层析时,电导率为4.0~6.0ms/cm,可保证蛋白收率在95%以上,且不会出现多聚体峰和拖尾峰。
25.进一步,在s3中,对蛋白制品b依次进行阳离子交换层析和阴离子交换层析时,调整蛋白制品b的ph值为5.10~5.50,电导率为2.0~6.0ms/cm,蛋白质浓度≤100g/l;将调整后的蛋白制品b以≤3.0cm/min的流速上样于样离子交换层析柱,收集流穿液b;调整流穿液b的ph值为4.40~5.00,电导率为1.0~1.5ms/cm;将调整后的流穿液b以≤3.0cm/min的流速上样于阳离子交换层析柱,收集流穿液a。流穿液a即为本方案制备获得的层析后制品。阴阳离子交换层析可以交换顺序进行,均不影响对人血白蛋白提取和纯化的效果。
26.进一步,在s2和s5中,巴氏灭活的条件为恒温60.0
±
0.5℃持续10h。由于血液制品的特殊性,需要在生产过程中对蛋白进行病毒灭活,上述巴氏灭活条件可以保证将人血白蛋白中的可能存在的病毒去除。
27.进一步,在s2中,所述滤液依次经过浓缩、等体积超滤处理后,进行蛋白制品a的配制;蛋白制品a中的蛋白浓度为10wt.%~25wt.%,ph值为6.40~7.40;蛋白制品a中含有氯化钠和辛酸钠,氯化钠的终浓度为60~100mmol/l,辛酸钠的添加量为每g蛋白0.14~0.18mmol;所述蛋白制品a经过巴氏灭活、过滤以及超滤透析之后获得蛋白制品b。经过上述操作除去部分杂质和灭活病毒,获得的蛋白制品b,以供后续的离子层析纯化过程。
28.进一步,在s1中,获取含有人血白蛋白的滤液的方法为:融化并离心处理原料血浆,获得上清液a;调整上清液a的温度为
‑
3.0~
‑
1.0℃、蛋白浓度为40~65g/l、ph为6.80~7.30、电导率为12~14ms/cm,加入终浓度为7~10%的乙醇,反应1~3h,压滤收集上清液b;调整上清液b的温度为
‑
6.0~
‑
4.0℃、蛋白浓度为30~45g/l、ph为5.70~6.30、电导率为5.0~8.0ms/cm,加入终浓度为18~22%的乙醇,反应1~3h,压滤收集上清液c;调整上清液c的温度为
‑
6.0~
‑
2.0℃、蛋白浓度为20~30g/l、ph为5.70~6.30、电导率为2.0~5.0ms/cm,加入终浓度为38~42%的乙醇,反应1~3h,压滤收集上清液d;调整上清液d温度为
‑
15.0~
‑
7.0℃、蛋白浓度为10~20g/l、ph为4.70~4.90、电导率为2.0~5.0ms/cm,加入终浓度为38~42%的乙醇,反应1~3h,压滤收集沉淀;将沉淀溶解,获得组分v溶液;调整组分v溶液的温度为
‑
4.0~
‑
1.0℃、蛋白浓度为20~60g/l、ph为4.50~4.70,加入终浓度为9~13%的乙醇,反应1~3h,过滤并收集滤液。
29.低温乙醇法为分离纯化人血白蛋白的常用手段,由于乙醇易得、成本低、易放大规模化生产,目前国内主要血液制品生产厂家多数采用低温乙醇法生产人血白蛋白。低温乙醇沉淀法是通过调整血浆的“五变”参数,即ph、电导率、蛋白浓度、乙醇浓度、温度来分级沉淀血浆成分,逐步分离血浆中的蛋白。
附图说明
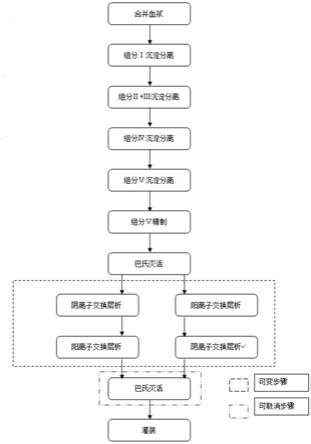
30.图1为人血白蛋白的纯化方法的整体工艺流程。
31.图2为本发明实施例2的流穿液多聚体与ph、导电率的等值线图。
32.图3为本发明实施例2的蛋白收率与ph、导电率的等值线图。
33.图4为本发明实施例4的蛋白制品b的hplc检测结果图。
34.图5为本发明实施例4的流穿液a的hplc检测结果图。
35.图6为图5的多聚体峰的放大图。
36.图7为本发明实施例4的流穿液b的hplc检测结果。
37.图8为图5和图7的多聚体峰的放大叠加图。
38.图9为《中国药典》中的测定人血白蛋白多聚体时的各峰(即单体、二体、多聚体)位置的hplc标准图谱。
具体实施方式
39.下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例以及实验例所用的技术手段为本领域技术人员所熟知的常规手段,且所用的材料、试剂等,均可从商业途径得到。
40.本方案的整体工艺流程参见图1,具体过程如下:
41.1、原料血浆处理:原料血浆出库后,使用70%~75%乙醇溶液对血浆袋表面消毒,然后将血浆袋破袋,控制温度在0~4℃融化,融化后将血浆合并,使用离心机离心血浆(离心力为10000rcf),收集上清液a。其中,原料血浆是血液离心去除细胞后的上清,含有蛋白质、无机盐和水等,不含血细胞。更具体地,原料血浆即《中国药典》中所指的人血浆:血液制品生产用人血浆系以单采血浆术采集的供生产血浆蛋白制品用的健康人血浆。
42.2、组分i沉淀分离:调整上清液a的温度为
‑
3.0~
‑
1.0℃、蛋白浓度为40~65g/l、ph为6.80~7.30、电导率为12~14ms/cm、乙醇(纯乙醇)体积百分浓度为7~10vol.%(终浓度),反应1~3h,压滤收集上清液b。
43.3、组分ii+iii沉淀分离:调整上清液b的温度为
‑
6.0~
‑
4.0℃、蛋白浓度为30~45g/l、ph为5.70~6.30、电导率为5.0~8.0ms/cm、乙醇体积百分浓度为18~22vol.%,反应1~3h,压滤收集上清液c。
44.4、组分iv沉淀分离:调整上清液c的温度为
‑
6.0~
‑
2.0℃、蛋白浓度为20~30g/l、ph为5.70~6.30、电导率为2.0~5.0ms/cm、乙醇体积百分浓度为38~42vol.%,反应1~
3h,压滤收集上清液d。
45.5、组分v沉淀分离:调整上清液d温度为
‑
15.0~
‑
7.0℃、蛋白浓度为10~20g/l、ph为4.70~4.90、电导率为2.0~5.0ms/cm、乙醇体积百分浓度为38~42vol.%,反应1~3h,压滤收集沉淀(即组分v)。
46.6、组分v精制:用沉淀量2~4倍注射用水溶解组分v沉淀2~4h(即沉淀:注射用水=1g:2~4ml),获得组分v溶液。调整组分v溶液的温度为
‑
4.0~
‑
1.0℃、蛋白浓度为20~60g/l、ph为4.50~4.70、乙醇体积百分浓度为9~13vol.%,反应1~3h,使用深层滤器进行过滤,收集滤液。
47.7、超滤配制:滤液经过超滤和配制后获得蛋白制品a,具体地为:使用氢氧化钠溶液将滤液的ph值调整为6.4~7.4,再使用10kd超滤机膜包浓缩调整ph值后的滤液,使其蛋白质含量达到180~240g/l,获得浓缩后滤液。然后,维持浓缩后的滤液的体积,使用10
‑
15倍的水,进行等体积超滤处理(即加水的同时滤除水,使体积保持不变),获得等体积超滤后滤液。然后浓缩等体积超滤后滤液,再在浓缩的等体积超滤后滤液中加入辅料,配制获得ph值为6.40~7.40蛋白制品a。辅料包括辛酸钠和氯化钠等,在蛋白制品a中辛酸钠的添加量为每g蛋白0.14~0.18mmol的辛酸钠,氯化钠的在蛋白制品a中的终浓度为60~100mmol/l。配制过程中,用氢氧化钠溶液调整蛋白制品a的ph值,并使用注射用水调整至配制体积。本方案按照蛋白制品a中的蛋白浓度10wt.%~25wt.%进行配制,例如10wt.%、20wt.%或25wt.%。
48.8、巴氏灭活:将蛋白制品a打入灭活罐中,控制制品温度60.0
±
0.5℃、恒温10小时。将巴氏灭活后制品使用0.2μm滤芯过滤,过滤后使用10kd超滤膜包超滤透析,去除离子根(例如:氯离子、钠离子、辛酸根离子等),获得蛋白制品b。蛋白制品b的蛋白浓度大于100g/l、电导率小于0.30ms/cm。
49.9、阴离子交换层析:调整蛋白制品b的ph为4.40~5.00,蛋白浓度不高于100g/l、电导率不高于2.5ms/cm,以不高于3.0cm/min流速上样阴离子交换层析柱,收集流穿液a。q和deae、tmae阴离子交换层析介质都能达到效果,层析介质颗粒大小为50~80μm,其中人血白蛋白多聚体去除效果的排序:tmae(密理博默克)>q(各厂家均有)>deae(各厂家均有),蛋白收率的排序:tmae(默克)<q(各厂家均有)=deae(各厂家均有)。其中,tmae可选用fractogel emd tmae(m)。阴离子交换层析介质(填料)deae是将二乙基氨基乙基离子交换基团共价连接在基质上,形成的阴离子交换层析柱填充材料,例如capto deae、unigel 80deae和unigel 50deae。阴离子交换层析介质(填料)q是指季铵基团通过化学稳定的醚键同基质连接(例如6%的琼脂糖)连接,形成的阴离子交换层析柱填充材料,例如capto q、nanogel 50q和unigel 80q均可选用。
50.10、阳离子交换层析:调整蛋白制品b的ph为5.10~5.50、电导率为2.0~6.0ms/cm、蛋白浓度不高于100g/l,以不高于3.0cm/min流速上样阳离子交换层析柱,收集流穿液b。使用的阳离子交换层析介质为sp。阳离子交换层析介质(填料)sp是一种将羧甲基键合在基质(例如6%的琼脂糖)上,形成的带有强酸阳离子基团的层析分离介质,具体可选用unigel 80sp、unigel 50sp、capto sp、eshmuno s。
51.另外,步骤9与步骤10不分先后顺序,即可先进行步骤9再进行步骤10,也可先进行步骤10再进行步骤9,对多聚体的去除效果无差异。先进行步骤9时,则在步骤10中使用流穿
液a进行层析操作;先进行步骤10时,则在步骤9中使用流穿液b进行层析操作。
52.11、超滤配制:经过阴离子交换层析和阳离子交换层析后,对流穿液b或流穿液a重复步骤7,获得蛋白制品c。
53.12、巴氏灭活及灌装:将蛋白制品c打入灭活罐中,控制制品温度60.0
±
0.5℃、恒温10小时。恒温结束后,经终端为0.2μm滤芯的离心过滤后进行制品灌装,获得蛋白制品d,即为成品。
54.步骤11可直接配制后灌装,可以不采用步骤12的操作。
55.13、蛋白浓度检测采用紫外分光光度计进行检测,检验方法为《中国药典》通则0731。多聚体含量检测采用高效液相色谱系统,检验方法为《中国药典》通则3123。
56.实施例1:
57.本实施例对采用了工艺步骤1
‑
8,未进行后续的离子交换层析,具体参数选择以及指标测试情况详见表1:
[0058][0059]
[0060]
实施例2
[0061]
本实施例在实施例1的基础上进行,按照测试2的方法,经过步骤1
‑
8,制备获得的蛋白制品b,再使用蛋白制品b进行阴离子交换层析柱层析,即进行步骤9中的工艺。调整蛋白制品b的ph为4.70(可选范围为4.60~4.80),电导率为1.2(可选范围为1.0~1.5ms/cm),蛋白浓度30g/l,分别以1.5cm/min流速上样于q、tmae、deae阴离子交换层析柱,上样量为不高于1500g/l(即每升离子交换层析介质上样量不高于1500g蛋白质,本实施例具体选用1000g/l),然后收集流穿液a。其中,q、tmae、deae阴离子交换层析柱的填料购自商业途径,在本实施例中,三种填料具体的使用类型分别为unigel 80qfractogel emd tmae(m)、unigel 50deae。利用q、tmae、deae填料按照本领域常规技术手段进行手动填装,层析柱规格为16
×
200mm。先使用5个柱体积的0.5m氢氧化钠溶液以1.5cm/min的流速对三种层析柱进行消毒,然后使用5个柱体积醋酸
‑
醋酸钠缓冲液(ph 4.60
±
0.02,电导率1.50ms/cm,流速1.5cm/min)作为平衡液进行层析柱平衡处理。层析柱的填装、消毒和柱平衡操作均为现有技术常规手段,可根据实际情况选择不同的消毒液、平衡液、流速和浓度等,并将ph值维持在4.60
±
0.02,均能实现目的效果。例如,平衡液还可以使用枸橼酸
‑
枸橼酸钠缓冲液以及磷酸氢二钠
‑
磷酸二氢钠缓冲液。完成上述操作之后,再进行对蛋白制品b的阴离子交换层析柱层析。将调整好的蛋白制品b上样于层析柱中,上样的同时开始收集流穿液(第一部分)。完成蛋白制品b上样后使用后平衡液再次处理层析柱,用于顶洗制品,提高蛋白回收率。使用5个柱体积醋酸
‑
醋酸钠缓冲液(流速1.5cm/min)作为后平衡液,但是ph和电导率同蛋白制品b保持一致,收集流穿液(第二部分)。将第一部分和第二部分合并,获得流穿液a,再进行取样检测。然后按照本领域常用技术手段进行后续操作,实现层析柱的再生,大致操作过程为:使用2m氯化钠作为洗脱液,洗脱吸附的多聚体和杂蛋白。接下来使用8m尿素作为清洗液,清洗层析柱残留的、吸附强的蛋白。再使用cip液(1m氯化钠+0.5m氢氧化钠+20%乙醇)消毒和彻底清洗残留蛋白。接下来使用平衡液平衡cip液处理时ph升高问题。最后,使用20%乙醇封存层析柱,以备下次使用。流穿液a取样检测多聚体、蛋白收率,实验结果如表2所示。
[0062]
表2:三种不同填料的多聚体含量以及蛋白收率测试结果。
[0063][0064]
由表2可知,不同填料对人血白蛋白中多聚体的去除效果和蛋白收率影响有较大差异,多聚体去除效果tmae>q>deae,蛋白收率效果tmae<q=deae。
[0065]
实施例3
[0066]
参照实验例2的操作流程,设计doe实验,对阴离子交换层析ph、电导率进行考察。取实施例2中巴氏灭活超滤过滤后的蛋白制品b,按照下表3的doe设计调整制品ph、电导率,分别上样q阴离子交换层析柱(16
×
200mm),收集流穿液a取样检测多聚体和蛋白收率。实验结果详见表3、图2和图3。
[0067]
表3:doe实验设计以及蛋白收率和多聚体含量测试结果
[0068][0069]
由表3、图2和图3可知,q阴离子交换层析能去除人血白蛋白中的多聚体峰,此处结果为系统自动积分结果。由于多聚体检测时,多聚体峰拖尾峰比较严重,且拖尾峰延伸至二聚体峰旁边,故自动积分时会将其识别成噪音,故需要进一步采用阳离子交换层析进行去除。
[0070]
实施例4
[0071]
本实施例在实施例3的基础上增加阳离子交换层析步骤,即增加工艺中的步骤10。在本实施例中,步骤9具体选用的蛋白制品b的ph条件为4.6,电导率为1.5ms/cm,其他操作同实施例3。经过步骤9获得流穿液a,对流穿液a进行步骤10的操作。流穿液a调整为ph为5.30(可选范围5.10~5.50)、电导率4.0ms/cm(可选范围2.0~6.0ms/cm)、不调整蛋白浓度,以1.5cm/min流速上样sp阳离子交换层析柱,流穿液a的上样量为不高于1000g/l(即每升离子交换层析介质上样量不高于1000g蛋白质,本实施例具体选用800g/l),收集流穿液b取样检测多聚体。
[0072]
sp阳离子交换层析柱的填料的具体类型为unigel 80sp。利用sp填料按照本领域常规技术手段进行手动填装,层析柱规格为16
×
200mm。先使用5个柱体积的0.5m氢氧化钠溶液以1.5cm/min的流速对三种层析柱进行消毒,然后使用5个柱体积醋酸
‑
醋酸钠缓冲液(ph 4.60
±
0.02,电导率1.50ms/cm,流速1.5cm/min)作为平衡液进行层析柱平衡处理。层析柱的填装、消毒和柱平衡操作均为现有技术常规手段,可根据实际情况选择不同的消毒液、平衡液、流速和浓度等,并将ph值维持在4.60
±
0.02,均能实现目的效果。例如,平衡液还可以使用磷酸氢二钠
‑
磷酸二氢钠缓冲液。完成上述操作之后,再进行对流穿液a的阳离子交换层析柱层析。将调整好的流穿液a上样于层析柱中,上样的同时开始收集流穿液(第一部分)。完成流穿液a上样后,使用后平衡液再次处理层析柱,用于顶洗制品,提高蛋白回收率。使用5个柱体积醋酸
‑
醋酸钠缓冲液(流速1.5cm/min)作为后平衡液,但是ph和电导率同蛋白制品b保持一致,收集流穿液(第二部分)。将第一部分和第二部分合并,获得流穿液b,再进行取样检测。然后按照本领域常用技术手段进行后续操作,实现层析柱的再生,大致操作过程为:使用2m氯化钠作为洗脱液,洗脱吸附的多聚体和杂蛋白。再使用cip液(1m氯化钠+0.5m氢氧化钠+20%乙醇)消毒和彻底清洗残留蛋白。接下来使用平衡液平衡cip液处理时ph升高问题。最后,使用20%乙醇封存层析柱,以备下次使用。
[0073]
经检测,两次层析后多聚体含量为0,无多聚体峰和拖尾峰。蛋白制品b的hplc检测结果图见图4,流穿液a的hplc检测结果图见图5,图5的多聚体峰的放大图见图6,流穿液b的hplc检测结果图见图7。图8展示了图7的多聚体峰放大图以及图5的多聚体峰放大图。可见经过阳离子交换层析之后,多聚体的含量减少且无多聚体峰和拖尾峰。《中国药典》中的测
定人血白蛋白多聚体时的各峰(即单体、二体、多聚体)位置的标准图谱参见图9。本方案的目的在于尽可能地除去人血白蛋白中的多聚体以及其他蛋白杂质,保留单体和部分二聚体,获得纯度高的人血白蛋白制品,不同于人血白蛋白的标准品的制作(需要将多聚体、二聚体以及其他蛋白杂质全部除去)。
[0074]
实施例5
[0075]
本实施例将步骤9和步骤10的顺序调换,即先对蛋白制品b进行如实施例4所述的阳离子交换层析(步骤10),获得流穿液b,然后对流穿液b(不进行蛋白浓度调整)进行实施例4所述的阴离子交换层析(步骤9)。经过两次层析后多聚体含量为0,无多聚体峰和拖尾峰。
[0076]
实施例6
[0077]
参照实施例4中的方法进行q阴离子交换层析柱,获得流穿液a。按照实施例4中的参数条件对流穿液a进行调整,电导率按照表3进行调整,以1.5cm/min流速上样sp阳离子交换层析柱,收集流穿液b取样进行hplc检测以及计算蛋白收率。由表4的实验结果可知,上样电导率在1.5~6.0ms/cm,可以获得比较理想的多聚体清除效果。但是,上样电导率越低会导致蛋白收率降低,电导率越高多聚体去除效果越差,选择电导率的范围为4.0~6.0ms/cm,既能保证蛋白收率又能去除多聚体。
[0078]
表4:电导率设置以及蛋白收率和多聚体含量测试结果
[0079][0080]
实施例7
[0081]
本实施例在实施例1的基础上进行,对获得的蛋白制品b依次进行工艺步骤9/10/11/12/13,具体如下:
[0082]
9、阴离子交换层析:取巴氏灭活超滤过滤后蛋白制品b,调整蛋白制品b的ph为4.6(可选择范围为4.60~4.80)、电导率1.5ms/cm(可选择范围为1.0~1.5ms/cm),蛋白浓度30g/l,以1.5cm/min流速上样q阴离子交换层析柱,收集流穿液a。本步骤采用的层析柱规格为100
×
500mm,蛋白制品b的上样量为不高于1500g/l(即每升离子交换层析介质上样量不
高于1500g蛋白质,本实施例具体选用1000g/l)。
[0083]
10、阳离子交换层析:调整流穿液a的ph为5.30(可选择范围为5.10~5.50)、电导率4.0ms/cm(可选择范围为2.0~6.0ms/cm)、不调整蛋白浓度,以2.5cm/min流速上样sp阳离子交换层析柱,收集流穿液b。本步骤采用的层析柱规格为100
×
500mm,流穿液a的上样量为不高于1000g/l(即每升离子交换层析介质上样量不高于1000g蛋白质,本实施例具体选用800g/l)
[0084]
11、超滤配制:参照实施例1中的测试2的步骤7的具体参数进行超滤,获得蛋白制品c。
[0085]
12、巴氏灭活及灌装:将蛋白制品c打入灭活罐中,控制制品温度60.0
±
0.5℃、恒温10小时。恒温结束后经终端为0.2μm滤芯离心过滤后进行制品灌装。获得蛋白制品d,即为成品。
[0086]
实验结果显示人血白蛋白经过巴氏灭活、阴离子交换层析、阳离子交换层析,制品再次超滤配制、巴氏灭活,制品未见肉眼可见变化,第二次巴氏灭活后制品无多聚体和多聚体拖尾峰的形成。说明制品经过层析后已经把杂质蛋白和损伤的不稳定蛋白去除掉,再次巴氏灭活时,不再有多聚体和拖尾峰的形成。人血白蛋白成品中重点检验项目见表5,其中多聚体含量能降低至0,且无多聚体峰和拖尾峰,曲线光滑平整。其它检验项目都在2020版《中国药典》的规定范围内。
[0087]
表5:成品检测结果
[0088][0089]
注:各项目检验方法来源于2020版《中国药典》。
[0090]
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1