一种3-氧杂氮环丁烷-1-羧酸叔丁酯的制备方法与流程
1.本发明涉及化学药物中间体制备方法领域,尤其涉及一种3-氧杂氮环丁烷-1-羧酸叔丁酯的制备方法。
背景技术:
2.3-氮环丁烷-1-羧酸叔丁酯是一种重要的有机合成中间体,广泛用于药物合成领域,可用于合成考比替尼,巴瑞克替尼等抗菌药抗肿瘤药物。所以有必要开发一条高效的合成方法来制备3-氧杂氮环丁烷-1-羧酸叔丁酯。目前的合成方法主要如下:
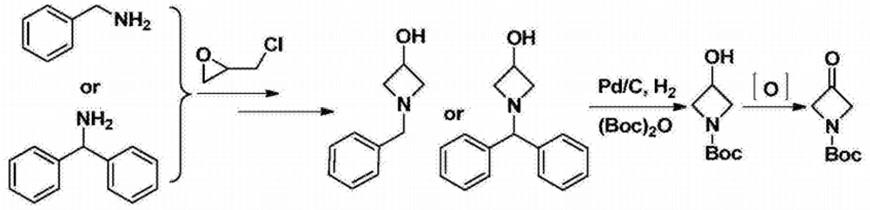
3.方法1:以环氧氯丙烷与苄氨或者二苯甲胺开环得到中间体(中国专利cn108752254),然后在碱的作用下关环得到氮杂环结构,再经过钯碳氢气还原氧化反应得到目标产物。由于需要钯碳氢化所以对反应设备要求较高。设备成本和原料成本较大。难以工业化生产。
[0004][0005]
方法2:
[0006]
cn106831523合成报道了以3-烷环氧丙烷、烷基苯甲醛作为起始原料,开环、缩合得到亚胺,再水解得到铵盐,然后引入boc基团氧化得到3-氧杂氮环丁烷-1-羧酸叔丁酯。该反应路线的缺点是合成步骤较长,中间体纯化繁琐,提高了生产成本。工业化生产也存在难度。
[0007]
技术实现要素:
[0008]
本发明旨在解决现有技术中存在的技术问题。为此,本发明提供一种3-氧杂氮环丁烷-1-羧酸叔丁酯的制备方法,目的是简化合成步骤,反应条件温和。
[0009]
基于上述目的,本发明提供了一种3-氧杂氮环丁烷-1-羧酸叔丁酯的制备方法,包括如下步骤:
[0010]
步骤一、以丙酮、氨水和双氧水为原料,在烷基化试剂和酸的作用下生成氮杂环丁烷-3-酮盐酸盐;
[0011]
步骤二、将步骤一获得的氮杂环丁烷-3-酮盐酸盐与(boc)2o和碱以摩尔比1:0.7-1.2:1.0-1.5在室温下搅拌反应后,依次经水相调酸并浓缩、残渣萃取、有机相干燥、浓缩后,即得。
[0012]
所述步骤一中以丙酮、氨水和双氧水为原料,在烷基化试剂和酸的作用下生成氮杂环丁烷-3-酮盐酸盐的方法是先将丙酮、氨水、烷基化试剂与第一溶剂混合并加热至30-70℃,搅拌过程中滴加溶有双氧水的醇溶液,反应至无气泡生成,之后经加酸酸化、萃取、有机层洗涤、干燥、减压浓缩后得到氮杂环丁烷-3-酮盐酸盐。
[0013]
所述加酸酸化是加柠檬酸调节ph值为4-5。
[0014]
所述丙酮、烷基化试剂、氨水、双氧水和酸的摩尔比为1:1.0-5.0:1.0-5.0:1.0-2.0:0.3-1.2。
[0015]
所述烷基化试剂为碘甲烷、一氯甲烷、硫酸二甲酯、对甲苯磺酸甲酯中的一种或几种的组合;所述酸为氯酸、盐酸、次氯酸、高氯酸、对甲苯磺酸中的一种或几种的组合。
[0016]
所述步骤一中采用的第一溶剂为二氧六环、四氢呋喃、甲醇、乙醇中的一种或几种的组合。
[0017]
所述步骤二中碱为三乙胺、碳酸钾、碳酸钠、dbu、dipea中的一种或几种的组合。
[0018]
所述步骤二中水相调酸是调节水相的ph值为4-5。
[0019]
所述残渣萃取是采用乙酸乙酯萃取。
[0020]
所述步骤二在浓缩之后还包括采用石油醚和/或甲叔醚对浓缩后的粗产品进行重结晶提纯的步骤。
[0021]
本发明的有益效果:
[0022]
1、本发明反应过程简单,步骤少,对设备要求低,反应原料价格低廉;反应条件温和,有利于工业化生产。
[0023]
2、本发明在第一步制备氮杂环丁烷-3-酮盐酸盐的过程中所需要的加热温度不超过70℃,相比现有技术中采用热回流方法(温度为110-140℃)制备中间体,对热量及设备要求相对更低,节省资源和成本。并且,反应过程中并不需要特殊的设备进行监测,只需要根据气泡有无形成即可判断反应完成程度。
[0024]
3、本发明在第二步制备3-氧杂氮环丁烷-1-羧酸叔丁酯的过程中,对ph值调节范围在酸性,能够有效保证产物的合成,避免生成过多杂质。
附图说明
[0025]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0026]
图1为本发明实施例1制备的3-氧杂氮环丁烷-1-羧酸叔丁酯的核磁谱图。
具体实施方式
[0027]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
[0028]
需要说明的是,除非另外定义,本发明实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。
[0029]
实施例1
[0030]
(1)氮杂环丁烷-3-酮盐酸盐的制备
[0031]
将丙酮(116.16g,2mol,1eq),氨水(13mol/l)(138.46g,2mol,1eq),甲醇500ml,碘甲烷(141.9g,2mol,1eq),依次加入到2000ml单口瓶中加热至60℃,磁力搅拌。然后用注射器泵慢慢滴入溶解有50g过氧化氢(1.5mol,0.75eq)的甲醇。7小时后,反应溶液中反应溶液呈红色,继续反应4小时,无气泡形成。加入次氯酸1mol酸化30min,反应停止。室温下加入硫代硫酸钠水溶液1l,用2l乙酸乙酯萃取2次。有机层用饱和氯化钠水溶液1l洗涤一次,并在200g无水硫酸钠干燥。减压浓缩得到粗产品177.7g氮杂环丁烷-3-酮盐酸盐。收率为82.7%。
[0032]
(2)3-氧杂氮环丁烷-1-羧酸叔丁酯的制备
[0033]
以氮杂环丁烷-3-酮盐酸盐(107.5g,1mol,1eq)和(boc)2o(152.74g,0.7mol,0.7eq)反应,加入dbu(152.20g,1mol,1eq),溶剂为二氧六环500ml,反应容器为1l三口烧瓶。室温下搅拌18h,加入200ml水,用固体柠檬酸135g调节水相ph=4并浓缩。残渣用200ml*3乙酸乙酯萃取3次。有机相用100g无水na2s04干燥,然后浓缩得到白色固体。再用500ml甲叔醚重结晶得到纯产品3-氧杂氮环丁烷-1-羧酸叔丁酯158g。
[0034]
核磁共振h谱,unity invoa 400型dmso作溶剂,tms内标,图谱如图1所示。通过图谱可以看出3-氧杂氮环丁烷-1-羧酸叔丁酯的末端叔丁基的3个甲基δ1.427(s,9h);n杂环2个亚甲基δ4.676(s,9h)均能对应目标分子的氢化学位移与积分面积。
[0035]
实施例2
[0036]
(1)氮杂环丁烷-3-酮盐酸盐的制备
[0037]
将丙酮(11.62g,0.2mol,1eq),氨水(13mol/l)(13.85g,1mol,5eq),四氢呋喃500ml,对甲苯磺酸甲酯(186.2g,1mol,5eq),依次加入到500ml单口瓶中加热至50℃,磁力搅拌。然后用注射器泵慢慢滴入溶解有50g过氧化氢(1.5mol,0.75eq)的甲醇。7小时后,反应溶液中反应溶液呈红色,继续反应4小时,无气泡形成。加入次氯酸1mol酸化30min,反应停止。室温下加入硫代硫酸钠水溶液1l,用2l乙酸乙酯萃取2次。有机层用饱和氯化钠水溶液500ml洗涤一次,并在100g无水硫酸钠干燥。减压浓缩得到粗产品17.80g氮杂环丁烷-3-酮盐酸盐。收率为82.8%。
[0038]
(2)3-氧杂氮环丁烷-1-羧酸叔丁酯的制备
[0039]
将氮杂环丁烷-3-酮盐酸盐(107.5g,1mol,1eq)和(boc)2o(261.8g,1.2mol,1.2eq),碳酸钾(207.3g,1.5mol,1.5eq),溶剂为甲醇500ml,加入反应容器为1l三口烧瓶。室温下搅拌10h,加入150ml水,用固体柠檬酸105g调节水相ph=4并浓缩。残渣用200ml*3二氯甲烷萃取3次。有机相用100g无水na2s04干燥,然后浓缩得到白色固体。再用500ml石油醚重结晶得到纯产品3-氧杂氮环丁烷-1-羧酸叔丁酯160g。收率为92.39%。
[0040]
实施例3
[0041]
(1)氮杂环丁烷-3-酮盐酸盐的制备
[0042]
将丙酮(116.16g,2mol,1eq),氨水(13mol/l)(110.77g,1.6mol,1.2eq),乙醇1500ml,硫酸二甲酯(201.83g,1.6mol,1.2eq),依次加入到3000ml单口瓶中加热至65℃,磁
力搅拌。然后用注射器泵慢慢滴入溶解有50g过氧化氢(1.5mol,0.75eq)的甲醇。6小时后,反应溶液中反应溶液呈红色,继续反应3小时,无气泡形成。加入对甲苯磺酸1mol酸化30min,ph=5左右。反应停止。室温下加入硫代硫酸钠水溶液800ml,用1l乙酸乙酯萃取3次。有机层用饱和氯化钠水溶液0.8l洗涤一次,并在200g无水硫酸钠干燥。减压浓缩得到粗产品187.7g氮杂环丁烷-3-酮盐酸盐。收率为87.3%。
[0043]
(2)3-氧杂氮环丁烷-1-羧酸叔丁酯的制备
[0044]
以氮杂环丁烷-3-酮盐酸盐(107.5g,1mol,1eq)和(boc)2o(137.16g,0.9mol,0.9eq)反应,加入dbu(167.42g,1.1mol,1.1eq),溶剂为二氧六环500ml,反应容器为1l三口烧瓶。室温下搅拌13h,加入200ml水,用固体柠檬酸155g调节水相ph=4并浓缩。残渣用200ml*3乙酸乙酯萃取3次。有机相用100g无水na2s04干燥,然后浓缩得到白色固体。再用500ml甲叔醚重结晶得到纯产品3-氧杂氮环丁烷-1-羧酸叔丁酯159g。收率为74.0%。
[0045]
对比例1
[0046]
本对比例与实施例1的不同点在于,3-氧杂氮环丁烷-1-羧酸叔丁酯的制备中,以氮杂环丁烷-3-酮盐酸盐(107.5g,1mol,1eq)和(boc)2o(152.74g,0.7mol,0.7eq)反应,加入dbu(152.20g,1mol,1eq),溶剂为二氧六环500ml,反应容器为1l三口烧瓶。室温下搅拌18h,加入200ml水,用固体柠檬酸135g调节水相ph=7并浓缩。残渣用200ml*3乙酸乙酯萃取3次。有机相用100g无水na2s04干燥,然后浓缩。得到3-氧杂氮环丁烷-1-羧酸叔丁酯95g,收率为44.2%,可以与实施例1比较,收率大大下降。降低了反应效率,经济效益大大下降。
[0047]
对比例2
[0048]
本对比例与实施例1的不同点在于,3-氧杂氮环丁烷-1-羧酸叔丁酯的制备中,以氮杂环丁烷-3-酮盐酸盐(107.5g,1mol,1eq)和(boc)2o(152.74g,0.7mol,0.7eq)反应,加入dbu(152.20g,1mol,1eq),溶剂为二氧六环500ml,反应容器为1l三口烧瓶。室温下搅拌18h,加入200ml水,用固体柠檬酸135g调节水相ph=2并浓缩。残渣用200ml*3乙酸乙酯萃取3次。有机相用100g无水na2s04干燥,然后浓缩。能得到产品105g,收率为48.8%。
[0049]
以上2个对比例说明调节ph值对于最终的目标分子的收率有很大的影响。经过大量实验论证控制ph值在4-5才可以保证3-氧杂氮环丁烷-1-羧酸叔丁酯的收率在较高的水平。
[0050]
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。
[0051]
本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1