用于检测β-淀粉样蛋白的水溶性化合物的制作方法
用于检测
β-淀粉样蛋白的水溶性化合物
技术领域
1.本发明涉及一种用于检测β-淀粉样蛋白(aβ)的化合物及其制备方法。
2.具体地,本发明涉及水溶性成像剂及其制备方法。
背景技术:
3.随着现代医学的发展,全世界老年人的人口正在增加,因此,患有老年病痴呆的患者的数量也在迅速增加。阿尔茨海默病是痴呆的最常见形式,并且是一种以记忆丧失、认知和行为不稳定为指征的进行性神经变性疾病。该疾病的原因尚不清楚,但作为分析患者死后脑组织的结果,由神经细胞之间的β-淀粉样蛋白(aβ)肽(beta-amyloid(aβ)peptides)组成的淀粉样蛋白斑的累积、和由神经细胞中的过度磷酸化τ蛋白纤丝形成的神经原纤维缠结,已经被报道。
4.包括β-淀粉样肽(aβpeptide)在内的39至43个氨基酸衍生自较大的淀粉样前体蛋白(app)。在促淀粉样变途径中,由于β-和γ-分泌酶的连续蛋白水解,β-淀粉样肽从app中被切割。β-淀粉样肽作为可溶性蛋白被释放,并且可以在正常老化的脑中的脑脊液(csf)中以低水平被检测到。已知在阿尔茨海默病的进展过程中,β-淀粉样肽聚集形成脑或血管中的淀粉样沉积物。此外,还已知淀粉样蛋白沉积物在淀粉样变性中起一定作用,淀粉样变性是由淀粉样蛋白在不同器官和/或组织中异常沉积引起的疾病。
5.因此,为了诊断可通过定量检测淀粉样蛋白聚集体来诊断的疾病,包括阿尔茨海默病,已经研究了许多具有荧光的化合物,其与β-淀粉样聚集体良好结合并容易地指示其存在。
6.在相关领域开发的阿尔茨海默病诊断剂中,用于检测β-淀粉样蛋白(beta-amyloid)的正电子发射断层扫描(pet)成像剂和光学成像剂占大多数。
7.作为检测β-淀粉样蛋白的技术,β-淀粉样蛋白是一种引起阿尔茨海默病的蛋白,最近继续在相关领域的基于脑成像的技术中尝试检测眼视网膜中的β-淀粉样蛋白。例如,在美国,通过视网膜成像诊断阿尔茨海默病的临床试验正在进行中。
8.对于视网膜成像,最有效的是开发注射形式的β-淀粉样蛋白诊断剂,然后将该诊断剂注射到血管中。然而,现有的用于检测β-淀粉样蛋白的诊断剂被设计用于穿透血脑屏障(bbb),因此被设计为保留脂溶性特征。由于这些特征,当使用现有的诊断剂时,难以制备用于通过视网膜成像检测和诊断β-淀粉样蛋白的水溶性注射剂。
9.因此,有必要开发新的β-淀粉样蛋白诊断剂,其可用于制备通过视网膜成像检测和诊断β-淀粉样蛋白的水溶性注射剂。
技术实现要素:
10.技术问题
11.本发明的目的是提供一种用于检测β-淀粉样蛋白的化合物及其制备方法。
12.具体而言,本发明的目的在于提供一种用于检测β-淀粉样蛋白的化合物及其制备
方法,该化合物可用于水溶性注射剂。
13.此外,本发明的另一个目的是提供一种使用用于检测β-淀粉样蛋白的水溶性化合物来检测β-淀粉样蛋白的方法。
14.技术方案
15.为了实现上述目的,本发明提供了由化学式1表示的化合物或其药学上可接受的盐。
16.[化学式1]
[0017][0018]
在化学式1中,
[0019]
y为s或o,
[0020]
a为衍生自氨基芳基类化合物的官能团,
[0021]
r1和r2各自独立地为氢或c1至c
10
烷基,
[0022]
x为1至10的整数,和
[0023]
n和m各自独立地为0或更大的整数,且n+m≥1。
[0024]
此外,本发明提供了用于检测β-淀粉样蛋白的组合物,该组合物含有上述化合物或其药学上可接受的盐。
[0025]
此外,本发明提供了一种检测β-淀粉样蛋白的方法,该方法包括:将上述化合物或其药学上可接受的盐与含有β-淀粉样蛋白的样品混合;以及测量β-淀粉样蛋白的荧光信号。
[0026]
有益效果
[0027]
本发明的化合物对β-淀粉样蛋白具有优异的选择性结合能力,因此在通过pet成像、光学成像和/或pet-mri融合成像方法检测β-淀粉样蛋白方面是有效的。因此,该化合物可用作检测β-淀粉样蛋白和诊断由β-淀粉样蛋白过量产生引起的疾病的组合物。
[0028]
特别是,根据本发明的化合物具有优异的水溶性性质,因此可以提供用于检测β-淀粉样蛋白的水溶性制剂。因此,该化合物可用作通过视网膜成像检测β-淀粉样蛋白的组合物。
附图说明
[0029]
本说明书所附的以下附图示出了本发明的优选实施例,并且用于进一步理解本发明的技术思想以及本发明的上述内容,因此本发明不应被解释为仅局限于这些附图中示出的内容。
[0030]
图1示出了本发明的化学式1的化学结构的特征;
[0031]
图2示出了根据一个实施方案,测量化合物1、化合物2、化合物4和化合物5的吸光度的结果;
[0032]
图3示出了根据一个实施方案,化合物1、化合物2、化合物4和化合物5在结合β-淀
粉样蛋白之前和之后的荧光光谱;以及
[0033]
图4示出了使用根据实施例1的化合物1的视网膜成像实验。
具体实施方式
[0034]
如图1所示,本发明的化合物具有包括荧光信号部分、以及与荧光信号部分结合的β-淀粉样蛋白结合部分和水溶性赋予部分,的结构特征。特别是,当将本发明的化合物配制成水溶性组合物时,通过包括水溶性赋予部分,可以确保组合物的稳定性。此外,使用该化合物的水溶性组合物可以具有,该组合物可以用作视网膜成像剂,的特征。
[0035]
以下,将详细描述本发明。
[0036]
本发明提供了由化学式1表示的化合物或其药学上可接受的盐。
[0037]
[化学式1]
[0038][0039]
在化学式1中,
[0040]
y为s或o,
[0041]
a为衍生自氨基芳基类化合物的官能团,
[0042]
r1和r2各自独立地为氢或c1至c
10
烷基,
[0043]
x为1至10的整数,和
[0044]
n和m各自独立地为0或更大的整数,且n+m≥1。
[0045]
在一个实施方案中,y为s。
[0046]
在另一个实施方案中,y为o。
[0047]
在一个实施方案中,所述氨基芳基类化合物可为选自由苯胺、苯基哌嗪及其衍生物所组成的群组中的至少一种。
[0048]
具体地,所述氨基芳基类化合物可为n-取代的苯胺或n,n-取代的苯胺。这里,在苯胺的n位的取代基可以各自独立地选自c1至c6直链、支链和环状饱和脂肪族烃基和c1至c6不饱和脂肪族烃基,并且可为例如各自独立地选自甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、异丁基、正戊基、异戊基、叔戊基、正己基、乙烯基、烯丙基、丙烯基、丁烯基、戊烯基、己烯基、己二烯基、异丙烯基、异己烯基、环己烯基、环戊二烯基、乙炔基、丙炔基、戊炔基、己炔基、异己炔基、环己炔基、环戊基和环己基。
[0049]
更具体地说,所述氨基芳基类化合物可为n-甲基苯胺或n,n-二甲基苯胺。
[0050]
在另一个实施方案中,r1和r2可以各自独立地为c1至c
10
烷基。
[0051]
具体地,r1和r2可以各自独立地为c1至c6烷基,或c1至c3烷基。
[0052]
更具体地,r1和r2可以各自为甲基。
[0053]
在另一个实施方案中,x可为1至9的整数、1至8的整数、1至7的整数、1至6的整数、1至5的整数、2至6的整数或3至5的整数。
[0054]
具体地,x可为4。
[0055]
在另一个实施方案中,n和m可以各自独立地为0至10的整数。
[0056]
具体地,n和m可以各自独立地为0至9的整数、0至8的整数、0至7的整数、0至6的整数、0至5的整数、0至4的整数、0至3的整数或0至2的整数。
[0057]
更具体地说,在满足n+m≥1的范围内,n可为0或1的整数,m可为0、1或2的整数。
[0058]
根据一个实施方案,可作为由化学式1表示的化合物的实施例提及的化合物的化学结构式总结于下表1中。
[0059]
[表1]
[0060]
[0061]
[0062][0063]
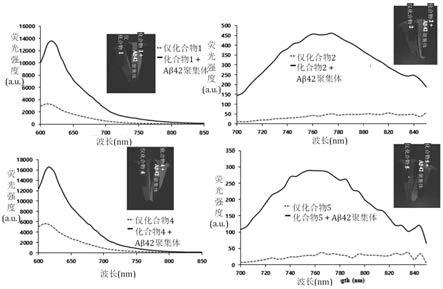
由化学式1表示的化合物可以以药学上可接受的盐的形式使用,并且所述盐可为使用药学上可接受的游离酸形成的酸加成盐。酸加成盐是从无机酸如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、亚硝酸和亚磷酸,无毒有机酸如脂族单羧酸酯和二羧酸酯、苯基取代的链烷酸酯、羟基链烷酸酯和链烷二甲酸酯、芳族酸和脂族和芳族磺酸,和有机酸如乙酸、苯甲酸、柠檬酸、乳酸、马来酸、葡糖酸、甲磺酸、4-甲苯磺酸、酒石酸和富马酸获得的。这样的药学上无毒盐的实例包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、氯化焦磷酸盐、溴化物、碘化物、氟化物、乙酸盐、丙酸盐、癸酸盐、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、癸酸盐、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己烷-1,6-二酸盐、苯甲酸盐、氯苯甲酸盐、苯甲酸甲酯、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、对苯二甲酸盐、苯磺酸盐、甲苯磺酸盐、氯苯磺酸盐、二甲苯磺酸盐、乙酸苯酯、丙酸苯酯、丁酸苯酯、柠檬酸盐、乳酸盐、β-羟基丁酸盐、羟乙酸盐、苹果酸盐、酒石酸盐、甲磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐和扁桃酸盐。
[0064]
本发明的酸加成盐可以通过常规方法制备,并且可以通过例如将化学式1表示的化合物溶解在有机溶剂如甲醇、乙醇、丙酮、二氯甲烷或乙腈中,加入有机酸或无机酸以形成沉淀,并且过滤和干燥沉淀,或者通过减压蒸馏溶剂和过量的酸并且干燥产物,并且在有机溶剂中结晶产物来制备。
[0065]
此外,可以使用碱来制备药学上可接受的金属盐。碱金属或碱土金属盐例如通过将化合物溶解在过量的碱金属氢氧化物或碱土金属氢氧化物溶液中,过滤未溶解的化合物盐,并蒸发和干燥滤液而获得。这里,制备钠盐、钾盐或钙盐作为金属盐是药学上合适的。此外,相应的盐通过使碱金属或碱土金属盐与合适的负盐(例如硝酸银)反应而获得。
[0066]
此外,本发明不仅包括由化学式1表示的化合物及其药学上可接受的盐,而且包括可由其制备的溶剂化物、水合物等。
[0067]
本发明的β-淀粉样蛋白检测用组合物含有上述化合物或其药学上可接受的盐。
[0068]
在本说明书中,“β-淀粉样蛋白”是指在阿尔茨海默病患者的脑中发现的淀粉样蛋白斑的主要成分,是与阿尔茨海默病密切相关的36至43个氨基酸的肽。
[0069]
在本说明书中,“β-淀粉样蛋白斑”是指各种不溶性纤维状蛋白质沉积在患者组织中的聚集状态,并且β-淀粉样蛋白斑包括通过聚集淀粉样蛋白形成的聚集体和/或由淀粉样蛋白的另外组合形成的淀粉样沉积物。
[0070]
在本说明书中,“β-淀粉样蛋白斑检测”或“由β-淀粉样蛋白斑过度产生引起的疾病的诊断”是使用β-淀粉样蛋白和/或β-淀粉样蛋白斑与根据本发明的化学式1表示的化合物或其药学上可接受的盐之间的结合进行的,并且“结合”是指化学相互作用,例如共价键、离子键、亲水-亲水相互作用、疏水-疏水相互作用和复合化合物键。
[0071]
在本说明书中,“由β-淀粉样斑块过量产生引起的疾病”可以包括痴呆、阿尔茨海默病、唐氏综合征、淀粉样血管病、脑淀粉样血管病、系统性淀粉样变、荷兰型淀粉样变、包涵体肌炎、地中海热病、穆-韦二氏综合征(muckle-wells综合征)、特发性骨髓瘤、淀粉样多神经病、淀粉样心肌病、系统性老年淀粉样变、遗传性脑出血伴淀粉样变(amyloidosis hereditary cerebral hemorrhage)、瘙痒病、克雅氏病、库鲁病、杰茨曼-斯脱司勒-史茵克综合征(gerstmann-straussler-scheinker syndrome)、甲状腺髓样癌、肌无力病和胰岛ii型糖尿病。
[0072]
在一个实施方案中,“检测用组合物”可以配制成成像剂,例如pet成像剂、使用活体中产生的可见或近红外范围内的光作为图像信号的光学成像剂、或pet-mri融合成像剂,然后用于pet成像方法、光学成像方法、或pet-mri融合成像方法中。当配制组合物时,根据需要,组合物可以进一步包含药学上可接受的载体。
[0073]
本发明的检测用组合物可以在临床给药时经口或肠胃外给药,可以以通常的制剂形态使用。组合物可以进一步含有药学上可接受的载体或添加剂,并且当配制组合物时,可以使用常用的填充剂、增量剂、粘合剂、润湿剂、崩解剂、稀释剂如表面活性剂、或赋形剂,制备制剂。
[0074]
在一个实施方案中,所述化合物表现出水溶性,因此所述组合物可以含有水作为溶剂。因此,所述组合物可以配制成水溶性注射剂,但本发明不限于此。
[0075]
本发明的β-淀粉样蛋白的检测方法包括将本发明的化合物或其药学上可接受的盐与含有β-淀粉样蛋白的样品混合的步骤,和测量β-淀粉样蛋白的荧光信号的步骤。
[0076]
在一个实施方案中,本发明提供了通过pet成像检测β-淀粉样蛋白的方法,该方法包括将本发明的化合物或其药学上可接受的盐与含有β-淀粉样蛋白的样品混合的步骤,和测量β-淀粉样蛋白的荧光信号的步骤。
[0077]
在另一个实施方案中,本发明提供了通过光学成像检测β-淀粉样蛋白的方法,该方法包括将根据本发明的化合物或其药学上可接受的盐与含有β-淀粉样蛋白的样品混合的步骤,和测量β-淀粉样蛋白的荧光信号的步骤。
[0078]
在另一个实施方案中,本发明提供了通过pet-mri融合成像检测β-淀粉样蛋白的方法,该方法包括将本发明的化合物或其药学上可接受的盐与含有β-淀粉样蛋白的样品混
合的步骤,和测量β-淀粉样蛋白的荧光信号的步骤。
[0079]
在此,根据本发明的化学式1表示的化合物或其药学上可接受的盐对β-淀粉样蛋白和/或β-淀粉样蛋白斑表现出高结合亲和力,并且形成特异性结合。
[0080]
将组合物给予受试者的步骤可以通过将可检测量的含有根据本发明的化合物或其药学上可接受的盐的组合物引入组织或受试者来进行。通过本领域技术人员已知的方法引入组织或受试者中。
[0081]
术语“组织”是指受试者身体的一部分。组织的示例可以包括视网膜、血管、脑、心脏、肝和动脉。“可检测量”是需要通过所选检测方法检测的组合物的量。本领域技术人员可以容易地确定引入患者体内用于检测的组合物的量。例如,可增加组合物的量并将其给予受试者,直到通过所选的检测方法检测到组合物中的有效成分。术语“受试者”是指人或另一种动物。本领域技术人员通过将上述组合物以可检测的量引入受试者中,然后在给药后的不同时间点检测标记物质,可以容易地确定根据本发明的化合物与淀粉样蛋白聚集体结合所需的时间。
[0082]
本发明的检测用组合物对受试者的给药可以通过全身或局部给药途径进行。例如,组合物可以口服、直肠内、肠胃外(静脉内、肌内或皮下)、脑池内、阴道内、腹膜内、膀胱内或局部(粉末、软膏或滴剂)施用,或者可以通过颊内或鼻内喷雾施用。可以将组合物给予受试者,使得组合物可以迁移通过身体。此外,可将组合物施用至感兴趣的特定器官或组织。
[0083]
在通过给予检测用组合物而产生的β-淀粉样蛋白聚集体的检测方法中,将含有本发明的化合物或其药学上可接受的盐的组合物以可检测的量导入到受试者中,经过足以使该化合物与淀粉样蛋白聚集体结合的时间后,可以非侵入性地检测受试者中的荧光标记物质。进一步地,从受试者分离组织样品,将上述组合物引入组织样品中,在经过足以使组合物中的化合物或其药学上可接受的盐与淀粉样蛋白聚集体结合的时间后,可以检测荧光标记物质。
[0084]
当使用根据本发明的检测用组合物时,可以表现出通过最近开发的视网膜成像检测β-淀粉样蛋白的有用效果。因此,通过视网膜成像诊断和治疗由β-淀粉样蛋白斑过量产生引起的疾病,特别是阿尔茨海默病的早期诊断和监测,可能提供了一种重要的手段。
[0085]
以下,将参照附图和实施例详细描述本发明。
[0086]
实施例1化合物1的合成
[0087]
化合物1:(e)-3-(2,4-(二甲氨基)苯乙烯基)-1,1-二甲基-1h-苯并[e]吲哚-3-正离子-3-基)丁烷-1-磺酸根离子
[0088][0089]
为了合成化合物1,将化合物7(43mg,0.289mmol)和化合物8(100mg,0.289mmol)溶
解于丁醇,并将生成物在130℃回流24小时。将反应物减压浓缩,然后通过色谱法(ch2cl2:meoh=5:1)分离,合成化合物1。
[0090]1h nmr(500mhz,meoh-d4,δ,ppm):1.80-1.83(2h,m),1.93-1.96(8h,m),2.51-2.52(2h,m),3.13(6h,s),4.60-4.63(2h,m),6.85(2h,d,j=9.0hz),7.37(1h,d,j=15.5hz),7.61(1h,t,j=7.0hz),7.72(1h,t,j=7.0hz),7.99(1h,d,j=8.0hz),8.12(2h,d,j=8.0hz),8.17(1h,d,j=9.0hz),8.32(1h,d,j=8.5hz),8.38(1h,d,j=15.5hz)。
[0091]
实施例2化合物2和化合物3的合成
[0092]
化合物2:(e)-4-(2-(2-(5-(4-(二甲氨基)苯基)噻吩-2-基)乙烯基)-1,1-二甲基-1h-苯并[e]吲哚-3-正离子-3-基)丁烷-1-磺酸根离子
[0093]
化合物3:(e)-4-(2-(2-(5
′‑
(4-(二甲氨基)苯基)-[2,2
′‑
联噻吩]-5-基)乙烯基)-1,1-二甲基-1h-苯并[e]吲哚-3-正离子-3-基)丁烷-1-磺酸根离子
[0094][0095]
将化合物11(167mg,0.7mmol)和pd(pph3)4(80mg,0.07mmol)溶于甲苯(10ml)。将化合物9或10(0.7mmol)溶于etoh(8ml),将生成物加入到混合物中。此外,加入2m k2co3(2ml),将生成物在120℃回流5小时,然后减压浓缩。用色谱法(己烷:乙酸乙酯=4:1)分离生成的混合物,合成化合物12或13。
[0096]
将化合物12或13(0.289mmol)和化合物8(100mg,0.289mmol)溶解于丁醇,并将生成物在130℃回流24小时。将反应物减压浓缩,然后通过色谱法(ch2cl2:meoh=5:1)分离,合成化合物2或3。
[0097]
化合物2:1h nmr(500mhz,meoh-d4,δ,ppm):2.04-20.9(8h,m),2.18-2.19(2h,m),2.93-2.96(2h,m),3.06(6h,s),4.64-4.67(2h,m),6.80(2h,d,j=8.5hz),7.13(1h,d,j=15.5hz),7.63(1h,t,j=4.0hz),7.70-7.76(3h,m),7.92(1h,d,j=8.5hz),7.96(1h,d,j=4.0hz),8.09(1h,d,j=8.5hz),8.17(1h,d,j=9.5hz),8.35(1h,d,j=8.0hz),8.65(1h,d,j=15.5hz)
[0098]
化合物3:1h nmr(500mhz,dmso-d6,δ,ppm):1.81-1.84(2h,m),2.0-2.01(8h,m),2.54-2.57(2h,m),2.97(6h,s),4.72-4.75(2h,m),6.78(2h,d,j=9.0hz),7.35(1h,d,j=15.8hz),7.42(1h,d,j=3.9hz),7.55(2h,d,j=8.9hz),7.62-7.64(2h,m),7.67-7.71(1h,
m),7.77-7.80(1h,m),8.12(1h,d,j=9.0hz),8.19(1h,d,j=8.1hz),8.23-8.26(2h,m),8.40(1h,d,j=8.1hz),8.72(1h,d,j=15.7hz)
[0099]
实施例3化合物4的合成
[0100]
化合物4:(e)-4-(1,1-二甲基-2-(4-(哌嗪-1-基)苯乙烯基)-1h-苯并[e]吲哚-3-正离子-3-基)丁烷-1-磺酸根离子
[0101][0102]
将化合物14(84mg,0.289mmol)和化合物8(100mg,0.289mmol)溶解于丁醇,并将生成物在130℃回流24小时。将反应物减压浓缩,然后通过色谱法(ch2cl2:meoh=5:1)分离,合成化合物15。将化合物15溶解于ch2cl4中,加入tfa,室温下搅拌12小时,得到化合物4。
[0103]1h nmr(500mhz,meoh-d4,δ,ppm):1.82-1.83(2h,m),1.97-1.99(8h,m),2.53-2.54(2h,m),3.22-3.24(2h,m),3.69-3.71(2h,m),4.69-4.72(2h,m),7.12(2h,d,j=9.0hz),7.53(1h,d,j=15.5hz),7.65(1h,t,j=7.0hz),7.75(1h,t,j=7.0hz),8.05(1h,d,j=8.0hz),8.15-8.22(4h,m),8.35(1h,d,j=8.5hz),8.43(1h,d,j=15.5hz)。
[0104]
实施例4化合物5和化合物6的合成
[0105]
化合物5:(e)-4-(1,1-二甲基-2-(2-(5-(4-(甲基氨基)苯基)噻吩-2-基)乙烯基)-1h-苯并[e]吲哚-3-正离子-3-基)丁烷-1-磺酸根离子
[0106]
化合物6:(e)-4-(1,1-二甲基-2-(2-(5
′‑
(4-(甲基氨基)苯基)-[2,2
′‑
联噻吩]-5-基)乙烯基)-1h-苯并[e]吲哚-3-正离子-3-基)丁烷-1-磺酸根离子
[0107][0108]
将化合物16(1g,5.43mmol)溶解在thf中,加入boc酸酐(2.36g,10.86mmol)。将混
合物在80℃回流12小时,然后减压浓缩。用色谱法(己烷:乙酸乙酯=9:1)分离混合物,合成化合物17。
[0109]
将化合物17(200mg,0.7mmol)和pd(pph3)4(80mg,0.07mmol)溶于甲苯(10ml)。将化合物9或10(0.7mmol)溶于etoh(8ml),将生成物加入到混合物中。此外,加入2m k2co3(2ml),将生成物在120℃回流5小时,然后减压浓缩。用色谱法(己烷:乙酸乙酯=4:1)分离生成的混合物,合成化合物18或19。
[0110]
将化合物18或化合物19(0.289mmol)和化合物8(100mg,0.289mmol)溶解于丁醇,并将生成物在130℃回流24小时。将反应物减压浓缩,然后通过色谱法(ch2cl2:meoh=5:1)分离,合成化合物20或化合物21。将化合物20或化合物21溶解于ch2cl2中,加入tfa,室温下搅拌12小时,得到化合物5或化合物6。
[0111]
化合物5:1h nmr(500mhz,meoh-d4,δ,ppm):2.01-2.05(8h,m),2.16-2.19(2h,m),2.93-2.96(2h,m),3.29(3h,s),4.64-4.67(2h,m),6.85(2h,d,j=8.5hz),7.15(1h,d,j=15.5hz),7.53(1h,d,j=4.0hz),7.63(1h,t,j=7.5hz),7.71-7.76(3h,m),7.92(1h,d,j=8.5hz),7.96(1h,d,j=4.0hz),8.09(1h,d,j=8.5hz),8.15(1h,d,j=9.5hz),8.35(1h,d,j=8.0hz),8.62(1h,d,j=15.5hz)
[0112]
化合物6:1h nmr(500mhz,dmso-d6,δ,ppm):1.81-1.83(2h,m),2.0-2.01(8h,m),2.54-2.57(2h,m),2.96(3h,s),4.71-4.73(2h,m),6.77(2h,d,j=9.0hz),7.34(1h,d,j=15.8hz),7.41(1h,d,j=3.9hz),7.52(2h,d,j=8.9hz),7.61-7.63(2h,m),7.67-7.71(1h,m),7.78-7.80(1h,m),8.11(1h,d,j=9.0hz),8.18(1h,d,j=8.1hz),8.24-8.27(2h,m),8.41(1h,d,j=8.1hz),8.72(h,d,j=15.7hz)
[0113]
实验例1化合物吸光度的测定
[0114]
本发明化合物1、2、4和5的最大激发和发射波长λ
max
通过spectramax m2(molecular devices)测量。10μm的aβ42原纤和5μm的由上述方法产生的各化合物,作为在pbs缓冲液中使用的终浓度。通常,通过扫描固定的第一发射来确定激发λ
max
,并且通过用固定的λ
max
扫描激发光谱来确定发射λ
max
。
[0115]
测定上述合成的化合物1、化合物2、化合物4、化合物5的吸光度,结果如图2所示。
[0116]
实验例2与β-淀粉样蛋白结合后的活性评价
[0117]
对于上述合成的化合物1、化合物2、化合物4、化合物5,评价与β-淀粉样蛋白结合前后的活性,其结果如图3所示。在图3的右上侧的各矩形框中,化合物1、化合物2、化合物4、化合物5(结合前)中的一方显示为深灰色的区域,化合物1、化合物2、化合物4、化合物5(结合β-淀粉样蛋白:“aβ42聚集体”)中的一方显示为浅灰色的区域(这些灰色在实际的荧光图像中,相当于红色)。
[0118]
另外,化合物1、化合物2、化合物4、化合物5在与β-淀粉样蛋白结合前后的吸收波长如下述表2所示。如下表2所示,确认了当本发明的化合物与β-淀粉样蛋白结合时,荧光强度显着增加。特别是,关于对β-淀粉样肽的荧光反应性,化合物1、2、4和5的faβ/f0值分别为4.3、11.6、3.1和9.6,表明高荧光性质(参见下表2)。
[0119]
此外,从图3中确认,在根据本发明的化合物结合至淀粉样蛋白斑之前和之后,发射波长存在明显差异。
[0120]
[表2]
[0121]
荧光特性化合物1化合物2化合物4化合物5λ
ex
(nm)560nm805nm570nm575nmλ
em
(nm)620nm765nm620nm760nm与β-淀粉样蛋白结合后荧光强度的变化(倍)4.311.63.19.6
[0122]
实验例3实验小鼠的视网膜靶向实验
[0123]
将水溶性化合物1(8mg/kg)注射到3月龄裸鼠的尾静脉中,并用ivis spectrum ct系统装置进行成像,其结果如图4所示。
[0124]
如图4所示,在静脉注射到裸鼠中1分钟后,在小鼠的眼睛中检测到水溶性化合物1的强荧光信号。
[0125]
而在“对照”(没有添加任何化合物用于检测β-淀粉样蛋白)的情况下没有检测到荧光信号,并且在静脉注射后10分钟(足够的排泄时间)在小鼠眼中检测到水溶性化合物1的弱荧光信号。
[0126]
该结果表明,水溶性化合物1可以通过视网膜成像用于诊断由淀粉样蛋白异常沉积引起的疾病,例如阿尔茨海默病。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1