噬菌体及其应用的制作方法
1.本发明涉及养殖技术领域,特别涉及一种噬菌体及其应用。
背景技术:
2.沙门氏菌是肠杆菌科的一个属,其特征为革兰氏阴性、兼性厌氧、非产芽孢、杆状细菌,并且大部分菌株通过鞭毛活动。沙门氏菌属是引起家畜以及人感染的病原微生物。肠道沙门氏菌—沙门氏菌的一个种—具有多种血清型,包括鸡沙门氏菌、鸡白痢沙门氏菌、鼠伤寒沙门氏菌、肠炎沙门氏菌、伤寒沙门氏菌(salmonella typhi)、猪霍乱沙门氏菌(salmonella choleraesuis)和德比沙门氏菌(salmonella derby)。
3.沙门氏菌病,又名副伤寒(paratyphoid),是各种动物由沙门氏菌属细菌引起的疾病总称。临诊上多表现为败血症和肠炎,也可使怀孕母畜发生流产。鸡沙门氏菌病和鸭沙门氏菌病属于沙门氏菌病中较为常见的两种。沙门氏菌病一旦在家禽、猪和牛中爆发,将难以用治疗剂控制。原因是沙门氏细菌对各种药物具有很强的抗性,并且在细胞内存活,而抗生素不能渗入其中。
4.噬菌体可特异性裂解病原微生物,目前被作为一种新型抗菌物质而广泛使用。但细菌仍有一定几率通过形成突变株而产生对噬菌体的抗性。因此,亟需发掘出更多的噬菌体以构建具有丰富多样性的沙门氏菌噬菌体库以降低细菌产生噬菌体抗性的概率。
技术实现要素:
5.本发明的主要目的是提出一种噬菌体及其应用,旨在提供一种特异性强的噬菌体,其对鸡源、鸭源以及猪源沙门氏菌均具有较高的裂解活性,可以有效治疗由鸡源沙门氏菌、鸭源沙门氏菌以及猪源沙门氏菌中的至少一种引起的传染病。
6.为实现上述目的,本发明提出一种噬菌体,所述噬菌体已被送至中国普通微生物菌种保藏管理中心,地址:北京朝阳区中国科学院微生物研究所,分类命名为沙门氏菌噬菌体s142,保藏编号为cgmcc no.23083,保藏时间为2021年08月16日。
7.此外,本发明还提出一种如上文所述的噬菌体在制备治疗或预防沙门氏菌病的药物或饲料中的应用,其中,所述沙门氏菌病为由鸡源沙门氏菌、鸭源沙门氏菌以及猪源沙门氏菌中的至少一种引起的传染病。
8.可选地,所述药物包括口服制剂、喷剂或注射剂。
9.本发明技术方案中,通过在青岛平度海奥肉鸡养殖有限公司(养殖场)的粪便或污水中分离出属长尾噬菌体科的s142噬菌体,该噬菌体爆发量高达1.8
×
104pfu/ml,有强增殖能力,在短时间内便可增殖获得大量的噬菌体子代,极大地降低了制备时间,同时对温度、ph、紫外有较好的耐受能力,可裂解鸡源、鸭源、猪源沙门氏菌、裂解率分别为72.8%、69.6%、100%,对由鸡源沙门氏菌、鸭源沙门氏菌以及猪源沙门氏菌中的至少一种引起的传染病均有很强的治疗作用,表现出良好的开发价值。
附图说明
10.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
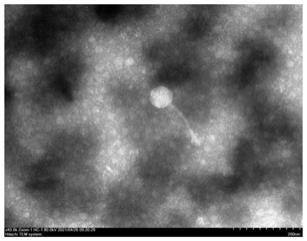
11.图1为实施例2中噬菌体s142的电镜图;
12.图2为实施例2中噬菌体s142的噬菌斑形态图;
13.图3为实施例4中噬菌体s142的ph稳定性变化图;
14.图4为实施例4中噬菌体s142的热稳定性变化图;
15.图5为实施例4中噬菌体s142的紫外线稳定性变化图;
16.图6为实施例5中噬菌体s142的一步生长曲线图;
17.图7为实施例6中噬菌体s142防治沙门氏菌感染雏鸡模型的效果对比图。
18.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
19.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
20.沙门氏菌是肠杆菌科的一个属,其特征为革兰氏阴性、兼性厌氧、非产芽孢、杆状细菌,并且大部分菌株通过鞭毛活动。沙门氏菌属是引起家畜以及人感染的病原微生物。肠道沙门氏菌—沙门氏菌的一个种—具有多种血清型,包括鸡沙门氏菌、鸡白痢沙门氏菌、鼠伤寒沙门氏菌、肠炎沙门氏菌、伤寒沙门氏菌(salmonella typhi)、猪霍乱沙门氏菌(salmonella choleraesuis)和德比沙门氏菌(salmonella derby)。
21.沙门氏菌病,又名副伤寒(paratyphoid),是各种动物由沙门氏菌属细菌引起的疾病总称。临诊上多表现为败血症和肠炎,也可使怀孕母畜发生流产。鸡沙门氏菌病和鸭沙门氏菌病属于沙门氏菌病中较为常见的两种。沙门氏菌病一旦在家禽、猪和牛中爆发,将难以用治疗剂控制。原因是沙门氏细菌对各种药物具有很强的抗性,并且在细胞内存活,而抗生素不能渗入其中。
22.噬菌体可特异性裂解病原微生物,目前被作为一种新型抗菌物质而广泛使用。但细菌仍有一定几率通过形成突变株而产生对噬菌体的抗性。因此,亟需发掘出更多的噬菌体以构建具有丰富多样性的沙门氏菌噬菌体库以降低细菌产生噬菌体抗性的概率。
23.本发明提出了一种噬菌体,所述噬菌体由发明人从在青岛平度海奥肉鸡养殖有限公司(养殖场)采集到的粪便以及污水中分离得到,目前已被送至中国普通微生物菌种保藏管理中心,地址:北京朝阳区中国科学院微生物研究所,分类命名为沙门氏菌噬菌体s142,保藏编号为cgmcc no.23083,保藏时间为2021年08月16日。
24.所述噬菌体s142的菌学特性如下所述:
25.所述噬菌体s142属于长尾噬菌体科,爆发量高达1.8
×
104pfu/ml,有强增殖能力,在短时间(80min)内便可增殖获得大量的噬菌体子代。经耐热性、ph耐受性和紫外线耐受性
测试,该菌株能耐受70℃以下温度环境以及ph6.0~10.0酸碱环境,且在紫外线照射下40min以内能够维持稳定。此外,该噬菌体可裂解鸡源、鸭源、猪源沙门氏菌,且裂解率分别为72.8%、69.6%、100%,对由鸡源沙门氏菌、鸭源沙门氏菌以及猪源沙门氏菌中的至少一种引起的传染病均有很强的治疗作用。
26.对该噬菌体进行基因组测序,结果显示其基因组序列长度为43324bp,gc含量为49.5%。该噬菌体预测到的orf个数为63个,其编码基因的累加长度为39786bp,平均长度为631bp,编码区域长度占基因组的比例为91.83%。63个orf中,有20个orf为已知。
27.进一步对其序列进行同源性比对,选取数据库中有同源性的15株噬菌体(沙门氏菌噬菌体sidste、沙门氏菌噬菌体5sent、沙门氏菌噬菌体demigod、沙门氏菌噬菌体celemicas、沙门氏菌噬菌体se2、沙门氏菌噬菌体vb_sens-ent3、沙门氏菌噬菌体piz_sae-01e2、沙门氏菌噬菌体vb-sens-enje1、沙门氏菌噬菌体st3、沙门氏菌噬菌体vb_sens-pvp-se2、沙门氏菌噬菌体nbsal007、沙门氏菌噬菌体vb_sens-enje6、沙门氏菌噬菌体vb_spus_sp4、沙门氏菌噬菌体vb_spus_spp11、沙门氏菌噬菌体s55)绘制进化树,结果显示,进化树大致分为两个分支,噬菌体s142与沙门氏菌噬菌体se2、沙门氏菌噬菌体vb_sens-ent 3等属于同一分支且亲缘关系较近。
28.本发明还提出了一种如上文所述的噬菌体在制备治疗或预防沙门氏菌病的药物或饲料中的应用,其中,所述沙门氏菌病为由鸡源沙门氏菌、鸭源沙门氏菌以及猪源沙门氏菌中的至少一种引起的传染病。
29.本噬菌体s142可裂解鸡源、鸭源、猪源沙门氏菌,且具有强增殖能力,经济效益高,且具有天然安全的优点,因此,可以作为沙门氏菌病的治疗药物的活性组分,或者是作为饲料添加剂使用,采用本噬菌体s142制得的药物或者饲料可以快速、有效地抑制、治疗沙门氏菌病。
30.其中,药物可以根据常规制剂加工方法被加工成多种剂型,其具体剂型可根据实际使用环境进行调整。本实施例中,上述药物可以是口服制剂、喷剂或注射剂等。此外,噬菌体加工成饲料添加剂时,该添加剂的形态可以是液体,也可以是干燥粉末或者颗粒。
31.本发明技术方案中,通过在鸡(鸭)场的粪便或污水中分离出属长尾噬菌体科的s142噬菌体,该噬菌体爆发量高达1.8
×
104pfu/ml,有强增殖能力,在短时间内便可增殖获得大量的噬菌体子代,极大地降低了制备时间,同时对温度、ph、紫外有较好的耐受能力,可裂解鸡源、鸭源、猪源沙门氏菌、裂解率分别为72.8%、69.6%、100%,对由鸡源沙门氏菌、鸭源沙门氏菌以及猪源沙门氏菌中的至少一种引起的传染病均有很强的治疗作用,表现出良好的开发价值。
32.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
33.实施例1 s142噬菌体的分离(点板法)
34.由菌种库中筛选96株沙门氏菌菌种作为分离噬菌体的宿主菌,进行复苏培养:用接种环挑取一环-80℃甘油冻存的沙门氏菌菌液,在普通营养琼脂培养基上划线分离单菌落,37℃恒温箱内培养16h。次日将96株沙门氏菌挑取单菌落接种至2ml的96孔深孔板中过夜培养。
35.将在青岛平度海奥肉鸡养殖有限公司采集的粪水样品加入200ml lb于37℃恒温
箱浸泡过夜,用纱布过滤掉多余杂质待用,0.22um过滤除菌。富集的粪水中加入上述培养的96株沙门氏菌混合菌液,每株细菌100ul,于37℃恒温箱内培养18-24h。次日将培养好的粪水进行离心,10000r/min,离心10min,留取上清液0.45um过滤。取3ul上述滤液+10ul单株沙门氏菌菌液混合均匀后取10ul点样于已制备好的大平皿中,37℃恒温箱内培养3h,观察点样位置是否出现噬菌斑。出现宿主斑即为初步分离到的噬菌体。
36.噬菌体的纯化:选择出现噬菌斑的细菌作为该噬菌体相应的宿主(例如,宿主菌21-1944),将噬菌斑切出来,镊子捣碎(可水浴帮助浸出),震荡,离心12000r/min,2-3min。萃取后进行10倍比稀释,每个梯度取100ul浸出液加入100ul相应的菌液,倒入5ml 47℃半固体lb培养基混合,倒双层平板。待上层半固体lb培养基凝固后放入37℃恒温培养箱中培养3-4h。上述出现单独且清晰透亮的噬菌体平板上用枪头挑取单斑,置于1ml生理盐水中,萃取后过滤除菌,所得经过第一次纯化的噬菌体液置于4℃保存。连续重复3~4次单噬菌斑穿刺进行噬菌体的纯化,直至平板中每个噬菌斑大小均一,得纯化沙门氏菌噬菌体s142菌液,存储在4
°
或者1:1加入sm buffer存储至-80
°
。
37.噬菌体的增殖:分别取纯化完成沙门氏菌噬菌体s142噬菌体增殖液200μl和宿主菌21-1944菌液100μl s142,置于5ml的灭菌营养肉汤中,混合均匀后放入37℃的恒温振荡培养箱中培养2~3h,待混合液变混又变澄清后,将混合液在12000r/min条件下离心1min。待离心完,使用0.22μl的微孔滤膜对上清进行过滤,获得增殖的噬菌体滤液,保存于4℃备用。
38.实施例2 s142噬菌体的鉴定
39.(1)取20μl s142噬菌体增殖液进行十倍比稀释,取合适稀释梯度的增殖液50μl与宿主菌21-1944菌液50μl,加入已经融化好的上层琼脂中(温度约为50-60℃),并用手搓试管使其混合均匀,迅速倒入已经准备好的底层琼脂平板,旋转平板使上层琼脂混合均匀,等到琼脂凝固后放于37℃的恒温培养箱中进行培养,3h后观察噬菌斑形态。结果如图2所示,从图中可以看出,s142噬菌体在双层平板上可以形成圆形透明的噬菌斑,直径约为4mm。
40.(2)取200μl贮存备用的噬菌体增殖液,将铜网正放于封口膜上,向铜网上滴加20μl样品后静置约15min,用滤纸吸去多余液体。继续向铜网滴加10μl的2%磷钨酸(pta),染色5min,用滤纸吸去多余的染液,自然晾干后用透射电子显微镜观察噬菌体形态,如图1所示。从图中可以看到,噬菌体由明显的正六边形头部和不可伸缩的尾部构成,头部直径约为72nm,尾部长约140nm,属于长尾噬菌体科。
41.(3)将s142噬菌体增殖液送到深圳市惠通生物科技有限公司,采用illumina测序方法完成毒株的基因组扫描测序,拼接出全基因组序列,并对其进行注释和分析。结果如下:
42.s142噬菌体属于有尾噬菌体目长尾噬菌体科,其基因组序列长度为43324bp,gc含量为49.5%。该噬菌体预测到的orf个数为63个,其编码基因的累加长度为39786bp,平均长度为631bp,编码区域长度占基因组的比例为91.83%。63个orf中,有20个orf为已知。
43.将s142噬菌体基因组序列在ncbi的数据库中进行同源性对比和分析,选取覆盖率和同源性较高的噬菌体毒株,绘制噬菌体s142的进化树,结果显示,进化树大致分为两个分支,噬菌体s142与沙门氏菌噬菌体se2、沙门氏菌噬菌体vb_sens-ent 3等属于同一分支且亲缘关系较近;沙门氏菌噬菌体vb_sens-enje 1、沙门氏菌噬菌体vb_sens_pvp-se2等属于
另一分支。
44.实施例3 s142噬菌体的最佳感染复数(moi)的测定
45.分别将s142噬菌体和宿主菌21-1944进行十倍比稀释,按照适宜的比例混匀(如下表1所示)。加入5ml的灭菌营养肉汤,后放入37℃全温振荡培养箱进行振荡培养3h,取出后12000rpm离心20min,再取上清,并用0.22μm的过滤器抽滤除菌,即可获得噬菌体增殖液。将噬菌体增殖液稀释到适宜的浓度,然后利用双层平板法测定噬菌体的最佳感染复数和效价,结果记入表1。
46.表1
[0047][0048]
结果显示:在感染复数为0.001时,噬菌体s142的效价最高达到6.2
×
10
10
pfu/ml。因此该噬菌体的最佳感染复数为0.001。
[0049]
实施例4 s142噬菌体的裂解谱的测定
[0050]
选择由全国各地分离到的(96株鸡源沙门氏菌、96株鸭源沙门氏菌、20株猪源沙门氏菌),采用点板法来做噬菌体s142的裂解谱分析,具体操作如下:
[0051]
将复苏好的沙门氏菌的菌板挑取单菌落接种到肉汤培养基中,160r/min过夜培养。将菌液浓度调整到0.5麦氏浓度,棉签蘸取菌液涂板,板子标记好菌株信息。将待测的噬菌体做倍比稀释,选取合适梯度进行点样,每个梯度取5ul点到涂好菌层的板子上,37℃恒温箱内培养,倒置培养3~4h后观察结果,出现噬菌斑为裂解,否则为不裂解。若对裂解谱结果有疑问,可进行双层平板验证。
[0052]
结果显示:噬菌体s142对96株鸭源裂解率高达69.6%,对96株鸡源沙门氏菌的裂解率高达72.8%,对20株猪源沙门氏菌裂解率高达100%。
[0053]
实施例4 s142噬菌体的裂解谱的测定稳定性的测定
[0054]
(1)ph稳定性
[0055]
取100μl s142噬菌体滤液(10
10
pfu/ml)放于4.5ml已经调好ph(即ph为3、4、5、6、7、8、9、10、11、12、13)的灭菌肉汤内,水浴37℃进行孵育,分别在1h、2h和3h时进行取样。取20μl样品进行10倍的梯度稀释,然后取稀释液50μl与宿主菌21-1944等量混匀后取出10μl在培养皿上进行点样,37℃恒温培养箱培养,根据噬菌斑数量确定合适的梯度,随后使用双层平板法测定噬菌体效价,重复3次,分析噬菌体在不同ph中的稳定性。结果如图3所示。
[0056]
结果分析:噬菌体s142在ph 6-10范围内较为稳定,但是在ph《6或者ph》10时,噬菌体的活性受到影响。尤其在ph 3的条件下,噬菌体效价随时间延时迅速下降,但仍有活性。在ph10-12范围下,处理1-3h噬菌体s142的效价下降1-3个数量级,当ph 13时迅速失活。
[0057]
(2)热稳定性
[0058]
取1ml s142噬菌体滤液(10
10
pfu/ml)放于1.5ml的ep管中,分别在温度为30、40、50、60、70℃条件下进行水浴,每隔20min取样,共取样3次。取20μl培养液进行10倍的梯度稀释,然后取稀释液50μl与宿主菌21-1944等量混匀后取出10μl在培养皿上进行点样,37℃恒温培养箱培养,根据噬菌斑数量确定合适的梯度,随后使用双层平板法测定噬菌体效价,重复3次,分析噬菌体在不同温度中的稳定性。结果如图4所示。
[0059]
结果分析:噬菌体s142处于温度为30℃、40℃、50℃、60℃时在1h内相对稳定,但是当70℃时处理20min,噬菌体效价便下降了四个数量级,仅为1.88
×
107puf/ml,并且随着时间的增长效价不断下降。因此,当温度在70℃以下,噬菌体s142的活性比较稳定。
[0060]
(3)紫外线稳定性
[0061]
取200μl s142噬菌体滤液(10
10
pfu/ml)与1800μl生理盐水混合于灭过菌的圆形一次性培养平皿,将平皿的盖子打开让其直接暴露在紫外灯的正下方(置于距离紫外灯50cm处)。在该条件下进行计时,分别于10min、20min、30min、40min、50min、60min时进行取样,取20μl培养液进行10倍的梯度稀释,然后取稀释液50μl与宿主菌21-1944等量混匀后取出10μl在培养皿上进行点样,37℃恒温培养箱培养,根据噬菌斑数量确定合适的梯度,随后使用双层平板法测定噬菌体效价,重复3次,分析噬菌体对于紫外线的耐受性。结果如图5所示。
[0062]
结果分析:在照射10min,噬菌体效价明显下降约三个数量级,效价仅为1
×
108puf/ml;在照射20、30、40min时,噬菌体效价变化不大,维持在105puf/ml上下;在照射50min时,噬菌体全部死亡。因此,说明噬菌体s142对紫外在短时间(40min)内具有一定的抵抗力。
[0063]
实施例5 s142噬菌体的一步生长曲线的测定
[0064]
先各取400μl稀释好的噬菌体(106pfu/ml)和宿主菌21-1944(109cfu/ml),混合后在37℃全温振荡培养箱中温育5min,使噬菌体吸附于细菌,温育后于12000r/min离心1min,弃上清,用灭菌营养肉汤进行2次冲洗去除游离的噬菌体,加入7ml的灭菌营养肉汤中并充分摇匀,将混合液放于37℃恒温培养箱震摇培养。取样200μl(前1h每5min取样一次、1h到2h每隔20min取样一次、2h到3h每隔30min取样一次),12000r/min离心1min,取上清,稀释到适宜的浓度梯度,使用双层平板法测定噬菌体效价,重复3次,绘制该噬菌体的一步生长曲线。结果如图6所示。
[0065]
结果分析:该噬菌体的潜伏期为15min,随后噬菌体效价急剧增加,在80min之后逐渐保持平稳,即判断噬菌体的爆发期为65min。通过计算可得该噬菌体的爆发量为1.8
×
104。
[0066]
实施例6噬菌体s142防治沙门氏菌感染雏鸡模型效果
[0067]
取20只21日龄三黄鸡,分为2组,每组10只,一组作为细菌对照组,另一组作为噬菌体组。细菌对照组进行肌肉注射108cfu菌液;噬菌体组在进行肌肉注射108cfu菌液2h后,再次肌肉注射108pfu噬菌体。对2组雏鸡的存活率进行统计。结果如图7所示。
[0068]
结果分析:细菌对照组鸡只死亡率达50%,肌肉注射108pfu/只以上的噬菌体能够完全保护沙门氏菌造成的感染。
[0069]
取60只1周龄鸡,分为4组,每组15只。试验分组情况和给药情况见下表:
[0070][0071]
首先给鸡肌肉注射沙门氏菌感染鸡的模型,在接菌0.5h后,各试验组分别接种不同剂量的噬菌体。肌肉注射噬菌体后,在相同环境条件下饲养,观察各组鸡的精神状态和生存情况,并对死亡的鸡进行剖检,观察内脏器官病变情况。
[0072]
结果分析:对死亡的鸡进行解剖发现,死亡的鸡肝脏有明显淤血,对肝脏部位进行细菌分离鉴定表明是沙门氏菌。细菌对照组鸡只死亡率达50%,肌肉注射108pfu/只以上的噬菌体能够完全保护沙门氏菌造成的感染。
[0073]
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1