一种治疗甲基苯丙胺成瘾的药物及其应用
1.本发明涉及生物医药领域,更具体地,涉及治疗甲基苯丙胺成瘾的药物及其应用。
背景技术:
2.甲基苯丙胺(methamphetamine,meth)俗称“冰毒”,是一种人工合成的苯丙胺类中枢神经系统兴奋剂,同时是一种普遍滥用且易上瘾的药物。由于其具体成瘾机制尚未完全清楚,因此对甲基苯丙胺成瘾的临床治疗效果不佳。针对甲基苯丙胺成瘾治疗的研究,俨然已经成为当前亟待解决的一个医学与社会问题。
技术实现要素:
3.为了解决上述技术问题,本发明提供了一种治疗甲基苯丙胺成瘾的药物及其应用,能够制备治疗甲基苯丙胺成瘾。
4.一方面,本发明实施例提供了一种治疗甲基苯丙胺成瘾的药物,所述药物包括:ppm1f基因的重组病毒,所述重组病毒的载体为腺相关病毒。
5.具体地,所述药物包括:ppm1f基因的重组病毒,所述重组病毒的载体为腺相关病毒,血清型为9型。
6.另一方面,本发明实施例提供了一种ppm1f基因的重组病毒的应用,如上所述的ppm1f基因的重组病毒用于制备治疗甲基苯丙胺成瘾的药物的应用。
7.本发明实施例提供了一种治疗甲基苯丙胺成瘾的药物,该药物为ppm1f 基因的重组病毒,在中缝背核中操控ppm1f的表达具有显著的抑制冰毒诱导 cpp行为的效果,使得该药物具有良好的治疗甲基苯丙胺成瘾的效果。
8.本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所特别指出的结构来实现和获得。
附图说明
9.附图用来提供对本发明技术方案的进一步理解,并且构成说明书的一部分,与本技术的实施例一起用于解释本发明的技术方案,并不构成对本发明技术方案的限制。
10.图1是本发明实施例提供的试验组小鼠中缝背核脑区注射 aav-ppm1f-gfp(以下简称aav-ppm1f)病毒后中缝背核脑区存在显著的 gfp绿色荧光的表达图。标尺为100μm。
11.图2是本发明实施例提供的aav-ppm1f和aav-gfp在中缝背核脑区过表达ppm1f蛋白对比图。
12.图3是本发明实施例提供的aav-ppm1f和aav-gfp分别在小鼠中缝背核脑区ppm1f蛋白的表达量对比图,图中,***为与aav-gfp组相比p《 0.001。
13.图4是本发明实施例提供的7天盐水注射前后在药物配对室花费的时间图。
14.图5是本发明实施例提供的7天甲基苯丙胺注射前后在药物配对室花费的时间图,
图中,***为两组相比p《0.001。
15.图6是本发明实施例提供的7天盐水或甲基苯丙胺注射后在药物配对室花费的平均时间图,图中,**为两组相比p《0.01。
16.图7是本发明实施例提供的7天盐水或甲基苯丙胺注射前后条件性偏好对比图,图中,***为两组相比p《0.001。
17.图8是本发明实施例提供的7天盐水注射前后在盐水配对室和药物配对室花费的时间比率对比图。
18.图9是本发明实施例提供的7天甲基苯丙胺注射后标准位置偏好比率对比图,图中,***为两组相比p《0.001。
19.图10是本发明实施例提供的7天盐水或甲基苯丙胺注射后相差偏好(注射前药物配对室时间-注射后药物配对室时间/注射后总时间)。图中,***为两组相比p《0.001,对照组n=16,试验组n=16。
20.图11a是本发明实施例提供的冠状切片面显示tph2(红色)共定位,由于图片调整为黑白色,因此红色显示为灰色。
21.图11b是本发明实施例提供的冠状切片面显示ppm1f(绿色)共定位,由于图片调整为黑白色,因此绿色显示为灰色。
22.图11c是本发明实施例提供的冠状切片面显示tph2(红色)和ppm1f (绿色)共定位,由于图片调整为黑白色,因此红色和绿色均显示为灰色。
23.图12是本发明实施例提供的对照组和试验组中缝背核中ppm1f的mrna水平。图中,盐水组:n=7;药物组:n=8,**为两组相比p《0.01。
24.图13是本发明实施例提供的对照组和试验组中缝背核中ppm1f的蛋白免疫印记图。
25.图14是本发明实施例提供的对照组和试验组中缝背核中ppm1f的蛋白 (d)的对比图,图中,盐水组:n=8;药物组:n=8,**为两组相比p《0.01。
26.图15是本发明实施例提供的7天盐水或meth注射后条件性偏好的与中缝背核脑区ppm1f的mrna水平的相关性分析。。
27.图16是本发明实施例提供的7天盐水或meth注射后相差偏好与中缝背核脑区ppm1f的mrna水平的相关性分析。
28.图17是本发明实施例提供的7天盐水或meth注射后条件性偏好的与中缝背核脑区ppm1f的蛋白水平的相关性分析
29.图18是本发明实施例提供的7天盐水或meth注射后相差偏好与中缝背核脑区ppm1f的蛋白水平的相关性分析。
30.图19是本发明实施例提供的中缝背核脑区注射aav-gfp病毒后再注射盐水的(7天)小鼠在药物配对室中的时间。
31.图20是本发明实施例提供的中缝背核脑区注射aav-gfp病毒后再注射 meth(7天)的小鼠在药物配对室中的时间。**为两组相比p《0.01。
32.图21是本发明实施例提供的中缝背核脑区注射aav-ppm1f病毒后再注射meth(7天)的小鼠在药物配对室中的时间。
33.图22是本发明实施例提供的中缝背核脑区注射aav-gfp或 aav-ppm1f病毒后再注
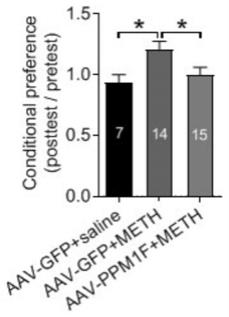
射盐水或meth(7天)前后条件性偏好对比图。图中,*为两组相比p《0.05。aav-gfp/saline组:n=7,aav-gfp/meth组: n=14,aav-ppm1f/meth组:n=15。
34.图23是本发明实施例提供的中缝背核脑区注射aav-gfp病毒后再注射盐水的(7天)小鼠在盐水配对室和药物配对室花费的时间比率对比图。
35.图24是本发明实施例提供的中缝背核脑区注射aav-gfp病毒后再注射 meth的(7天)小鼠在盐水配对室和药物配对室花费的时间比率对比图。
36.图25是本发明实施例提供的中缝背核脑区注射aav-ppm1f病毒后再注射meth的(7天)小鼠在盐水配对室和药物配对室花费的时间比率对比图。注射盐水或冰毒后(7天后)的aav-ppm1f/meth标准偏好比值。
37.图26是本发明实施例提供的中缝背核脑区注射aav-gfp或 aav-ppm1f病毒后再注射盐水或meth(7天)小鼠在药物配对室花费的时间比率对比图。
38.图27是本发明实施例中缝背核脑区注射aav-gfp或aav-ppm1f病毒后再注射盐水或meth(7天)后小鼠在16分钟内活动性对比图。
39.图28是本发明实施例中缝背核脑区注射aav-gfp或aav-ppm1f病毒后再注射盐水或meth(7天)后小鼠在16分钟内总活动性统计图。
具体实施方式
40.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.实施例
42.本发明实施例提供了一种治疗甲基苯丙胺成瘾的药物,药物包括: ppm1f基因的重组病毒,重组病毒的载体为腺相关病毒。
43.具体地,药物包括:ppm1f基因的重组病毒,重组病毒的载体为腺相关病毒(adeno-associated virus,aav,血清型为9型),即aav-ppm1f。
44.另一方面,本发明实施例提供了一种ppm1f基因的重组病毒的应用,如上的ppm1f基因的重组病毒用于制备治疗甲基苯丙胺成瘾的药物的应用。
45.下面简单介绍一下本发明实施例提供的药物的制备方法,具体如下:
46.将ppm1f基因的mrna序列插入到穿梭质粒paav-mcs中,得到重组质粒;
47.将重组质粒、第一载体质粒paav-rc9和第二载体质粒phelper分别进行高纯度无内毒素抽提后,将重组质粒、第一载体质粒paav-rc9和第二载体质粒phelper采用转染试剂lipofiter
tm
共转染293t细胞,转染后72h收集细胞沉淀;其中,转染试剂lipofiter
tm
购置于汉恒生物科技(上海)有限公司。在本实施例中,共转染操作由汉恒生物科技上海有限公司按照转染试剂 lipofiter
tm
的说明书完成。
48.纯化细胞沉淀。具体地,采用全能核酸酶处理细胞沉淀:每1ml细胞沉淀中加入0.1μl benonase酶,于37℃水浴1h,除细胞沉淀中的细胞基因组及残留的质粒dna。于600g且温度为4℃条件下离心10min,得到上清液。将该上清液安装biomiga腺相关病毒纯化试剂盒v1469-01进行柱纯化,得到的 4ml aav病毒样品液体,将aav病毒样品液体加入到超滤管
中,于1400g 离心30min,得到约200μl的产物,即为本发明实施例提供的治疗精神疾病的药物。将产物保存于﹣80℃条件下。同时,测得该产物的滴度为 1.2
×
10
12
vg/ml。
49.验证本发明实施例提供的药物对治疗甲基苯丙胺成瘾的作用,具体如下:
50.选取128只c57bl/6j小鼠(购置于济南朋悦实验动物繁育有限公司)均饲养在12小时灯光和12小时黑暗交替的环境中,饲养期间供应充足的水和饲料。
51.本发明实施例所用的甲基苯丙胺(纯度≥95%)均来自烟台市戒毒所。实验时采用0.9%的医用生理盐水将甲基苯丙胺配置成浓度为2mg/ml的溶液,并通过腹腔注射方法使最终的注射剂量为1mg/kg。
52.免疫荧光:分别采用中缝背核病毒注射aav-ppm1f-gfp(以下简称 aav-ppm1f)与aav-gfp病毒进行注射,aav-ppm1f和aav-gfp病毒均由汉恒生物公司包装合成(aav-ppm1f和aav-gfp病毒的滴度均大于 1.0
×
10
12
vg/ml),本发明将注射aav-ppm1f的小鼠作为试验组,注射 aav-gfp的小鼠作为对照组。3周后,将将两组小鼠(每组选取8只)的大脑分别用预冷的浓度为4%的多聚甲醛水溶液进行灌流后固定1天,再用浓度为30%的蔗糖脱水3天,采用冰冻切片机将小鼠的大脑切成40μm厚的冠状切面,得到大脑切片。将大脑切片在pbs(phosphate buffer saline,磷酸缓冲盐溶液)中冲洗三次,并转移到聚赖氨酸涂层的玻璃载玻片上,用封片剂覆盖,并通过olympus共焦显微镜进行观察。
53.中缝背核病毒注射方法:将c57bl/6j小鼠经戊巴比妥钠麻醉后,切开头部皮肤,并暴露颅骨,按照中缝背核微注射参数进行立体定位(中缝背核: ap:-4.0mm;ml:
±
0.4mm;dv:-3.0mm),使用微量注射泵进行注射,注射体积为0.5μl,流速为0.1μl/min。
54.观察结果如图1所示,图1为试验组小鼠中缝背核存在显著的gfp绿色荧光的表达图,由于图片调整为黑白色,因此绿色荧光部分显示为灰色,由图1可知,aav-ppm1f在试验组小鼠的中缝背核显著感染并表达目的基因。
55.利用免疫印迹(western blot)方法验证aav-ppm1f是否在试验组小鼠的中缝背核脑区过表达了ppm1f蛋白。
56.具体地,选取8只试验组小鼠和8只对照组小鼠,将8只试验组小鼠和8 只对照组小鼠的中缝背核用组织裂解液进行匀浆处理,在本实施例中,组织裂解液包括:nacl、浓度为1%的triton x-100、浓度为1%的sodiumdeoxycholate、浓度为0.1%的sds、苯甲基磺酰氟(phenylmethylsulfonylfluoride)和phosstop phosphatase inhibitor cocktail。经浓度为12%的聚丙烯酰胺凝胶(sds-page)进行电泳,得到蛋白,将蛋白转印到pvdf(聚偏氟乙烯)膜上,经浓度为5%的脱脂奶粉水溶液封闭1小时,经内参基因 anti-ppm1f(1:1000,pa5-15571,invitrogen,carlsbad,california,usa) 于4℃孵育过夜,在其它实施例中,也可以采用anti-β-actin(1:1000,#4970, cellsignalingtechnology,danvers,ma,usa)替换anti-ppm1f作为内参基因,经tbst(tris buffered saline tween)洗涤后与羊抗兔(goat anti-rabbitir dye 680lt)孵育1小时,在其它实施例中,也可以采用羊抗鼠(goatanti-mouse ir dye 800cw)替换羊抗兔。利用odyssey双红外荧光成像系统进行成像和定量分析。
57.结果分别如图2和图3所示,图2为aav-ppm1f和aav-gfp在中缝背核脑区过表达ppm1f蛋白对比图。由图2可知aav-ppm1f的确在小鼠中缝背核脑区过表达了ppm1f蛋白。图3为aav-ppm1f和aav-gfp分别在小鼠中缝背核脑区ppm1f蛋白的表达量对比图。由图3可知,
试验组的表达量明显高于对照组的表达量。
58.进一步地,将本实施例提供的两组小鼠(每组选取16只)分别进行条件性位置偏好实验(conditional place preference cpp),用于构建及评价甲基苯丙胺导致的成瘾动物模型。准备cpp位置偏好箱,cpp位置偏好箱由透明有机玻璃(长50cm
×
宽50cm
×
高30cm)构成,并被透明有机玻璃的隔板(长 50cm
×
宽30cm)分为两个大小相同的隔间,其中,cpp位置偏好箱与隔板的材质相同,在隔板的底部有一个可闭合开放的闸门(长10cm
×
宽10cm)。其中一个隔间的外壁贴有间隔布置的黑色条带,另一个隔间的外壁贴有间隔布置的黑色圆点,用以区分为盐水配对室及药物配对室。cpp实验分为三个阶段,包括:前测、训练和测试。前测:第1天,将小鼠单笼饲养于cpp位置偏好箱进行环境适应性训练。第2天,下午2时开始,打开闸门,小鼠被允许在cpp位置偏好箱中自由探索15分钟,同时,记录小鼠在各个隔间的活动时间,并以此作为基线。实验结束后淘汰具有初始偏好的小鼠(在任何隔间中的活动时间均》600秒)。训练:第3天,上午8时开始向小鼠腹腔注射生理盐水,并限制在盐水配对室中活动30分钟。下午2时,试验组小鼠接受甲基苯丙胺注射(腹腔注射,注射量:1mg/kg),随后将小鼠限制在药物配对室中探索30分钟,对照组小鼠除注射相同剂量的生理盐水,其他均与试验组小鼠相同。训练阶段按照上述步骤重复7天用于条件性位置偏好行为的建立。测试:训练结束后的次日下午2时开始,打开装置闸门,将小鼠放在隔间中,并允许其自由移动15分钟,同时记录小鼠在每个隔间的活动时间。 cpp行为评价如下所示:1)条件偏好:测试前后小鼠在药物配对室中花费的时间比率;2)标准化位置偏好:测试前后小鼠在药物配对室活动的时间差/ 测试总时间。3)相差偏好(注射前药物配对室时间-注射后药物配对室时间/ 注射后总时间)
59.活动性检测:小鼠放于长40cm
×
宽40cm
×
高30cm检测箱内自由运动 16分钟,运动情况由红外线光电传感器进行记录,并由fusion software电脑软件进行分析。
60.实时定量荧光pcr(quantitative real-time pcr),使用rna提取试剂盒(omega,doraville,ga,usa)从试验组小鼠和对照组小鼠的dr脑区中分别提取总rna,并通过cdna反转录试剂盒(hiscript ii q rt supermixfor qpcr(+gdna wiper)kit vazyme,nanjing,china)反转录成cdn a。最后使用steponeplus实时pcr系统(applied biosystems,waltham,m a,usa)将得到的cdna用于实时pcr检测,具体条件如下:每个循环均包括:95℃5分钟,随后95℃7秒,60℃30秒,共进行40个循环。用于扩增相应基因的引物序列如下:ppm1f forward:agatggcctgtgacagt gaga;reverse:aagcccaatgccagctcaa;β-tubulin:forward:agc aacatgaatgacctggtg;reverse:gctttccctaacctgcttgg。甲基苯丙胺成瘾小鼠动物模型的建立。
61.首先,利用cpp实验建立小鼠的甲基苯丙胺成瘾动物模型,用于评价及探究ppm1f基因或蛋白对甲基苯丙胺成瘾的调控作用。野生型c57bl6小黑鼠被用于本实验。在前测阶段完成后淘汰具有初始偏好的小鼠(在任何隔间花费时间均大于600秒),随后,剩余的小鼠随机分为对照组与试验组,并在相应的隔间内接受为期7天的盐水或甲基苯丙胺注射训练。
62.对照组小鼠在前测与测试阶段在药物配对室所花费的时间近似,然而药物组小鼠在测试阶段则表现出极为显著的时间提升,结果参见图4和图5,图 4中saline:t(15)15=0.3880,p=0.7034;图5中meth:wilcoxonmatched-pairs signed rank test,p《0.0010。对比在药物室花费的平均时间中发现,两组小鼠在前测阶段的表现中近似,而在测试阶段
试验组小鼠则表现出较为明显的提高,具体见图6,图6中,前测阶段:p=0.6133,测试阶段:p=0.0034。同时我们发现对比盐水组小鼠,药物组小鼠表现出较强的条件性偏好行为见图7,图7中mann whitney test,p=0.0012。
63.在标准偏好比率的分析中盐水组小鼠在前测与测试阶段表现近似,见图 8,图8中saline:wilcoxon matched-pairs signed rank test,p=0.8209;而试验组小鼠对比前测阶段的比率在测试中表现出极为显著的比率升高,见图9,图9中meth:t(15)=5.4570,p《0.0010,同时对比对照组小鼠,试验组小鼠也表现出较高的相差偏好比率,见图10,图10中mann whitney test,p《 0.0010。综上所述,7天甲基苯丙胺给药成功的诱导了cpp行为。
64.ppm1f表达水平的降低与meth诱导的cpp行为有关。
65.ppm1f在中缝背核5-ht神经元中表达并且其表达水平与meth诱导的 cpp有关。确定ppm1f可在5-ht神经元中表达,通过中缝背核双免疫荧光结果显示,ppm1f与5-ht神经元标记物tph2同样存在大量共定位的现象,见图11a、图11b和图11c。然后,评估甲基苯丙胺诱导的cpp小鼠中缝背核中ppm1f的表达是否发生改变。具体见图12和图13以及图14,meth注射的小鼠ppm1f的mrna(t(14)=3.5500,p=0.0032)和蛋白(t(14)=3.4440, p=0.0039)的表达水平均显著降低。同时,分析甲基苯丙胺诱导的cpp行为与ppm1f水平的相关性,结果显示条件位置偏好和标准偏好比率分别与 ppm1f的mrna和蛋白水平显著相关,参见图15至图18。结果表明,5-ht 神经元中ppm1f的表达量降低确实与甲基苯丙胺诱导的成瘾病理学存在确切的相关性。
66.在中缝背核中过表达ppm1f减轻了甲基苯丙胺诱导的cpp行为
67.具体地,甲基苯丙胺诱导的cpp小鼠在中缝背核中ppm1f的表达降低。假设在中缝背核中过表达ppm1f可能会调控甲基苯丙胺诱导的cpp。随后,将ppm1f过表达的aav载体注入wt小鼠的中缝背核中。三周后,通过检测gfp的荧光表达,鉴别aav介导的ppm1f是否表达以及是否在正确的位置,结果如图1所示,可见位置正确,随后这些小鼠接受7天的盐水或 meth给药,然后进行cpp检测。结果参见图19至图21,在前测与测试阶段小鼠在药物室花费的时间显示,盐水注射的aav-gfp小鼠(t(6)=1.1300, p=0.3017)的时间几乎没有差异,药物注射的aav-gfp小鼠的时间增加(t (13)=3.3510,p=0.0056),药物注射的aav-ppm1f小鼠(t(14)=0.0843, p=0.9340)无明显变化。同时,见图22,与盐水注射的aav-gfp小鼠相比,甲基苯丙胺注射的aav-gfp小鼠表现出增强的条件偏好(p=0.0331),而这种增强在药物注射的aav-ppm1f小鼠中受到显著抑制(p=0.0448),图22 中,f(2,33)=4.673,p=0.0163。此外,进一步分析发现盐水注射的 aav-gfp小鼠(t(6)=0.6581,p=0.5349)在两个隔间中花费的时间比值没有显著变化,见图23(图23中t(6)=0.6581,p=0.5349),但甲基苯丙胺注射的aav-gfp小鼠的比值显著增加,见图24(图24中(t(13)=3.4830, p=0.0044))。而在前测和测试阶段之间的比值显著增加的情况在甲基苯丙胺注射的aav-ppm1f小鼠中显著受到抑制。,见图25(图25中(t(14)= 0.7021,p=0.4941)。
68.最后,操控ppm1f的表达具有一个显著的操控甲基苯丙胺诱导cpp行为的效果(f(2,33)=5.415,p=0.0093),与盐水注射aav-gfp组对比,甲基苯丙胺注射的aav-gfp组小鼠表现出一个极为明显的相差偏好比率的增高见图26(p=0.0197),然后这种明显的标准偏好比率却在甲基苯丙胺注射的aav-ppm1f组小鼠中消失了,见图26(p=0.0303)。此外,见图27和图28,活动性检测结果显示盐水注射的aav-gfp、甲基苯丙胺注射的 aav-gfp及药物
注射的aav-ppm1f小鼠各时间点和总的活动性均没有明显差异,图27,药物处理:f(2,33)=0.9616,p=0.3927;时间点:f(7,231)= 142.6000,p《0.0010;药物处理
×
时间点:f(7,231)=1.1260,p=0.3362,图 28,f(2,33)=0.9616,p=0.3927。
69.结果表明,上述假设成立,即在中缝背核中操控ppm1f的表达具有显著的抑制甲基苯丙胺诱导cpp行为的效果。
70.本发明实施例提供了一种治疗甲基苯丙胺成瘾的药物,该药物为ppm1f 基因的重组病毒,在中缝背核中操控ppm1f的表达具有显著的抑制甲基苯丙胺诱导cpp行为的效果,使得该药物具有良好的治疗甲基苯丙胺成瘾的效果。
71.虽然本发明所揭露的实施方式如上,但所述的内容仅为便于理解本发明而采用的实施方式,并非用以限定本发明。任何本发明所属领域内的技术人员,在不脱离本发明所揭露的精神和范围的前提下,可以在实施的形式及细节上进行任何的修改与变化,但本发明的专利保护范围,仍须以所附的权利要求书所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1