嵌合抗原受体(CAR)及其应用的制作方法
嵌合抗原受体(car)及其应用
技术领域
1.本发明属于肿瘤免疫治疗领域和生物技术领域,具体提供了一种嵌合抗原受体(car)及其应用。
背景技术:
2.肿瘤因其具有难治愈性、高死亡率、低愈后临床表现,而成为威胁人类健康的最严重的疾病之一,为此研究人员先后尝试了多种肿瘤治疗手段和技术,包括手术治疗、放射治疗、化学药物治疗、基因治疗等等,但是截至目前仍未找到行之有效的治疗手段。随着生物技术和免疫学研究的深入,肿瘤免疫治疗和抗肿瘤抗体受到业内的重视,自上世纪80年代以来,全球范围内已有上百种抗体并批准用于肿瘤治疗,以免疫检查点抑制剂和嵌合抗原受体t细胞为代表的新一代免疫治疗技术也得到广泛重视,并用于治疗多种恶性肿瘤。
3.受体酪氨酸激酶样孤儿受体1(receptor tyrosine kinase-like orphan receptor1,ror1)是受体酪氨酸激酶(receptor tyrosine kinase,rtks)家族成员之一,与生长因子受体的酪氨酸激酶结构域具有很高的同源性。人ror1分子由胞外区、跨膜区和胞内区组成,其胞外区包括一个免疫球蛋白样结构域(immunoglobulin-like domain,ig-like)、两个富含半胱氨酸卷曲的结构域(cysteine-rich domain or frizzled,crd or fzd)和一个kringle(kng)结构域;胞内区含有一个酪氨酸激酶结构域(tyrosine kinase domain,tkd)、两个富含丝氨酸/苏氨酸结构域(serine/threonines-rich domain,ser/thrd)和一个富含脯氨酸富集结构域(proline-rich domain,prd)。大量研究显示ror1在促进肿瘤的生长和转移、诱导肿瘤细胞耐药和抑制细胞凋亡等方面起到了关键性的作用,尤其是ror1正常组织中低水平表达,而高表达于多种恶性肿瘤或组织中,如慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、乳腺癌、卵巢癌、黑色素瘤、肺腺癌等等。ror1在肿瘤组织中具有高度识别性,基于这种特性,使得ror1成为一种新型的肿瘤特异性标志物和抗肿瘤靶点。
4.针对ror1靶点,已经开发出了多种肿瘤免疫疗法,包括:(1)单克隆抗体,是由单一b细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,该类抗体灵敏度高,特异性强,交叉反应少,制备的成本低,是目前应用最为广泛的抗体药物。目前研究人员针对ror1靶点开发了多种单克隆抗体,如jp2021522162a、wo2021202863a1、ep3842072a1、cn112384533a等公开了相应的抗ror1单克隆抗体;(2)双特异性抗体,该类抗体含有2种特异性抗原结合位点,能在靶细胞和功能分子(细胞)之间架起桥梁应,激发具有导向性的免疫反应,进一步增强抗体治疗的靶向性,ep2984107a1公开了针对ror1和cd3靶点的双特异性抗体,可有效抵抗白血病、弥漫性大b细胞淋巴瘤、骨髓瘤、乳腺癌、肺癌等肿瘤;(3)抗体偶联药物(antibody-drug conjugate,adc),是通过一个化学链接将具有生物活性的小分子药物连接到单抗上,单抗作为载体将小分子药物靶向运输到目标细胞中,这种组合药物既具有生物分子的靶向性,又具有化学药较强的肿瘤杀伤能力,为了降低毒副作用,往往要求生物分子具有较高的特异性,对于连接生物分子和化学药物的连接子也需要进行精确设
id no:1、seq id no:2和seq id no:3所示的hcdr1、hcdr2和hcdr3;所述轻链可变区包含分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、lcdr2和lcdr3。
10.进一步的,所述抗人ror1的scfv中的重链可变区的氨基酸序列如seq id no:7所示;所述抗人ror1的scfv中的轻链可变区的氨基酸序列如seq id no:8所示。
11.本发明中所选用的抗人ror1 scfv源自于申请人在前期实验中筛选并获得的新型抗体结构,除对目标抗原具有较高亲和力之外,还具有良好的热稳定性和ph稳定性,能够耐受肿瘤组织中的极端环境,对于实体肿瘤具有较高的抑制作用,适用于开发针对实体肿瘤的药物或免疫疗法。
12.进一步的,所述嵌合抗原受体还包括人fc结构域,所述人fc结构域选自igg1,其氨基酸序列如seq id no:9所示。
13.在现有技术中,fc片段多用于和目标蛋白质结合形成融合蛋白,从而能够延长相关蛋白分子的体内半衰期,达到长效给药的目的,如将fc片段与glp-2、il-2、il-15结合等等。而本发明中惊奇的发现,在嵌合抗原受体结构中,引入fc片段后似乎能够提高抗原结合域与目标抗原的结合活性,同时抑制某些炎症因子的过度分泌,防止严重不良反应的发生。fc片段包括多种类型,如igg、igm、iga、igd等,本发明中选用人体中最为常见、生理活性最强的人igg1作为结合片段,以便有效降低排斥反应,同时延长cart细胞的作用时效。
14.进一步的,所述信号肽氨基酸序列如seq id no:10所示;所述铰链区氨基酸序列如seq id no:11所示;所述跨膜区氨基酸序列如seq id no:12所示;所述4-1bb胞内域氨基酸序列如seq id no:13所示;所述cd3ζ胞内域氨基酸序列如seq id no:14所示。
15.提供了一种编码本发明中所述ror1特异性嵌合抗原受体的核苷酸。
16.提供了一种重组载体,所述重组载体包括本发明所述的ror1特异性嵌合抗原受体的核苷酸。
17.提供了一种宿主细胞,所述宿主细胞本发明中所述的重组载体。
18.提供了一种ror1特异性嵌合抗原受体在制备抗肿瘤药物中的应用。
19.进一步的,所述肿瘤包括实体肿瘤和血液肿瘤。
20.进一步的,所述肿瘤包括乳腺癌、卵巢癌、肺癌、胃癌、结直肠癌、头颈癌、鼻咽癌、黑色素瘤。
21.有益效果
22.本发明中提供了一种新型ror1特异性嵌合抗原受体,该嵌合抗原受体具有全新的抗原结合域,能够与目标抗原高度特异性结合,有效防止脱靶效益的发生。在嵌合抗原结构中引入fc片段,可提高与目标抗原的亲和力和靶向性,同时抑制严重不良反应的发生,防止免疫因子风暴的出现,提供了较高的安全性。本发明中所述提供的嵌合抗原受体t细胞能够抑制多种实体肿瘤,促进抑癌因子分泌,激活体内免疫系统。本发明中所述的嵌合抗原受体t细胞能够在体内和体外实验中显著抑制肿瘤生长,发挥强大的抗肿瘤作用。
附图说明
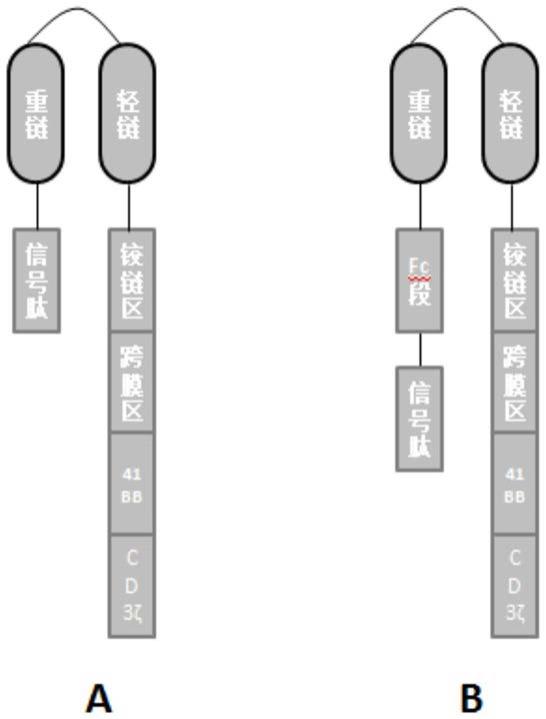
23.图1:图1嵌合抗原受体结构图;图1a第二代car结构;图1b为fc-car结构;
24.图2:cart细胞对实体细胞的杀伤效应;
25.图3:cart细胞对小鼠模型肿瘤体积的影响;
26.图4:cart细胞对小鼠skov3模型细胞因子的影响;
27.图5:cart细胞对小鼠bt-549模型细胞因子的影响。
具体实施方式
28.实施例1:嵌合抗原受体分子设计
29.发明人前期筛选靶向人ror1蛋白的抗体,获得多个单克隆抗体,从中筛选出亲和力较高的抗体分子,选用其包含重链和轻链的scfv片段作为本发明所示嵌合抗原受体的抗原结合域,该抗原结合域可与目标抗原高水平结合,其亲和力可达2.20e-09nm。并且在4℃-42℃、ph2-ph12条件下均能够维持较强的抗原结合能力,可以耐受实体肿瘤微环境中的极端环境,有利于发挥对实体肿瘤的抑制作用。
30.为获得安全而有效的cart细胞,本发明中提供了两种嵌合抗原受体结构,如图1所示,图1a所示结构为经典的第二代car结构,包括信号肽、抗人ror1 scfv、铰链区、跨膜区、4-1bb胞内域和cd3ζ胞内域;图1b所示结构所示的结构中引入了fc片段,构建fc-car结构,包括信号肽、fc片段(具体为人igg1片段)抗人ror1 scfv、铰链区、跨膜区、4-1bb胞内域和cd3ζ胞内域,通过引入fc片段,改善肿瘤微环境,抑制肿瘤对t细胞的逃逸效应,提高cart治疗的安全性,提高生物利用度。
31.所述抗人ror1 scfv由本实验室保存,包括重链可变区和轻链可变区,所述重链可变区包含分别如seq id no:1、seq id no:2和seq id no:3所示的hcdr1、hcdr2和hcdr3;所述轻链可变区包含分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、lcdr2和lcdr3。进一步的,所述重链可变区的氨基酸序列如seq id no:7所示;所述轻链可变区的氨基酸序列如seq id no:8所示。
32.fc片段的种类较多,包括igg、igm、iga、igd等,且不同物种之间差异较大,为了降低体内应用过程中的排斥反应,本发明中选用人体中含量最丰富的人igg1片段,氨基酸序列如seq id no:9所示。
33.通过分子生物学和生物信息学检索获得其他相关元件的序列结构,其中信号肽氨基酸序列如seq id no:10所示;所述铰链区氨基酸序列如seq id no:11所示;所述跨膜区氨基酸序列如seq id no:12所示;所述4-1bb胞内域氨基酸序列如seq id no:13所示;所述cd3ζ胞内域氨基酸序列如seq id no:14所示。
34.实施例2:cart细胞制备
35.根据上述元件的氨基酸序列,通过逆转录、核酸扩增等方式获得其核苷酸序列,并将相应的基因片段插入慢病毒表达载体plent-ef1a-fh-cmv-rfp-p2a-puro载体中。将上述表达载体经电转化导入dh5αe.coli中,经测序正确后,使用质粒提取试剂盒(购自qiagen公司)提取并纯化质粒。
36.在37℃5%co2培养箱中恒温培养293t细胞,使其在转染前生长密度达到70%-80%,更换新鲜培养基备用;分别将脂质体,以及上述纯化质粒与plp/vsvg、plp1、plp2质粒混合物使用无血清dmem-hg培养基稀释,随后将二者混合均匀,室温静置15min形成脂质体/dna复合物;将上述脂质体/dna复合物加入到准备好的293t细胞中,混合均匀后37℃培养12-18小时,然后更换新鲜培养基继续培养48小时,离心收集重组病毒,经测定重组病毒的滴度达到3.35
×
106pfu/ml以上,符合实验要求。
37.取新鲜健康志愿者外周血10ml,采用rosettesep t cell enrichment cocktail(购自stemcell公司)和ficoll-paque plus(购自ge healthcare公司)提取人t细胞,具体步骤按照说明书进行。将前述步骤中收集得到的病毒,按2:1比例加入到t细胞培养基中,转入5%co2,37℃培养箱中培养48小时。使用流式细胞仪检测car修饰t细胞的阳性率,结果显示cart细胞阳性率达90%以上。为了便于区分,本发明中所提供的具有如实施例1中所述两种结构的嵌合抗原受体的t细胞,分别记为ror1-cart和fc-ror1-cart。
38.实施例3cart细胞对肿瘤细胞的体外杀伤效应
39.据报道,ror1抗体对多种血液肿瘤和实体肿瘤具有抑制作用,而根据本发明的前期实验结果可知,本发明中所提供的含有seq id no:1-3所示hcdr和seq id no:4-6所示lcdr等cdr区域的单克隆抗体对于造血系统肿瘤细胞和以卵巢癌为代表的实体肿瘤细胞均具有较强的识别能力和杀伤作用,本实施例中扩展了实体肿瘤的范围,验证相关cart细胞对于实体肿瘤细胞的抑制作用。
40.据报道,ror1高表达于多种实体肿瘤组织中,本发明中选用skov3(卵巢癌细胞系)、bt-549(乳腺癌细胞系)、a549(肺癌细胞系)和mgc-803(胃癌细胞系)作为研究对象,通过cck-8法检测杀伤作用。具体方法包括:
41.(1)将上述肿瘤细胞接种于培养皿中,细胞生长至对数生长期后,更换新鲜培养基备用;
42.(2)培养ror1-cart细胞和fc-ror1-cart细胞,待细胞处于对数生长期后,更换新鲜培养基备用;
43.(3)分别离心收集肿瘤细胞和修饰的t细胞,按1:1比例混合,然后接种于96孔板中,37℃细胞培养箱培养48小时。
44.(4)每孔加入cck-8(dojindo,日本)试剂(20μl/孔),37℃细胞培养箱孵育2小时后,450nm处测定吸光度;
45.(5)根据cck-8试剂盒(dojindo,日本)说明书,统计活细胞数目并推算杀伤效率:杀伤率=[((t+e)-t&e)/t]
×
100%
[0046]
其中,t代表活的靶细胞数量;e代表活的效应细胞数量;则t+e等于活的靶细胞和效应细胞的总数;t&e代表靶细胞经效应细胞杀伤后的活细胞数量。
[0047]
如图2所示,本发明所提供的嵌合抗原受体修饰的t细胞对于多种实体肿瘤细胞均有抑制作用:对于skov3细胞,fc-ror1-cart的抑制能力略强于ror1-cart,具有显著差异(p《0.01);对于bt-549细胞,两种cart细胞的抑制能力类似,未见显著差异;对于a-549细胞,fc-ror1-cart的抑制能力也似乎强于ror1-cart(p《0.05),但细胞杀伤率差异不如在skov3细胞中表现明显;对于mgc-803细胞,二者未见显著差异,且对于该细胞的杀伤能力明显弱于其他三种细胞,说明本发明中所提供的cart细胞对于mgc-803为代表的胃癌细胞系具有一般杀伤能力。
[0048]
上述实验结果说明,本发明所提供的嵌合抗原受体t细胞能够抑制多种实体肿瘤细胞生长,尤其是多于乳腺癌、卵巢癌和肺癌细胞作用显著,说明其能够作为实体肿瘤的治疗手段。
[0049]
实施例4cart细胞对血液肿瘤的体内抑制效应
[0050]
为了进一步验证本发明中所提供的cart细胞的抗肿瘤效果,本节中选择采用
skov3(卵巢癌细胞系)和bt-549(乳腺癌细胞系)构建动物模型,研究体内抗肿瘤效果。
[0051]
4.1动物模型制备与治疗
[0052]
采用c57bl/6小鼠,6-8周龄,均为雌性,体重18-23g。实验动物在spf级恒温恒湿房间内饲养5天,适应环境;在37℃5%co2环境中培养skov3或bt-549细胞,每2-3天进行传代培养,调整细胞至对数生长期;离心收集细胞,无菌生理盐水重悬细胞,调整浓度为1
×
107个/ml,剃去c57bl/6小鼠右侧腹部体毛,将100μl细胞悬液注射入小鼠右前侧胁部皮下。每日观测肿瘤生长情况,当肿瘤直径达到3mm和5mm之间时进行后续实验。
[0053]
造模成功后,将实验动物随机分为三组,每周分别注射ror1-cart细胞(2
×
106个/只)、fc-ror1-cart细胞(2
×
106个/只)和等体积的生理盐水,治疗4周后尾静脉取血,留存血液样本,处死小鼠。
[0054]
4.2肿瘤体积
[0055]
实验动物给药4周后检测肿瘤体积变化,使用游标卡尺测量肿瘤的尺寸,肿瘤体积(l x w2)/2估算,其中l是长度或最长尺寸,w是肿瘤的宽度。
[0056]
结果如图3所示,治疗4周后,cart细胞能够明显抑制小鼠体内肿瘤生长速度,与对照组相比,肿瘤体积大幅度减小。在skov3细胞模型中,fc-ror1-cart和ror1-cart的抑制能力类似,二者均能有效抑制肿瘤组织生长,未见显著差异;在bt-549细胞模型中,fc-ror1-cart的杀伤能力明显强于ror1-cart。这可能与fc片段可延长融合蛋白的半衰期,提高生物利用度,还具有一定的免疫调节功能,可进一步强化肿瘤免疫效果等因素有关,还可能是由于不同肿瘤组织的肿瘤微环境不同,影响cart的响应能力。
[0057]
4.3cart影响血液肿瘤模型中细胞因子表达
[0058]
血液肿瘤的发生发展受多种因素影响,抗体发挥抗肿瘤作用也与细胞因子分泌、免疫细胞活化、缺氧环境形成和肿瘤微环境变化等多种因素相关,其中在抗体治疗过程中,免疫因子的表达水平发生变化,可介导一系列免疫机制,发挥协同抗肿瘤作用。因此,本发明中为初步探讨cart细胞的作用机制,检测了治疗后小鼠血浆中ifn-γ、il-2和il-6水平变化。
[0059]
治疗4周后尾静脉取血,离心收集血清,使用elisa法检测血浆中的ifn-γ、il-2和il-6浓度,如图4所示,在skov3细胞模型中,cart细胞治疗能够提高细胞因子的表达,ifn-γ、il-2和il-6浓度均有所提高,说明cart细胞能够激起动物体内的免疫反应,发挥协同的抗肿瘤作用;具体而言,ror1-cart细胞和fc-ror1-cart细胞在诱导ifn-γ表达方面未见限制差异,但fc-ror1-cart细胞却可以显著抑制il-2和il-6等白介素因子的表达。
[0060]
类似的结果出现在bt-549细胞模型中,如图5所示,ror1-cart细胞和fc-ror1-cart细胞在诱导ifn-γ高表达,且二者无显著差异;但在il-2和il-6表达中,fc-ror1-cart细胞可使得白介素因子处于相对低表达水平。
[0061]
上述结果说明,本发明中所提供的嵌合抗原受体t细胞能够有效抑制卵巢癌、乳腺癌、肺癌等实体肿瘤的生长,诱导免疫细胞因子的表达,并且在嵌合抗原受体结构中引入fc片段,可能显著抑制白介素类免疫因子的过量表达,防止细胞因子风暴的发生,提高治疗的安全性。
[0062]
虽然本发明参考其示例性的实施例已经进行了具体显示和描述,本领域的技术人员应当理解的是,在不偏离由所附权利要求书所涵盖的本发明的范围的情况下,可以在其
中做出在形式和细节方面的多种改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1