一个具有高催化活性的Ppmar2转座酶I441A突变体及其应用
一个具有高催化活性的ppmar2转座酶i441a突变体及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种具有高催化活性的ppmar2转座酶i441a突变体及其应用。
2.
背景技术:
3.转座子(transposon)是指在基因组上能从一个位点转移到另一个位点的一段dna序列。自转座子被发现以来,随着人们在分子水平上对转座子结构和功能认识的不断深化,一些转座子已被改造为基因标签应用于基因分析,并逐渐成为大规模分离基因的重要手段之一。
4.mariner-like转座子(mariner-like elements,mle)是转座子中一个重要家族,最早是在研究毛里塔尼亚果蝇(drosophila mauristiana) 白眼基因的一个不稳定突变时发现的。此后在其他动物以及植物基因组中也发现了大量mle转座子的存在。与其它转座子相比较,mle转座子具有结构简单、异源转座率高、在基因组插入位点接近随机等特点,在开发基因标签,分离基因,研究基因功能上,远远优于其他转座子。
5.mle转座子由两端反向重复序列(terminal inverted repeats,tirs)和编码转座酶的基因组成,转座酶负责催化转座子转座,因此转座酶的活性是影响转座子的转座频率的主要因素。然而自然界分离的mle转座酶由于在进化过程中“垂直失活”效应积累了或多或少的突变,部分或全部丧失了催化转座能力,成为低活性或非活性的转座酶,严重影响了mle转座子的应用,因此人工构建高活性的转座酶就显得十分重要。
技术实现要素:
6.本发明的目的是提供一种具有高催化活性的ppmar2转座酶i441a突变体及其应用,解决了现有自然界分离的mle转座酶催化活性较低或者不具备催化活性的问题。
7.本发明提供了一种具有高催化活性的ppmar2转座酶i441a突变体,所述的ppmar2转座酶i441a突变体的氨基酸序列如seq id no.1所示。
8.本发明还提供了一种编码所述ppmar2转座酶i441a突变体的基因,编码所述ppmar2转座酶i441a突变体的基因的核苷酸序列如seq id no.2所示。
9.本发明还提供了一种重组质粒,所述重组质粒携带有编码所述ppmar2转座酶i441a突变体的基因。
10.本发明还提供了一种工程菌株,所述工程菌株携带有上述重组质粒。
11.本发明还提供了一种具有高催化活性的ppmar2转座酶i441a突变体在构建酵母突变体中的应用。
12.与现有技术相比,本发明提供的一种具有高催化活性的ppmar2转座酶i441a突变体,具有以下有益效果:本发明从毛竹(phyllostachys pubescens)中克隆到的活性转座酶,对其进行人
72 ℃ 40 s,35 个循环;72 ℃ 2 min,4 ℃ 10 min。
23.步骤1.4,采用takara公司pmd
™
18-t vector cloning kit试剂盒的方法将步骤1.3的ppmar2转座酶核苷酸序列连接到pmd18-t载体克隆,测序确认,ppmar2转座酶核苷酸序列和相应的氨基酸序列分别如seq id no. 3和 seq id no. 4所示。
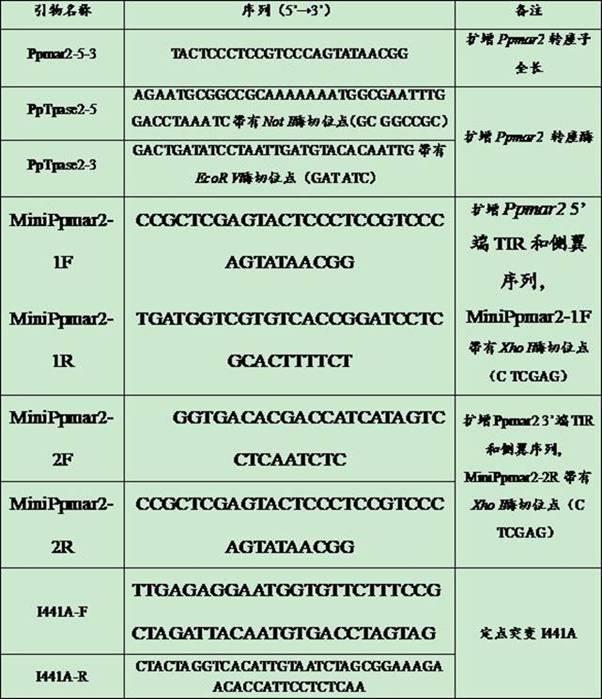
24.以含有ppmar2转座子全长序列的pmd18-t载体为模板,引物minippmar2-1f和minippmar2-1r扩增ppmar2 5’端tir和侧翼序列,获得226 bp片段,minippmar2-1f带有xho
ꢀⅰ
酶切位点(c tcgag)。
25.pcr扩增的反应条件为:预变性94 ℃ 5 min;变性94 ℃ 30 s,58 ℃ 30 s,延伸 72 ℃ 40 s,35 个循环;72 ℃ 40 s,4 ℃ 10 min。
26.引物minippmar2-2f和minippmar2-2r扩增ppmar2 3’端tir和侧翼序列,得到664bp 片段,minippmar2-2r带有xho
ꢀⅰ
酶切位点(c tcgag)。
27.pcr扩增的反应条件为:预变性94 ℃ 5 min;变性94 ℃ 30 s,60 ℃ 30 s,延伸 72 ℃ 40 s,35 个循环;72 ℃ 40 s,4 ℃ 10 min。
28.将上述两个片段回收后,按照分子数摩尔比1:1混合,以此为模板,通过引物minippmar2-1f和minippmar2-2r得到缩短的phmar2na转座子,长度为830 bp,ppmar2na的序列如seq id no. 5所示。
29.pcr扩增的反应条件为:预变性94 ℃ 5 min;变性94 ℃ 30 s,60 ℃ 30 s,延伸 72 ℃ 40 s,35 个循环;72 ℃ 1 min,4 ℃ 10 min。
30.二、酵母转座表达载体的构建步骤2.1,ppmar2转座酶表达载体的构建将步骤1.3的ppmar2转座酶核苷酸序列经not i和ecor v双酶切,回收ppmar2转座酶酶切产物的大片段;将 pag413-gal-ccdb载体经not i和ecor v双酶切,回收pag413-gal-ccdb载体酶切产物的大片段;且ppmar2转座酶核苷酸序列的双酶切体系、双酶切条件与pag413-gal-ccdb载体的双酶切体系、双酶切条件均相同;其中双酶切体系为50
µ
l,包括5
µ
l 10
×
buffer,1
µ
l not i (1u/
µ
l), 1
µ
l ecor v (1u/
µ
l),1
µ
g质粒(ppmar2转座酶核苷酸序列或者pag413-gal-ccdb载体),加无菌水补齐 50
µ
l,双酶切条件为:37 ℃温浴6小时。
31.将ppmar2转座酶酶切产物的大片段和pag413-gal-ccdb载体酶切产物的大片段相连接;连接体系为10
µ
l ,包括1
µ
l 10
×
t4 dna ligase buffer,1
µ
l t4 dna ligase (10u/
µ
l), 50ng pag413-gal-ccdb载体酶切产物的大片段,20ng ppmar2转座酶酶切产物的大片段,加无菌水补齐 10
µ
l,16 ℃温浴8小时。
32.此时完成了用ppmar2转座酶核苷酸序列替换pag413-gal-ccdb质粒中的ccdb核苷酸序列,得到重组质粒pag413-gal-tpase(tpase表示转座酶);该重组质粒pag413-gal-tpase即为ppmar2转座酶表达载体,其携带有编码所述ppmar2转座酶的基因。该表达载体具有his(组氨酸)筛选标记,使导入pag413-gal-tpase载体的宿主能够缺乏his的缺失培养基上生长。
33.步骤2.2,ppmar2非自主转座子供体载体的构建以步骤1.4的ppmar2的非自主性转座子ppmar2na为模板,xhoⅰ酶切回收。
34.同时,将载体pwl89a用xhoⅰ酶切(酶切位点位于ade2基因内),回收载体pwl89a骨架。酶切体系为50
µ
l,包括5
µ
l 10
×
buffer,1
µ
l xho
ⅰꢀ
(1u/
µ
l), 1
µ
g 载体pwl89a,加无菌水补齐 50
µ
l,37 ℃温浴6小时。
35.然后用t4 ligase将ppmar2na扩增产物插入到载体pwl89a骨架的ade2基因中,导致报告基因ade2插入失活,得到pwl89a-ppmar2na重组质粒,即为ppmar2非自主转座子供体载体。若ppmar2na发生转座从ade2基因上离开,那么ade2基因阅读框得到回复。该载体具有ura3筛选标记,使导入pwl89a-ppmar2na的宿主能够在缺乏ura(尿嘧啶)的缺失培养基上生长。
36.为了排除假阳性,通过测序选择和确认ppmar2na反向插入pwl89a载体的重组质粒开展实验。
37.三、ppmar2转座酶i441a突变体的获得将ppmar2转座酶核苷酸序列与其他植物mle转座酶的核苷酸序列进行同源性比对,选取ppmar2转座酶核苷酸序列441位置上的异亮氨酸开展突变,计划将它突变为丙氨酸(i441a)。
38.步骤3.1,根据quikchange
™ꢀ
site-directed mutagenesis kit(stratagene公司,美国)试剂盒说明书,设计定点突变引物i441a-f和i441a-r(i441a-f和i441a-r的序列信息见表1),按照quikchange
™
site-directed mutagenesis kit试剂盒方法,以步骤2.1的重组质粒pag413-gal-tpase为模板,利用pfuturbo
™ꢀ
dna polymerase重新合成含有ppmar2转座酶i441a突变体的质粒dna;步骤3.2,然后在合成的质粒dna中加入2 μl的dpn i限制性内切酶,于37 ℃条件下反应5 min,将原始模板序列彻底降解。将新合成的质粒dna测序确认后得到ppmar2转座酶i441a突变体;ppmar2转座酶i441a突变体的氨基酸序列如seq id no.1所示,编码所述ppmar2转座酶i441a突变体的基因的核苷酸序列如seq id no.2所示。
39.四、转座酶活性的检测实验组是将步骤3.2的含有ppmar2转座酶i441a突变体的质粒dna和步骤2.2的pwl89a-ppmar2na重组质粒,用peg/liac法共同转化到酵母中,用his/ ura双缺固体培养基上进行选择培养。用半乳糖诱导转座酶表达,促使非自主转座子发生转座。
40.以野生型ppmar2转座酶为对照组,步骤2.1的带有野生型的ppmar2转座酶的重组质粒pag413-gal-tpase和步骤2.2的pwl89a-ppmar2na重组质粒,用peg/liac法共同转化到酵母中,用his/ ura双缺固体培养基上进行选择培养。用半乳糖诱导转座酶表达,促使非自主转座子发生转座。
41.实验组和对照组的经诱导培养的酵母用缺失his/ura/ade固体培养基上进行选择培养,计算培养基上长出的酵母菌斑。如果转座发生,pwl89a-ppmar2na重组质粒上的ade2基因就能表达,因此阳性酵母株能够在缺乏腺嘌呤的培养基上生长。
42.以野生型ppmar2转座酶为对照,比较转化有ppmar2转座酶i441a突变体的酵母菌落数目,筛选出较高活性的转座酶突变株,结果如表2所示。
43.由表2可知,野生型ppmar2转座酶的阳性酵母菌落数量明显小于ppmar2转座酶i441a突变体,且ppmar2转座酶i441a突变体催化转座能力提高到原来的200%。这个高活性
人工改造的ppmar2转座酶i441a突变体将为利用ppmar2转座子开发基因标签奠定了重要基础。
44.表1 本发明应用的引物序列表2 不同转座酶诱导的阳性酵母菌落数量和催化活性
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
45.显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1