Rgs12作为γ射线辐射生物标志物的应用
rgs12作为
γ
射线辐射生物标志物的应用
技术领域
1.本发明属于生物技术领域,具体涉及rgs12作为γ射线辐射生物标志物的应用。
背景技术:
2.核辐射事故及核恐怖袭击发生后对伤员进行快速的辐射剂量评估、分类诊断并给予相应的救治是至关重要的。目前常见的辐射生物剂量计有染色体畸变(“金标准”)、微核分析、彗星电泳及淋巴细胞绝对值计数等,但这些方法在精准评估个人的受照剂量和辐射反应方面是有局限性的,且只适用于少量事故性伤员救治剂量估算,不适用于大规模核事故紧急医学救援现场的快速剂量估算。
3.因此,急需一种简单、快速、精准、易于操作和分析的生物剂量计检测方法。
技术实现要素:
4.本发明所要解决的技术问题是如何更简单、快速、精准和灵敏的检测或辅助检测待测受试者是否受到γ射线的辐照及所受的辐射剂量。
5.本发明提供了检测rgs12表达量或相对表达量的系统在制备检测或辅助检测受试者是否受到γ射线辐射的产品中的应用。
6.在一些实施方案中,所述检测rgs12表达量或相对表达量的系统为下述任一种:
7.a.利用mrna芯片技术检测所述rgs12表达量或相对表达量的系统;
8.b.利用定量pcr检测所述rgs12表达量或相对表达量的系统。
9.在一些实施方案中,所述系统包括引物和/或试剂和/或仪器。
10.具体的,所述利用定量pcr检测所述rgs12表达量或相对表达量的系统包括引物、试剂和/或进行定量pcr所需的其他试剂和/或仪器。
11.通过定量pcr检测所述rgs12表达量或相对表达量的系统包括扩增rgs12的引物、内参例如β-肌动蛋白的引物和/或进行定量pcr所需的其他试剂和/或仪器。所述用于扩增rgs12的引物、试剂和进行定量pcr所需要的其它试剂均可独立包装。
12.上述应用中,所述检测rgs12表达量或相对表达量的系统还包括数据处理装置,所述数据处理装置用于将来自待测受试者的所述rgs12表达量或相对表达量转换为所述待测受试者的检测结果。
13.上述应用中,所述数据处理装置包括数据输入模块、数据比较模块和结论输出模块;所述数据输入模块用于输入待测受试者的所述rgs12表达量或相对表达量值;所述数据比较模块用于将待测受试者的所述rgs12表达量或相对表达量值与未遭受γ射线辐射的对照组进行比较;结论输出模块用于输出结论:若待测受试者的rgs12表达量或相对表达量大于未遭受γ射线辐射的对照组的rgs12表达量或相对表达量,则结论是待测受试者遭受了γ射线辐射;若待测受试者的rgs12表达量或相对表达量小于或等于未遭受γ射线辐射的对照组的rgs12表达量或相对表达量,则结论是待测受试者未遭受γ射线辐射。
14.上述应用中,所述rgs12表达量或相对表达量为细胞及人血液中rgs12的表达量或
相对表达量。具体的,所述rgs12的表达量或相对表达量为人淋巴母细胞或人离体的外周血中rgs12的表达量或相对表达量。
15.以上述rgs12作为标志物的检测或辅助检测是否遭受γ射线辐射的系统在制备检测或辅助检测是否遭受γ射线辐射的产品中的应用也在本发明的保护范围之内。
16.上述应用中,所述检测或辅助检测是否遭受γ射线辐射的系统为上述检测rgs12的表达量或相对表达量的系统。
17.本发明进一步提供了检测或辅助是否遭受γ射线辐射的产品。
18.本发明检测或辅助检测是否遭受γ射线辐射的产品为上述检测rgs12的表达量或相对表达量的系统。
19.本发明中,所述rgs12的相对表达量值是所述rgs12相对于β-肌动蛋白的表达量。
20.本发明中所述遭受γ射线辐射是指遭受钴60-γ射线辐射。
21.另一方面,本发明提供rgs12用作检测受试者是否遭受辐射的标志物的用途。
22.另一方面,本发明提供检测或辅助检测受试者是否遭受辐射的试剂盒,其特征在于,所述试剂盒包括检测rgs12的表达量或相对表达量的试剂,任选地,所述试剂盒还包括检测内参β-肌动蛋白的表达量的试剂。
23.在一些实施方案中,检测rgs12的表达量或相对表达量的试剂包括检测rgs12的引物,上游引物gcaacagagcagatgaccaac,下游引物gcgcttctcttgctaaagcc。
24.在一些实施方案中,检测β-肌动蛋白表达量的试剂包括β-肌动蛋白的引物,上游引物tgtgtccgtcgtggatctga,下游引物ttgctgttgaagtcgcaggag。
25.在一些实施方案中,所述试剂盒还包括rna提取试剂、rna逆转录试剂。
26.另一方面,本发明提供检测或辅助检测rgs12的表达量或相对表达量的试剂在检测或辅助检测受试者是否遭受辐射的试剂盒制备中的用途。
27.在一些实施方案中,所述辐射为γ射线。
28.在一些实施方案中,所述辐射为钴60-γ射线。
29.另一方面,本发明提供检测或辅助检测受试者是否遭受辐射的方法,所述方法包括检测受试者中rgs12的表达量或相对表达量。
30.在一些实施方案中,所述方法包括检测受试者外周血中的rgs12的表达量或相对表达量。
31.在一些实施方案中,所述方法包括检测受试者淋巴母细胞中的rgs12的表达量或相对表达量。
32.定义
33.rgs12:g蛋白信号转导调控因子12,是一种重要的信号分子,其dna基因组跨越70kbp,包含16个外显子。
34.人淋巴母细胞:增殖状态下的淋巴细胞,体积较大,rna和蛋白质合成增多。对辐射比较敏感,能较好的反应是否受到辐射。
35.有益效果
36.本发明对淋巴母细胞或人离体的外周血辐射后,可检测到rgs12的表达量增加,进一步通过实时荧光定量pcr法建立检测rgs12表达量或相对表达量的系统,对待测受试者的rgs12表达量或相对表达量与未遭受γ射线辐射的正常受试者进行比较,能检测到待测受
试者是否遭受γ射线辐射,及时进行事故救援和伤员处理,对辐射处理具有重要意义。
37.荧光定量pcr方法的检测剂量范围大,检测时间短,灵敏度高,可用于大规模辐射事故发生后大量样本量的检测。
附图说明
38.图1为不同批次处理后人淋巴母细胞rgs12的相对表达量检测结果;不同剂量的γ射线照射不同时间后rgs12的相对表达量,各组不同照射剂量的rgs12相对表达量都与0gy比较,*p<0.05。
39.图2为不同批次处理后人外周血rgs12的相对表达量检测结果;不同剂量的γ射线照射不同时间后rgs12的相对表达量,各组不同照射剂量的rgs12相对表达量都与0gy比较,*p<0.05。
40.图3为人淋巴母细胞rgs12的相对表达量与照射剂量的拟合曲线。
41.图4为人外周血rgs12的相对表达量与照射剂量的拟合曲线。
具体实施方式
42.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
43.下述实施例中用到的材料、试剂和试验技术的来源如下:
44.小鼠外周血的全转录组数据测序由上海欧易生物医学科技有限公司进行。
45.反转录试剂盒(revertra ace qpcr rt master mix with gdna remover)购自东洋纺生物科技公司(日本),货号为:lot031500。
46.mrna荧光定量检测试剂盒(thunderbirdqpcr mix)购自东洋纺生物科技公司(日本),货号为:841600。
47.实施例1、用于辐射估算的rgs12表达的发现
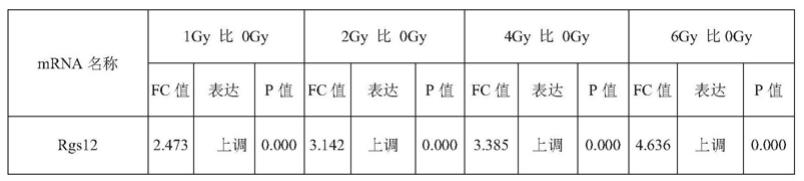
48.balb/c雄性小鼠购买自斯贝福(北京)生物技术有限公司,生长至8周龄,给予不同剂量(1、2、4和6gy)的全身钴60-γ射线照射,在照射后的4h收集小鼠的外周血,用红细胞裂解液分离白细胞并提取样品总rna。通过对5组样品rna质量检测完好后使用illumina测序仪进行测序。利用deseq软件对各个样本基因的counts数目进行标准化处理,计算差异倍数,并采用nb(负二项分布检验的方式)对reads数进行差异显著性检验,最终根据差异倍数及差异显著性检验结果来筛选差异蛋白编码基因。比较照射前后mrna的表达变化,结果显示各个剂量组与对照组相比表达均上调的mrna有65个,表达均下调的mrna有15个,经过比较筛选出上调比较明显的rgs12(如表1所示),即将rgs12作为γ射线辐射检测的标志物,通过检测rgs12的表达量或相对表量可以检测或辅助检测待测受试者是否遭受γ射线辐射。
49.表1 balb/c雄性小鼠照射4h后mrna测序分析结果
50.51.fc值:实验组与对照组mrna表达值的比值
52.53.54.[0055][0056]
实施例2、在人淋巴母细胞(ahh1)中进行rgs12表达的验证
[0057]
1、细胞培养:
[0058]
ahh1细胞(上海宾穗生物科技有限公司(c0309))为永生化的正常人淋巴母细胞,培养于含10%胎牛血清的rpmi 1640培养基中,置37℃、5%co2培养箱中传代培养。
[0059]
2、采用钴60-γ射线照射:
[0060]
传代培养后的ahh1细胞给予钴60-γ射线照射。
[0061]
其中,所述钴60γ射线照射的照射条件为室温,照射剂量为1gy和2gy,4gy和6gy,照射距离为4米,剂量率为66.66cgy/min。收取对照组(不照射组)细胞(标记为0gy),依次收取辐照后4和12小时的细胞(标记为4h和12h)。
[0062]
3、ahh1细胞rna的提取:
[0063]
采用trizol法提取细胞rna,具体步骤如下:
[0064]
1)用15ml离心管收取10ml细胞混悬液,3000rpm,离心3分钟,倒掉上清,4℃ 1
×
pbs缓冲液清洗细胞2遍。弃上清,加1ml trizol,用移液枪吹打使其充分裂解,吹打细胞至拉丝状,吸至1.5ml ep管中。
[0065]
2)加入200μl氯仿,颠倒混匀,室温放置2-3分钟。
[0066]
3)4℃,12000rpm离心15分钟。
[0067]
4)吸取上层水相至另一1.5ml无rna酶ep管中。
[0068]
5)再加入500μl异丙醇(沉淀rna),颠倒混匀,室温放置10分钟。
[0069]
6)4℃,12000rpm离心10分钟,倒掉上清,rna沉于管底。
[0070]
7)加入0.5ml 75%乙醇,移液枪温和吹打液体,悬浮沉淀。
[0071]
8)4℃,12000rpm离心5分钟,小心吸掉上清,扣在位置上。
[0072]
9)室温晾干20分钟。
[0073]
10)用20-30μl无rna酶水溶解沉淀,放置37℃烘箱中孵育10min以溶解rna。
[0074]
11)测od值,用超微量分光光度计测定总rna浓度,以a260nm/a280nm比值评估纯度,定量rna浓度。
[0075]
12)将rna浓度调整到500ng/μl,按10ul每ep管分装,冻于-80℃冰箱。
[0076]
4、ahh1细胞总rna逆转录为cdna:
[0077]
逆转录所用的试剂盒为revertra ace qpcr rt master mix with gdna remover,具体步骤如下:
[0078]
1)从试剂盒中取出各组分放于冰上溶化,混匀溶化后的各组分并短暂离心后放于冰上备用。
[0079]
2)将4
×
dn master mix和gdna remover混合:取88μl的4
×
dn master mix和1.8μl的gdna remover混合,颠倒混匀备用,实验结束后放于-20℃冰箱保存备用。
[0080]
3)变性:取1μg的rna作为模板,置于65℃条件下水浴5min后,立即放于冰上备用。
[0081]
4)dna的去除:配制反应体系如下:
[0082]
表3 dna去除的反应体系(8μl)
[0083]
组分体积4
×
dn master mix(已添加gdna remover)2μlrna模板1μg无核酸酶水补足至8μl总体积8μl
[0084]
5)反应程序1:轻轻混匀以上反应体系后,放于37℃水浴,5min。
[0085]
6)逆转录的反应体系如下:
[0086]
表4逆转录反应体系(10μl)
[0087]
组分体积步骤5)中的反应体系18μl5
×
rt master mix ii2μl总体积8μl
[0088]
7)反应程序2:轻轻混匀以上反应体系,短暂离心后,将逆转录pcr反应体系放于pcr仪中上,设置程序如下:
[0089]
表5逆转录的反应程序
[0090][0091]
8)反应程序结束后,取出合成的cdna用于后续的实验,如若暂时不进行下一步实验,将cdna保存于-20℃冰箱备用。
[0092]
5、实时荧光定量pcr反应
[0093]
为了确定提取出的总rna中有rgs12存在,选用β-肌动蛋白为内参,利用实时荧光定量pcr的方法对总rna中的mrna进行检测,实时定量pcr所用的试剂盒为东洋纺生物科技公司(日本)公司的mrna荧光定量检测试剂盒(thunderbirdqpcr mix)。
[0094]
具体步骤如下:
[0095]
1)将试剂盒中各组分从-20℃冰箱取出,放于冰上解冻,使用前混匀并低速离心。
[0096]
2)将cdna稀释5倍,即加入180μl无菌无酶水,使总体积达到100μl;
[0097]
3)分别配制rgs12和内参β-肌动蛋白的荧光定量pcr反应体系,所述实时定量pcr反应体系如表6所示,rgs12和内参β-肌动蛋白的引物如表7所示;
[0098]
表6实时定量pcr反应体系(20μl)
[0099][0100]
表7实时荧光定量pcr引物序列
[0101][0102]
4)每个样品的每一种mrna做三个重复的反应体系,即三组平行试验,将配置好的qpcr反应体系均匀分装于白色的八连管中,反应体系配制的过程中需在冰上进行,并关闭实验台中的日光灯以避光;
[0103]
5)将分装到八连管中的反应体系轻轻混匀,短暂离心后,放置于pcr仪中,反应程序的如表8所示;
[0104]
表8实时定量pcr的反应程序
[0105][0106]
6)实时定量pcr反应完成后,保存实验数据进行分析,以法计算出目的rgs12的相对表达量。rgs12在不同批次的ahh1细胞中三次平均数据如图1所示,rgs12在不同照射时间点(4h、12h)以及不同的照射剂量(1gy、2gy、4gy和6gy)的rgs12的相对表达量;图1中照射剂量组分别与不照射组比较均存在显著性的差异(显著性水平是p≤0.05),说明通过检测ahh1细胞中rgs12的表达量或相对表达量可检测待测受试者是否遭受γ射线的辐射,当待测受试者的ahh1细胞中rgs12的表达量或相对表达量相对于未遭受γ射线辐射的对照组增加表明待测受试者遭受γ射线的辐射。
[0107]
照射4h的拟合曲线为:y=0.4772x+1.2294,r2=0.9556;照射12h的拟合曲线为:y=2.782x+3.1028,r2=0.9535,根据rgs12的表达值带入建好的拟合曲线的方程,就可以估
计出所受到的辐射剂量(见图3)。
[0108]
表9:ahh1细胞照射后的rgs12的相对表达量
[0109][0110][0111]
实施例3、在人离体外周血中进行rgs12表达的验证
[0112]
1、人外周血采集与培养:
[0113]
6名正常青年志愿者(均在实验前签署知情同意书),年龄20-30岁,近期无急性疾病感染史,无高血压、糖尿病等慢性疾病史,无吸烟史,无化学毒物接触史,非从事放射相关工作的人员,一次抽取2管共20ml的外周血于抗凝管中。
[0114]
2、钴60-γ射线照射:
[0115]
给予外周血不同剂量的钴60-γ射线照射,把照射后的外周血转移至含有等体积血清培养基的25cm培养瓶中继续培养,倾斜45℃放置培养瓶,置于37℃、5%co2培养箱中继续培养直至收获。
[0116]
其中,所述钴60-γ射线照射的照射条件为室温,照射剂量为1gy、2gy、4gy和6gy,照射距离为4米,剂量率为66.66cgy/min。收取对照组(不照射人群)血液(标记为0gy),依次收取辐照后4和12小时的细胞(标记为4h和12h)。
[0117]
3、人外周血rna的提取:
[0118]
采用qiaamp rna blood mini kit试剂盒提取外周血rna,具体步骤如下:
[0119]
1)将人抗凝外周血混匀,取1份的抗凝血液加入其体积5倍的buffer el混合,混合液体积应小于自备管体积的3/4;
[0120]
2)将混合液混匀,冰上孵育10-15分钟,孵育过程中混匀2次,此过程中混合液会逐渐变清亮,显示红细胞被溶解,若有需要可延长孵育时间至20分钟;
[0121]
3)4℃ 400g、离心10分钟,此时在离心管底可见细胞团形成,完全去除上清;
[0122]
4)按照提取抗凝血量的2倍加入buffer el,重悬细胞;
[0123]
5)4℃、400g、离心10分钟,完全去除上清;
[0124]
6)加入600μl的buffer rlt重悬上述沉淀物至无可见细胞团块,(使用前确保已加入β-巯基乙醇,1ml的buffer rlt加入β-巯基乙醇的量为10μl,混匀待用,室温可保存1个月),此过程后,可将混合物保存于-70℃冰箱,解冻时于37℃水浴融化;
[0125]
7)将上述混合物加入qiashredder spin column柱中,调整移液枪>750μl,确保
一步完成,以14000g离心2分钟,弃掉qiashredder spin column,保留均质化的混合液;
[0126]
8)加入与buffer rlt加入量等量的70%乙醇于均质化的混合液中,混匀,可见絮状沉淀形成;
[0127]
9)小心吸出混合液,包括形成的沉淀,加至qiaamp spin column柱中,≥10000g离心15秒,弃废液;
[0128]
10)将qiaamp spin column放置于一新的收集管中,加700μl buffer rw1于qiaamp spin column柱中,≥10000g离心15秒,洗涤,弃废液;
[0129]
11)将qiaamp spin column转移至一个新的收集管中,加500μl buffer rpe(rpe使用前加4倍体积的无水乙醇)于柱中,≥10000g离心15秒,弃废液;
[0130]
12)在qiaamp spin column柱中,再次加入500μl buffer rpe,14000g离心3分钟;
[0131]
13)将qiaamp spin column放于自备的1.5ep管中(无rnase、无菌处理),14000g离心3分钟;
[0132]
14)将qiaamp spin column放于1.5ep管(已提供)中,30-50μl rnase-free水于qiaamp膜上,≥10000g离心1分钟,若提取rna血量>0.5ml,可将获得的rna溶液再次加至柱上离心,以提高rna浓度。
[0133]
15)测od值,用超微量分光光度计测定总rna浓度,以a260nm/a280nm比值评估纯度,定量rna浓度。
[0134]
16)将rna浓度调整到500ng/μl,按10ul每ep管分装,冻于-80℃冰箱。
[0135]
4、人的离体外周血rna逆转录为cdna:
[0136]
逆转录所用的试剂盒为revertra ace qpcr rt master mix with gdna remover,具体步骤如同实施例2;
[0137]
5、实时荧光定量pcr反应
[0138]
为了确定提取出的总rna中有rgs12存在,选用β-肌动蛋白为内参,利用实时荧光定量pcr的方法对总rna中的mrna进行检测,实时定量pcr所用的试剂盒为东洋纺生物科技公司(日本)公司的mrna荧光定量检测试剂盒(thunderbirdqpcr mix)。具体步骤如同实施例2;
[0139]
实时定量pcr反应完成后,保存实验数据进行分析,以法计算出目的rgs12的相对表达量。rgs12在3批不同批次的人外周血后三次平均数据如图2所示,图2示出了rgs12在不同照射时间点(4h和12h)以及不同的照射剂量(1gy、2gy、4gy和6gy)的相对表达量;图2中照射剂量组分别与不照射组比较均存在显著性的差异(显著性水平是p≤0.05),说明通过检测ahh1细胞中rgs12的表达量或相对表达量可检测待测受试者是否遭受γ射线的辐射,当待测受试者的ahh1细胞中rgs12的表达量或相对表达量相对于未遭受γ射线辐射的对照组增加表明待测受试者遭受γ射线的辐射。
[0140]
照射4h的拟合曲线为:y=0.3612x+1.2209,r2=0.9514;照射12h的拟合曲线为:y=0.1482x+1.1987,r2=0.8501,根据rgs12的表达值带入建好的拟合曲线的方程,就可以估计出所受到的辐射剂量(见图4)。
[0141]
表10:人外周血照射后的rgs12的相对表达量
[0142][0143][0144]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1