DNASE1L3基因作为肝癌侵袭转移的检测和/或防治靶点的应用
dnase1l3基因作为肝癌侵袭转移的检测和/或防治靶点的应用
技术领域
1.本发明涉及生物医药技术领域,尤其涉及dnase1l3基因作为高nets(中性粒细胞胞外诱捕网,neutrophil extracellular traps)环境所致肝癌侵袭转移的检测和/或防治靶点的应用。
背景技术:
2.肝癌是威胁全球公众健康的重大疾病,其发病率和死亡率逐年上升。肝细胞肝癌(hepatocellular carcinoma,hcc)是原发性肝癌的主要类型,局部侵袭和远处转移是hcc治疗失败,最终导致患者死亡的重要原因。目前,手术切除仍是hcc治疗的主要手段。然而,很多hcc患者在确诊时肿瘤已经发展至中、晚期,错失手术的机会。另外,hcc细胞对很多常规化疗药物并不敏感。即便是价格昂贵的靶向治疗和免疫治疗的疗效也极为有限,而且副作用较多。因而,根据疾病的病理特征和hcc细胞的基因组特点采取精准治疗,对hcc的防治具有及其重要的意义和价值。
3.随着肝癌早期诊断、早期治疗和手术切除技术的进步,总体疗效有所提高。但肝癌癌细胞的易侵袭转移的特性,即使获得根治性切除术,病人在后续几年也经常出现转移复发,所以及早预测肝癌复发和转移风险并采取相应的干预措施显得十分必要。值得注意的是,在糖尿病人群中,肝癌的发病率和死亡率较无糖尿病的肝癌患者明显升高,因此,有必要寻找合适的靶点针对此类人群的肝癌肿瘤转移和复发进行预警和防治。
技术实现要素:
4.为了克服现有技术的不足,本发明的目的在于提供dnase1l3基因作为高nets环境所致肝癌侵袭转移的检测和/或防治靶点的应用。
5.本发明的目的采用如下技术方案实现:
6.dnase1l3基因作为高nets环境所致肝癌侵袭转移的检测和/或防治靶点的应用。
7.进一步地,所述dnase1l3基因包括两个转录变异体,其核苷酸序列分别如seq id no.1和seq id no.2所示。
8.进一步地,所述dnase1l3基因用于编码dnase1l3酶(脱氧核糖核酸酶γ)。
9.进一步地,所述dnase1l3酶和/或其同类脱氧核糖核酸酶(如dnase i酶)在抑制高nets环境所致肝癌侵袭转移中的应用
10.进一步地,检测所述dnase1l3基因在体液中、肿瘤组织中表达的试剂在诊断及预测高nets环境所致肝癌侵袭转移的试剂中的应用。
11.进一步地,所述体液包括血液、唾液、尿液、引流液中任一种或两种以上。
12.进一步地,所述高nets环境由持续的糖尿病状态、手术、感染和伤害性刺激中的至少一种所导致。
13.相比现有技术,本发明的有益效果在于:
14.本发明的dnase1l3基因作为高nets环境所致肝癌侵袭转移的检测和/或防治靶点的应用,通过检测dnase1l3基因的表达水平预测高nets环境所致肝癌侵袭转移的风险。
15.发明人发现,在高nets环境下,胞外游离dna的含量升高,游离dna对肿瘤细胞的侵袭转移具有极强的促进作用;在肝癌组织中dnase1l3基因的表达降低,低表达dnase1l3的肝癌患者生存率也显著下降,证明在肝癌细胞内dnase1l3表达缺陷,导致胞外dnase1l3酶含量减少,不利于胞外游离dna的清除,这对nets诱导的肝癌细胞侵袭转移具有显著的增效作用。
16.持续的糖尿病状态可促进中性粒细胞发生netosis,由此释放nets;另外dnase1l3基因表达缺陷,导致胞外dnase1l3酶含量减少,两者协同下使胞外游离dna含量升高,对肿瘤细胞的侵袭转移具有极强的促进作用;dnase1l3基因及其编码蛋白dnase1l3作为糖尿病患者的肝癌侵袭转移的检测和/或防治靶点,进行风险预测和/或防治药物的筛选,可为肝癌转移复发风险预测和/或防治药物提供一种新的筛选方法和研发思路。
附图说明
17.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单介绍。
18.图1为本发明的实施例1中糖尿病患者血清和外源分离的nets对肝癌snu398细胞侵袭生长图。其中,图1a为糖尿病患者血清和健康志愿者血清对肝癌snu398细胞侵袭生长图;图1b为不同浓度的nets对肝癌snu398细胞侵袭生长图。
19.图2为本发明的实施例1中pma处理使中性粒细胞释放nets的分析图。
20.其中,图2a为用pma刺激人中性粒细胞后用hoechst染色结合荧光照相术检测细胞核dna的显微图;图2b为picogreen染色检测正常中性粒细胞培养液和pma处理中性粒细胞培养液中胞外游离dna含量的定量分析图;图2c为中性粒细胞释放nets的模式图;图2d为检测nets颗粒蛋白的结果图;图2e为nets颗粒蛋白的催化活性图。
21.图3为本发明的实施例2中dnase i抑制不同来源nets引起的肝癌snu398细胞侵袭生长图。其中,图3a为dnase i抑制糖尿病患者血清引起的肝癌snu398细胞侵袭生长图;图3b为dnase i抑制外源分离的nets引起的肝癌snu398细胞侵袭生长图。
22.图4a为本发明的实施例3中正常肝组织和hcc肿瘤组织中编码dna降解酶相关基因表达量的热图。
23.图4b为本发明的实施例3中dnase1l3基因在正常肝组织和hcc肿瘤组织中表达的小提琴图。
24.图4c为本发明的实施例3中dnase1l3基因低表达和高表达的hcc肝癌患者生存率对比图(p《0.001)。
25.图4d为本发明的实施例3中正常肝癌snu398细胞和敲低dnase1l3基因表达的肝癌snu398细胞,nets引起的细胞侵袭转移图。
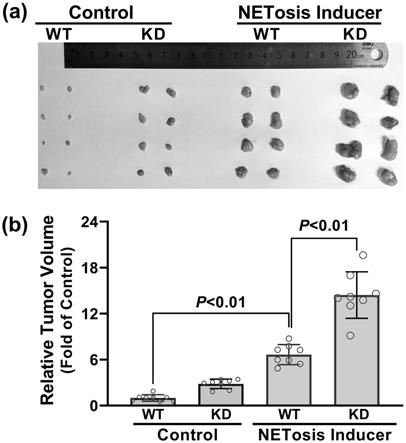
26.图5为本发明的实施例4中在高nets环境裸鼠、敲低dnase1l3基因对肝癌移植瘤在裸鼠体内侵袭性生长的对比图。图5a为肿瘤体积对比图;图5b为图5a的统计图。
具体实施方式
27.下面,结合具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。以下是本发明具体的实施例,在下述实施例中所采用的原材料、设备等除特殊限定外均可以通过购买方式获得。
28.实施例1
29.糖尿病患者血清促进肝癌细胞侵袭转移分析
30.1.糖尿病状态促进肝癌细胞侵袭转移
31.试验方法:分离糖尿病患者血清和健康志愿者血清,加至transwell小室,随后分别接种人肝癌snu398细胞孵育48h,检测细胞的侵袭转移。
32.结果:如图1a所示,与正常(normal)血清相比,糖尿病患者(diabetic)血清对肝癌snu398细胞具有更强的促进作用(p《0.01)。
33.2.用pma处理人中性粒细胞制备nets并对其进行鉴定
34.在用pma处理人中性粒细胞后,被处理的细胞可释放网状结构成分(图2a);将这些网状结构收集,用picogreen染色,发现其荧光强度明显较高,提示含有更多的游离dna(图2b);中性粒细胞释放网状结构(nets)的模式图如图2c所示;进一步,用免疫印迹法检测胞外成分中颗粒蛋白,发现这些网状结构中含有mpo、mmp-9和ne等蛋白(图2d);试剂盒检测胞外成分,发现具有mpo和ne蛋白的催化活性(图2e)。说明本法制备的nets和体内产生的nets之间具有可比性。
35.3.外源提取的nets促进肝癌细胞侵袭转移
36.试验方法:将人肝癌snu398细胞分组接种于transwell小室中,用上述提取的nets处理肝癌细胞。所用nets的浓度分别为0.1μg/ml、0.2μg/ml、0.5μg/ml、1μg/ml、2μg/ml的实验组和空白对照组(control),处理时间为48h,检测细胞的侵袭转移。
37.结果:如图1b所示,外源提取的nets在一定浓度范围内(0.1~0.2μg/ml)也能促进肝癌snu398细胞的侵袭转移(
**
p《0.01)。
38.实施例2
39.胞外游离dna介导糖尿病患者血清和nets所致肝癌细胞侵袭转移
40.为明确糖尿病患者血清和外源性提取的nets所致肝癌细胞的侵袭转移是否与dna有关,我们应用了dna酶i(dnase i)清除胞外游离dna。
41.试验方法:将肝癌snu398细胞接种于transwell小室,加入糖尿病患者血清(dm serum)和/或dnase i,标记为(a),检测细胞侵袭转移;
42.将肝癌snu398细胞接种于transwell小室,加入外源提取的nets和/或dnase i处理,标记为(b),检测细胞侵袭转移。
43.结果:如图3a所示,dnase i本身对肝癌snu398细胞的侵袭转移无明显影响,然而其可显著削弱糖尿病患者血清所诱导的肝癌细胞侵袭转移(
##
p《0.01);
44.如图3b所示,dnase i也可抑制外源性nets所诱导的肝癌细胞侵袭转移(
##
p《0.01);
45.此结果说明,糖尿病通过引起中性粒细胞发生netosis并释放nets,依赖nets的dna成分诱导了肝癌细胞的侵袭转移。
46.实施例3
47.dnase1l3基因表达对nets促进肝癌细胞侵袭转移的影响
48.由于胞外dna受到dnase的精准调控,为此我们首先应用生物信息学分析tcga_lihc数据库中肝癌组织和正常肝组织中dna降解酶相关基因的表达。
49.如图4a所示,将正常肝组织和hcc肿瘤组织中dna降解相关基因绘制表达量热图,确定在所有胞外dna降解酶的基因中,基因dnase1l3差异表达最明显。基因dnase1l3包括两个转录变异体(transcript variant),转录变异体的核苷酸序列分别如seq id no.1和seq id no.2所示。
50.如图4b所示,与正常肝组织(normal)相比,肿瘤组织(hcc)中dnase1l3基因的表达明显降低。
51.根据dnase1l3的基因表达量,将肝癌患者分为dnase1l3高、低两组,分析两组的生存率;结果如图4c所示,低表达dnase1l3的肝癌患者的生存率显著下降,p《0001。
52.采用体外细胞模型,对敲低dnase1l3基因的肝癌snu398细胞和正常肝癌snu398细胞的侵袭转移进行试验,如图4d所示,敲低肝癌snu398细胞内dnase1l3基因对nets诱导的肝癌细胞侵袭转移具有显著的增效作用。
53.上述结果表明,在肝癌细胞内dnase1l3基因表达缺陷,将导致胞外dnase1l3酶含量减少,不利于肿瘤细胞外dna的清除,这些游离dna对肿瘤细胞的侵袭转移具有极强的促进作用。
54.实施例4
55.dnase1l3基因对高nets环境所致肝癌侵袭转移的影响
56.试验方法:腹腔注射lps,在整体动物水平诱导裸鼠发生中性粒细胞netosis,用picogreen染色证实血清nets-dna含量升高,得到netosis裸鼠。
57.将正常snu398细胞(wt,野生型)和dnase1l3基因敲低型snu398细胞(kd)的移植瘤分别接种在正常裸鼠皮下(对照组,control),比较两者的相对肿瘤体积(relative tumor volume)。
58.将正常snu398细胞(wt,野生型)和dnase1l3基因敲低型snu398细胞(kd)的移植瘤分别接种在netosis裸鼠皮下(netosis试验组,netosis inducer),比较两者的相对肿瘤体积(relative tumor volume)。
59.结果:如图5所示,与正常裸鼠相比,肝癌细胞在netosis裸鼠体内侵袭生长更快(p《0.01)。在rna干扰法敲低肝癌snu398细胞内的dnase1l3基因后,低表达该基因的肝癌snu398细胞较野生型肝癌snu398细胞的侵袭生长更快(p《0.01)。
60.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1