一种重组质粒pMFA42S-Ag85a-IL-17a及其构建方法与应用与流程
一种重组质粒pmfa42s-ag85a-il-17a及其构建方法与应用
技术领域
1.本发明涉及生物医学技术领域,尤其涉及一种重组质粒pmfa42s-ag85a-il-17a及其构建方法与应用。
背景技术:
2.哮喘是人类呼吸系统最为常见的变态反应性疾病,整体发病率呈现逐年上升的趋势。哮喘反复发作使患者的日常生活受到严重影响,生活质量明显下降,哮喘已然成为严重的社会问题。因此,对哮喘的治疗进行深入研究,寻求新的治疗策略十分必要。
3.应用特异性抗体或可溶性受体阻断细胞因子的致炎作用,是目前比较成熟的抗炎靶向治疗策略。目前针对细胞因子的单克隆抗体已被用来治疗如关节炎、变异性脑炎、强直性脊柱炎等多种严重的自身免疫性疾病。抗il-17a单克隆抗体也已被用于哮喘治疗的研究中,动物实验研究指出,抗il-17a单克隆抗体被动免疫接种哮喘模型小鼠后,能降低小鼠气道中性粒细胞的浸润,但与此同时也增强了机体的th2型免疫反应,小鼠的balf中il-5、il-13等th2细胞因子的表达水平显著升高,因而治疗效果并不确切,并且单克隆抗体费用较高,往往需要大剂量反复多次注射,限制了其临床应用。
4.卡介苗(bacillus calmette-gu
é
rin,bcg)是结核分枝杆菌减毒活疫苗,作为非特异性免疫调节剂,可刺激th1型免疫反应,抑制th2型免疫反应,调控th1/th2细胞平衡,抑制嗜酸性粒细胞在气道局部的聚集,从而降低气道高反应性,减轻气道炎症。但bcg生长缓慢且构建的重组疫苗质粒表达水平偏低,因而也限制了其应用。
5.因此,亟需一种同时兼具有调节th1/th2细胞平衡功能,并可通过主动免疫诱导机体产生自身抗体抑制内源性il-17a的功能的重组耻垢分枝杆菌疫苗rms-ag85a-il-17a。
技术实现要素:
6.本发明的目的是针对现有技术中的不足,提供一种重组质粒pmfa42s-ag85a-il-17a及其构建方法与应用。
7.为实现上述目的,本发明采取的技术方案是:
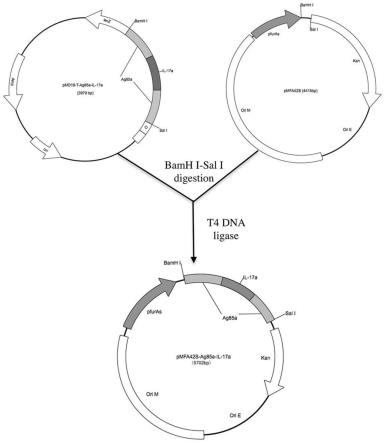
8.本发明的第一方面是提供一种重组质粒pmfa42s-ag85a-il-17a,所述重组质粒pmfa42s-ag85a-il-17a的核苷酸序列如seq id no:1所示。
9.测序结果如下表所示:
[0010][0011]
本发明的第二方面是提供一种上述重组质粒pmfa42s-ag85a-il-17a的构建方法,步骤包括:
[0012]
步骤a1、pcr扩增目的基因ag85a-il-17a;
[0013]
步骤a2、分别酶切所述目的基因ag85a-il-17a以及质粒pmfa42s;
[0014]
步骤a3、连接所述目的基因ag85a-il-17a与所述质粒pmfa42s,即得所述重组质粒pmfa42s-ag85a-il-17a。
[0015]
优选地,步骤a1中,所述目的基因ag85a-il-17a的上游引物核苷酸序列如seq id no:2所示,所述目的基因ag85a-il-17a的下游引物核苷酸序列如seq id no:3所示。
[0016]
更优选地,步骤a1中,所述pcr扩增的反应体系包括:
[0017][0018][0019]
优选地,步骤a1中,pcr扩增目的基因ag85a-il-17a后,分离纯化所述目的基因ag85a-il-17a。
[0020]
优选地,步骤a2中,酶切所述目的基因ag85a-il-17a以及质粒pmfa42s时,所采用的酶均为bamh i以及sal i。
[0021]
更优选地,步骤a2中,所述酶切质粒pmfa42s的反应体系包括:
[0022][0023]
优选地,步骤a3中,所述连接的反应体系包括:
[0024][0025]
本发明的第三方面是提供一种上述重组质粒pmfa42s-ag85a-il-17a在构建重组耻垢分枝杆菌疫苗中的应用。
[0026]
优选地,所述重组耻垢分枝杆菌疫苗的构建步骤包括:
[0027]
步骤b1、制备耻垢分枝杆菌感受态细胞;
[0028]
步骤b2、电转化所述重组质粒pmfa42s-ag85a-il-17a至所述耻垢分枝杆菌感受态细胞中,即得所述重组耻垢分枝杆菌疫苗。
[0029]
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
[0030]
本发明以大肠杆菌-分枝杆菌穿梭表达载体pmfa系列中的pmfa42s为载体,构建重组质粒pmfa42s-ag85a-il-17a,采用电转化技术将重组质粒pmfa42s-ag85a-il-17a转入耻垢分枝杆菌中,构建表达融合蛋白ag85a-il-17a的重组耻垢分枝杆菌疫苗rms-ag85a-il-17a。上述疫苗同时兼具有调节th1/th2细胞平衡功能,并可通过主动免疫诱导机体产生自身抗体抑制内源性il-17a的功能,实验周期短,方法经济,且仅需要2次接种,具有较强的实用性。
附图说明
[0031]
图1为重组质粒pmfa42s-ag85a-il-17a的构建流程示意图;
[0032]
图2a为巨噬细胞凋亡率的比较结果;图2b为细胞培养上清中no浓度测定结果;
[0033]
图3a为小鼠第28天血清稀释液od值测定结果;图3b为小鼠血清1:100稀释后不同时间点血清中抗体滴度的变化;图3c为小鼠血清稀释液中抗il-17a自身抗体滴度的测定结果;
[0034]
图4a为实验动物免疫方案的流程示意图;图4b为实验流程的示意图;
[0035]
图5a为不同组小鼠inf-γ+th细胞百分比;图5b为不同组小鼠il-4+th细胞百分比;
[0036]
图6为重组耻垢分枝杆菌与野生型耻垢分枝杆菌生长曲线的比较结果。
具体实施方式
[0037]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0038]
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
[0039]
下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
[0040]
实施例1
[0041]
重组耻垢分枝杆菌rms-ag85a-il-17a小鼠体内诱导抗il-17a自身抗体
[0042]
1.菌株准备
[0043]
从-80℃冰箱中取出冻存的耻垢分枝杆菌m.smegmatis(ms),rms-ag85a,rms-il-17a和rms-ag85a-il-17a菌株,分别接种于7h9和含卡那霉素(kan)(20g/ml)的7h9液体培养基中,置于37℃摇床中200g振摇培养过夜,按1:200体积比分别转接至上述培养基中,继续培养至对数生长期,以4000g离心5min收集菌体沉淀,pbs洗涤3次后,用pbs重悬菌体并调整至浓度约为5
×
108cfu/ml。
[0044]
2.动物免疫方案
[0045]
将balb/c小鼠随机分为5组,分别为哮喘组,重症哮喘组,重症哮喘+ms组,重症哮喘+rms-ag85a-il-17a组和pbs组,每组6只动物。
[0046]
各组动物处理方案如下:
[0047]
(1)哮喘组:小鼠分别于实验第7天和第21天腹腔注射200μl ova混悬液(含10μg ova和1.6mg氢氧化铝),于实验第28天到第34天,以10mg/ml ova雾化吸入20min,24h后处死小鼠,收集标本。
[0048]
(2)重症哮喘组:小鼠前期处理同哮喘组,在此基础上于实验第45天以200mg/ml ova大剂量雾化吸入20min,24h后处死小鼠,收集标本。
[0049]
(3)重症哮喘+ms组:小鼠分别在实验第0天和第14天鼻腔接种ms菌液20μl(5
×
108cfu/ml),每只小鼠每次接种细菌总量约为107cfu,于实验第7天和第21天腹腔注射200μl ova混悬液,于实验第28天到第34天,以10mg/ml ova雾化吸入20min,于实验第45天以200mg/ml ova大剂量雾化吸入20min,24h后处死小鼠,收集标本。
[0050]
(4)重症哮喘+rms-ag85a-il-17a组:小鼠分别在实验第0天和第14天鼻腔接种rms-ag85a-il-17a菌液20μl(5
×
108cfu/ml),每只小鼠每次接种细菌总量约为107cfu,余处理同重症哮喘+ms组。
[0051]
(5)pbs组:小鼠于相同实验时间分别以等量pbs鼻腔接种、腹腔注射及雾化吸入处理。
[0052]
3.elisa法血清抗il-17a自身抗体滴度的测定
[0053]
分别于实验第3天,第7天,第14天,第21天和第28天小鼠眼眶取血,血标本于室温静置,待血液凝固后4000g低温离心10min,分离血清。
[0054]
以il-17a的碳酸盐缓冲液包被96孔酶标板,4℃包被过夜。以pbs-t20缓冲液洗板3次,每孔加入100μl封闭液,37℃孵育1h;弃封闭液,加入pbs-t20缓冲液洗涤3次。血清样品
起始以1:100倍比稀释于样品稀释液,各取100μl加入抗原包被过的酶标板中,37℃反应1h;弃样品液,加入pbs-t20缓冲液洗涤6次;将hrp标记的羊抗鼠igg以1:5000稀释于样品稀释液,每孔各加入100μl,37℃反应30min;pbs-t20缓冲液洗涤7次;每孔各加入tmb底物溶液100μl,37℃反应15min-20min,最后加入终止液2m h2so450μl终止反应。将酶标板置于酶标仪中读数。
[0055]
结果如图3a-c所示,ms组、rms-ag85a组、rms-il-17a组与pbs组的od值均无显著性差异,这4组小鼠血清中无抗il-17a特异性抗体,而rms-ag85a-il-17a组小鼠血清中具有较高滴度的抗il-17a特异性抗体;在小鼠免疫后第1周,血清中开始出现抗体,第3周到达峰值(od值1.02
±
0.03),滴度可维持4周以上。
[0056]
实施例2
[0057]
重组耻垢分枝杆菌rms-ag85a-il-17a对小鼠巨噬细胞raw264.7功能的影响
[0058]
1.ms及rms-ag85a-il-17a感染raw264.7细胞
[0059]
从co2培养箱中取出贴壁培养的raw264.7细胞,分别选择6个培养孔,弃培养基,按moi(multiplicity of infection)为5加入以dmem高糖培养基重悬的ms和rms-ag85a-il-17a,补足培养基体积至1ml,继续培养3h,使耻垢分枝杆菌充分感染巨噬细胞,以dmem培养基洗涤细胞3遍以除去细胞外部未感染的分枝杆菌,加入1ml新鲜的含10%fbs的dmem高糖培养基继续培养至48h;另设6个培养孔,加入不含耻垢分枝杆菌的dmem高糖培养基作为对照组。
[0060]
2.感染巨噬细胞内耻垢分枝杆菌菌落形成单位(cfu)检测
[0061]
(1)ms及rms-ag85a-il-17a按上述方案感染巨噬细胞,分别于感染后3h、12h以及24h处理细胞。
[0062]
(2)pbs缓冲液洗涤细胞3次,去除未感染细胞的菌体,轻轻吹打细胞收集,经血球计数板计数细胞密度。
[0063]
(3)取等量各组细胞离心,弃上清,加入1.0%的sds溶液200μl裂解巨噬细胞约10min,加入800μl的7h9液体培养基。
[0064]
(4)将裂解液以7h9液体培养基倍比稀释涂于7h11固体培养基,37℃培养约3天后进行cfu计数。
[0065]
(5)根据裂解液稀释倍数,计算每组细胞吞噬细菌的存活数量。
[0066]
3.巨噬细胞凋亡率的测定
[0067]
(1)ms及rms-ag85a-il-17a按上述方案感染巨噬细胞,于感染后48h收获细胞,冷pbs洗涤细胞2次,以binding buffer重悬细胞,调整细胞密度至1
×
106/ml。
[0068]
(2)取100μl细胞悬液加入离心管(1
×
105细胞),加入5μl annexin-fitc,混匀,避光室温孵育15min。
[0069]
(3)加入400μl binding buffer,置流式细胞仪检测并加以分析。
[0070]
4.rms-ag85a-il-17a对巨噬细胞分泌no的影响
[0071]
ms及rms-ag85a-il-17a分别感染巨噬细胞,培养48h后吸取细胞培养上清,采用griess法测定各种细胞no的分泌浓度。
[0072]
结果如图2a-b所示,感染ms和rms-ag85a-il-17a后,巨噬细胞的凋亡率均显著高于正常对照组(17.30%
±
1.50%,24.37%
±
1.48%vs.11.96%
±
1.45%),差异有统计学
意义(p《0.01);而rms-ag85a-il-17a组细胞的凋亡率显著高于ms组,差异有统计学意义(p《0.01);
[0073]
与正常对照组比较,感染ms及rms-ag85a-il-17a后巨噬细胞no分泌显著增加(11.11μmol/l
±
1.55μmol/l,11.71μmol/l
±
1.51μmol/lvs.4.83μmol/l
±
1.09μmol/l),差异有统计学意义(p《0.01);ms组与rms-ag85a-il-17a组比较,no分泌无显著性差异(p>0.01)。
[0074]
实施例3
[0075]
rms-ag85a-il-17a对哮喘小鼠脾脏th1和th2细胞数量的影响
[0076]
脾细胞在体外培养,经ova刺激24h后收集细胞,流式细胞术分别检测各组小鼠脾脏inf-γ+th细胞和il-4+th细胞百分比。
[0077]
结果如图5a-b所示,哮喘组以及重症哮喘组的inf-γ+th细胞百分比分别为0.239%以及0.231%,明显低于pbs组的0.618%(p《0.01),rms-ag85a-il-17a干预组的inf-γ+th细胞百分比为0.705%,明显高于重症哮喘组,差异有统计学意义(p《0.01);
[0078]
哮喘组以及重症哮喘组的il-4+th细胞百分比分别为0.736%以及0.796%,明显高于pbs组的0.329%(p《0.01),rms-ag85a-il-17a干预组的il-4+th细胞百分比为0.569%,较重症哮喘组明显降低,差异有统计学意义(p《0.01)。
[0079]
实施例4
[0080]
重组耻垢分枝杆菌(rms-ag85a-il-17a)与野生型耻垢分枝杆菌生长曲线的比较
[0081]
将ms和rms-ag85a-il-17a单菌落分别接种于7h9液体培养基,置于37℃摇床上,低转速振摇培养。
[0082]
结果如图6所示,rms-ag85a-il-17a较之野生型耻垢分枝杆菌生长速度略为缓慢,约在接种28h后进入对数生长期,且对数生长状态可以维持20h以上,约在72h后生长进入平台期。
[0083]
综上所述,本发明以大肠杆菌-分枝杆菌穿梭表达载体pmfa系列中的pmfa42s为载体,构建重组质粒pmfa42s-ag85a-il-17a,采用电转化技术将重组质粒pmfa42s-ag85a-il-17a转入耻垢分枝杆菌中,构建表达融合蛋白ag85a-il-17a的重组耻垢分枝杆菌疫苗rms-ag85a-il-17a。上述疫苗同时兼具有调节th1/th2细胞平衡功能,并可通过主动免疫诱导机体产生自身抗体抑制内源性il-17a的功能,实验周期短,方法经济,且仅需要2次接种,具有较强的实用性。
[0084]
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1