麦饭石益生菌发酵物及其应用的制作方法
:
1.本发明属于益生菌技术领域,具体涉及一种麦饭石益生菌发酵物及其在肠道菌群调节中的应用。
背景技术:
2.麦饭石最早收载于《本草纲目》,《中国药学大辞典》中记载,麦饭石味甘、性温、无毒,可健脾养胃,除寒祛湿。现代研究表明,麦饭石具有良好的吸附性、溶出性、矿化性、生物活性等多种特性。麦饭石所含的微量元素,可以提高抗疲劳、抗缺氧和免疫能力,具有健身益寿、防衰抗病作用。其对镉、汞、砷、铅等对人体有害的几种元素有较强的吸附力,对氯丙嗪也有较强的吸附作用,同时对大肠杆菌、痢疾杆菌、绿脓杆菌、金黄色葡萄球菌及白色念珠菌也有较好的吸附能力,可以改善人体胃肠道环境,增强人体胃肠道蠕动和消化能力。此外,利用麦饭石作为新型抗菌剂载体也成为目前研究的前沿领域。
3.鼠李糖乳杆菌是厌氧耐酸、不产芽孢的一种革兰氏阳性益生菌。鼠李糖乳杆菌lactobacillus rhamnosus gg(简写为lactobacillus gg或lgg)在人类肠道环境中定殖和繁殖后,依附于宿主的肠上皮细胞,能够成为肠道粘膜的一层生物屏障。而且,lgg能对宿主肠道内的微生态系群落结构和功能进行调节,并使之达到平衡状态,进而达到改善宿主消化道系统功能的目的。相关研究表明,lgg对成年人的黏着率明显高于小儿,主要是由于成年人的肠道环境更为成熟,适宜lgg黏着。
4.借助lgg可以达到预防和治疗腹泻的目的,相关研究表明,29名患婴分别口服lgg制剂和普通牛乳后,在服用lgg婴儿的粪便中检测出lgg菌种。说明服用后,宿主借助lgg实现对肠道菌群的调节,且服用lgg制剂婴儿的腹泻治疗效果比服用普通牛乳的治疗效果好。
5.据此,本发明将公开麦饭石对鼠李糖乳杆菌耐受性的影响及其吸附情况。并将麦饭石与鼠李糖乳杆菌共同发酵,以此治疗腹泻模型大鼠,实现调节肠道菌群和改善肠道炎症的功能。
技术实现要素:
6.本发明涉及一种麦饭石和鼠李糖乳杆菌发酵物及其制备方法,通过麦饭石发酵提高鼠李糖乳杆菌在不同环境下的耐受能力,并通过给予有效量的中华麦饭石-鼠李糖乳杆菌发酵物达到治疗腹泻模型动物的肠道炎症并调节肠道菌群的目的。
7.本发明提供的技术方案之一,是一种复合培养基,所述复合培养基是由矿化水配置mrs培养基后添加麦饭石粉末所得;
8.所述mrs培养基组成为(g/l):蛋白胨4.0~14.0,牛肉粉3.0~12.0,酵母粉1.0~5.0,葡萄糖10.0~30.0,磷酸氢二钾1.0~3.0,柠檬酸氢二铵1.0~5.0,乙酸钠2.0~8.0,硫酸镁0.1~1.0,硫酸锰0.01~0.5,吐温80 0.1~3.0,其余为溶剂;
9.优选地,所述mrs培养基组成为(g/l):蛋白胨10.0,牛肉粉8.0,酵母粉4.0,葡萄糖20.0,磷酸氢二钾2.0,柠檬酸氢二铵2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温80 1.0,
其余为溶剂;
10.所述矿化水的制备方法如下:将麦饭石样品打粉,过40-325目筛,得麦饭石粉末;过筛后的麦饭石粉末按质量体积比(g/ml)1-2:1-20与水混合,35-39℃、100-150rpm浸泡12-36h,得麦饭石矿化水悬浊液,减压抽滤后过微滤膜,得麦饭石矿化水;
11.优选地,所述麦饭石为中华麦饭石;
12.优选地,所述麦饭石粉末为80-325目;
13.优选地,所述微滤膜为0.45μm滤膜;
14.进一步地,所述复合培养基采用75%矿化水配置,即将矿化水和纯净水按75:25混合后制备成75%矿化水;
15.进一步地,所述复合培养基添加2-10%(m/v)麦饭石粉;
16.更进一步地,所述所述麦饭石粉末为40-325目;
17.优选地,添加5%160目的麦饭石粉末;
18.更优选地,所述复合培养基组成为(g/l):蛋白胨10.0,牛肉粉8.0,酵母粉4.0,葡萄糖20.0,磷酸氢二钾2.0,柠檬酸氢二铵2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温80 1.0,160目的麦饭石粉末50.0,其余为75%矿化水;
19.进一步地,所述复合培养基ph5.7
±
0.2。
20.本发明提供的技术方案之二,是方案一所述复合培养基的应用;
21.进一步地,所述应用为其在鼠李糖乳杆菌培养中的应用;
22.进一步地,所述应用为在提高鼠李糖乳杆菌耐受性中的应用;
23.所述耐受性包括但不限于酸性、碱性、胃液、肠液、胆盐耐受性;
24.进一步地,所述应用为制备由技术方案一培养获得的鼠李糖乳杆菌发酵物,具体制备方法如下:
25.培养基接入鼠李糖乳杆菌,35-39℃,100-150rpm培养12-16h后即得;
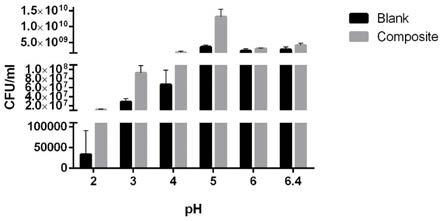
26.进一步地,按1
×
10
7-5
×
10
10
cfu/ml接入鼠李糖乳杆菌;
27.所述发酵物可为液态,也可冻干后以固态形式进行保存和使用;
28.本发明提供的技术方案之三,是上述发酵物在制备治疗腹泻药物中的应用,特别是在制备调节肠道菌群药物中的应用。
29.有益效果:
30.1、本发明提供的麦饭石复合培养基能显著促进鼠李糖乳杆菌在酸性、胆盐及人工肠液环境中的存活,表现出优良的抗酸、抗胆盐及人工肠液特性。复合培养基在2≤ph≤5的酸性环境中,或0.1-0.15%胆盐浓度时,对鼠李糖乳杆菌具有保护作用,且在人工肠液中可显著提高其存活能力。
31.2、本发明制备的复合培养基,用于发酵鼠李糖乳杆菌,发酵产物用于治疗腹泻模型大鼠,可以缓解大鼠的腹泻情况,增加大鼠体重并降低粪便含水量。经治疗后大鼠肠道炎症恢复明显,可认为发酵产物具有改善病情的功效,且发酵过程可增强治疗效果。发酵产物可降低大鼠结肠炎性因子表达情况,使其结肠的炎性症状得到了改善。治疗后大鼠结肠内大肠杆菌、乳杆菌数量略有增加,双歧杆菌数量明显减少,发酵产物对大鼠肠道中肠道菌群中的关键菌株有一定调节作用。
附图说明:
32.图1是不同ph中复合培养基发酵体系鼠李糖乳杆菌生长变化情况
33.其中,blank为mrs培养基体系,composite为复合培养基体系。
34.图2是不同胆盐浓度中复合培养基发酵体系鼠李糖乳杆菌生长变化情况
35.其中,blank为mrs培养基体系,composite为复合培养基体系。
36.图3是人工肠液中复合培养基发酵体系鼠李糖乳杆菌生长变化情况
37.其中,blank为mrs培养基体系,composite为复合培养基体系。
38.图4是大鼠病理状态变化情况
39.其中,a图为大鼠体重变化量;b图为大鼠粪便含水量值;
40.blank为空白组,model为模型组,normal saline为自然恢复组,probiotics为益生菌组,fermentation为发酵组。
41.图5是大鼠结肠h&e病理切片情况。
42.图6是大鼠炎性因子在肠组织中表达情况
43.其中,a图为tlr4在肠组织中的含量;b图为nf-κb在肠组织中的含量。
44.图7是大鼠不同肠道菌的特征基因表达量相对变化情况(空白组为参照,设置为1)。
具体实施方式:
45.为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本专利,并不用于限定本发明。
46.麦饭石矿化水的制备:
47.将中华麦饭石样品打粉,过40-325目筛,得麦饭石粉末。过筛后的麦饭石粉末各取20-40g,加入200-400ml去离子水,35-39℃、100-150rpm浸泡12-36h,得麦饭石矿化水悬浊液,减压抽滤后过0.45μm滤膜,得麦饭石矿化水。
48.本发明实施例使用的实验菌株为鼠李糖乳杆菌cctcc hb 20082747,该菌株为申请日前已公开的菌株,公众可从中国典型培养物保藏中心(cctcc)获取。
49.本发明实施例中培养基如未特别标注,ph均为5.7
±
0.2。
50.以下将结合具体实施例对本发明做进一步的解释说明。
51.实施例1:复合培养基对鼠李糖乳杆菌耐酸特性的影响
52.用1mol/l盐酸、0.4%氢氧化钠溶液调节mrs液体培养基、复合培养基为不同ph值梯度,分别为2.0、3.0、4.0、5.0、6.0、6.4。向以上ph条件下的mrs培养基、复合培养基中按照2%接种量分别接种浓度为3
×
108cfu/ml的鼠李糖乳杆菌,每组做3个平行,37℃、125rpm培养14h后取样,通过梯度稀释平板计数法计算活菌数。
53.mrs培养基组成为(g/l):蛋白胨10.0,牛肉粉8.0,酵母粉4.0,葡萄糖20.0,磷酸氢二钾2.0,柠檬酸氢二铵2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温80 1.0,其余为无菌水;
54.复合培养基组成为(g/l):蛋白胨10.0,牛肉粉8.0,酵母粉4.0,葡萄糖20.0,磷酸氢二钾2.0,柠檬酸氢二铵2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温80 1.0,160目中华
麦饭石粉末50,其余为75%矿化水;
55.矿化水的制备:中华麦饭石打粉过80目筛,得麦饭石粉末;过筛后的麦饭石粉末取30g,加入300ml去离子水,37℃、125rpm浸泡24h,得麦饭石矿化水悬浊液,减压抽滤后过0.45μm滤膜,得麦饭石矿化水,将矿化水和无菌水按75:25复配得75%矿化水。
56.结果如图1所示,在2≤ph≤5时,益生菌在复合培养基发酵体系中生长情况明显优于普通发酵体系。可说明在中强酸性环境下,复合培养基发酵体系可显著提高益生菌的耐酸特性。
57.实施例2:复合培养基对益生菌耐胆盐特性的影响
58.在mrs液体培养基、复合培养基(同实施例1)中分别加入猪胆盐,使其浓度分别为0%(对照)、0.05%、0.1%、0.15%、0.2%、0.3%。向以上胆盐浓度条件下的mrs培养基、复合培养基中按照2%接种量分别接种浓度为3
×
108cfu/ml鼠李糖乳杆菌,每组做3个平行,37℃、125rpm培养14h后取样,通过梯度稀释平板计数法计算活菌数。
59.结果如图2所示,在0.1-0.15%胆盐浓度时,益生菌在复合培养基发酵体系中生长情况明显优于普通发酵体系,说明在此浓度胆盐下复合培养基发酵体系可显著提高益生菌的耐胆盐特性。
60.实施例3:复合培养基对益生菌抗人工肠液特性的影响
61.人工肠液的配制:称取磷酸二氢钾0.68g,加水50ml溶解,用0.4%的氢氧化钠溶液调ph值至6.8,另取胰蛋白酶1g,加适量水溶解,两液合并后加水定容至100ml,用0.45μm无菌滤膜过滤。
62.取6ml人工肠液于10ml离心管中,将mrs环境下生长的益生菌发酵液、复合培养基(mrs培养基、复合培养基同实施例1)环境生长的益生菌发酵液(按照2%接种量分别接种浓度为3
×
108cfu/ml的鼠李糖乳杆菌,37℃、125rpm培养14h后)分别接种2ml于人工肠液中,每组做3个平行,37℃,125rpm摇床培养,分别在0、1、2、4、16h取样,通过梯度稀释平板计数法计算活菌数。
63.结果如图3所示,在食物停留在人体肠道内的时长内,在同一梯度稀释下,复合培养基环境生长的益生菌平板菌落数量明显多于mrs环境,说明复合发酵体系能明显提高益生菌在人工肠液中的存活能力。
64.实施例4:发酵产物对大鼠病理状态的影响
65.1、药液制备
66.发酵组:以80目中华麦饭石制备的75%矿化水配置mrs培养基,再按照5g/100ml的比例向培养基中添加160目中华麦饭石粉末制备发酵组培养基(制备方法同实施例1复合培养基);
67.接种鼠李糖乳杆菌后37℃、125rpm培养14h,发酵后取样进行涂布计数,根据计数结果将发酵液稀释为108cfu/ml,作为发酵药液。
68.益生菌组:以mrs培养基(组成同实施例1)接种鼠李糖乳杆菌37℃、125rpm培养14h后取样进行涂布计数,根据计数结果将发酵液稀释为108cfu/ml,作为益生菌药液。
69.2、病理形态观察
70.将50只雄性sd大鼠(200
±
20g)置于25
±
2℃、12h/12h光暗循环、60%相对湿度的条件下,自由饮食饮水3天使其适应环境。随后分为5组(空白组、模型组、自然恢复组、发酵
组、益生菌组。除非特别说明,各组持续自由饮食饮水,直至处死前24h禁食禁水),其中:
71.空白组:一直灌胃生理盐水(2ml/200g);
72.其余各组:灌胃三联抗生素(2ml/200g),连续灌胃5天(灌胃开始计为day1)以诱导大鼠腹泻。此后:
73.模型组:禁食禁水24h,腹腔注射20%乌拉坦(2ml/200g)以麻醉大鼠,快速解剖结肠,一部分浸泡在10%福尔马林中4℃储存,另一部分置于-80℃储存;
74.自然恢复组:每天灌胃生理盐水(2ml/200g);
75.益生菌组、发酵组:分别灌胃对应药液(2ml/200g),连续灌胃5天并每天收集粪便,之后将五组大鼠麻醉,解剖结肠。
76.粪便样品收集后称重,经快速水分测定仪105℃干燥后称干重。粪便含水量=(湿重-干重)/湿重
×
100%。
77.各组大鼠活动状态良好,饮食程度相当,经抗生素造模后大鼠皮毛松耸、拱背及排稀便等现象,可认为造模有效。给药过程中,各给药组大鼠体重均逐步增长,如图4a所示,在给药后第3天各给药组体重增长率均超过自然恢复组,发酵组体重增加最为显著;如图4b所示,仅给药后发酵组大鼠粪便含水量稳步降低,说明发酵组药液能改善大鼠腹泻情况,缓解大鼠病症。
78.实施例5:发酵产物对大鼠肠道炎症的影响
79.将实施例4的实验鼠完成实验后取同位置结肠冷冻切片,进行h&e染色,并根据染色结果进行病理学观察。
80.如图5所示,正常组大鼠结肠粘膜结构正常,上皮细胞完整,杯状细胞排列整齐,细胞层次清楚。模型组大鼠结肠有明显水肿,上皮细胞缺失、糜烂,杯状细胞缺失,腺体密度降低,黏膜固有层有大量炎症细胞浸润。自然恢复组大鼠结肠仍然可见明显水肿,存在杯状细胞破碎,溃疡和炎性细胞浸润等现象;益生菌组大鼠结肠无水肿现象,但仍可见杯状细胞破碎及炎性细胞浸润;发酵组大鼠结肠无水肿现象,上皮细胞排列整齐,腺体正常,虽仍有少量炎性细胞,但整体形态与正常大鼠相似。
81.实施例6:发酵产物对大鼠肠道炎性因子的影响。
82.tlr4和nf-κb与肠组织炎症有较大的相关性,nf-κb参与促炎因子的释放和肠黏膜损伤的修复;tlr4可激活nf-κb信号通路,使炎症信号持续放大。
83.取实施例4的实验鼠同位置结肠组织8cm,用冰冷pbs缓冲液反复冲洗去血水及粪渣,吸干称重,按比例加入9倍冰冷pbs,冰浴下用组织匀浆器研磨成10%的组织匀浆液,2500~3000r/min离心15min,上清液待测。根据tlr4、nf-κb试剂盒(酶联免疫分析法)说明书进行操作,根据试剂盒提供的标准品制作标准曲线。通过与标准曲线比对计算得出肠组织中tlr4、nf-κb的含量。
84.如图6所示,根据试剂盒说明书操作得到tlr4、nf-κb的标准曲线分别为y=10.819x+0.2073和y=7.8713x-0.6943,标准曲线r2均大于0.99,标准曲线有效。各给药组tlr4、nf-κb的含量均小于自然恢复组,特别是发酵组趋近于空白对照组,说明经给药后大鼠结肠中tlr4、nf-κb的水平下降,炎症情况有所缓解,证明药物有效性。各给药组相比,仅发酵组与模型组结果间具有显著性差异,其余两组与模型组结果差异不显著,证明发酵组效果更优。
85.实施例7:发酵产物对大鼠肠道菌群的影响。
86.以总细菌为内参基因,拟杆菌(bacteroid)、粪肠球菌(enterococcus)、大肠杆菌(escherichia coli)、乳杆菌(lactobacillus)4种肠道菌为指标,上述4种肠道菌为肠道菌群中的关键菌株,常被用于肠道菌群的分析。其中大肠杆菌为常见的条件致病菌,其丰度过高可能会引起肠道疾病的发生;粪肠球菌可在肠道上皮细胞上形成生物膜,保护肠上皮细胞免受有害物质侵袭,但在长期进化中可出现毒力基因,引起广泛的感染;乳杆菌为常见的益生菌,可分泌多种酶类,参与营养物质的代谢和维持肠道菌群稳态的功能;拟杆菌是肠道菌群中的常见优势菌,约占到肠道菌群总数的1/4,其在一定条件下可转化为条件致病菌,但其也参与肠道的正常代谢功能。
87.分别称取实施例4各组实验鼠day10的0.20g粪便样品至2ml无菌ep管中,参照dna提取试剂盒说明书步骤进行粪便总dna的提取。提取产物用核酸蛋白检测仪测定其浓度与纯度。采用10μl的pcr反应体系,包括荧光染料sybr green 5μl,dna模板0.6μl,上下游引物各0.2μl,rox 1μl,双蒸水3μl。荧光定量pcr反应条件:95℃变性30s,95℃5s,60℃1min共40个循环,72℃延伸10min后结束。每次实验均设立阴性对照。为了检测pcr产物的特异性,在进行定量pcr时设置从60℃逐渐升温至95℃(每个循环0.5℃),每次循环过程末期检测sybr green信号,绘制熔解曲线。每个样品重复3次。
88.表1:各细菌扩增引物序列
[0089][0090][0091]
各组特征基因表达倍数为该组基因qpcr的ct值与正常组的比值(虚线为正常空白组,视为1),其比值趋近于1时为该组基因的对应菌丰度接近正常空白组,大于或小于1分别表示为菌丰度升高或降低。
[0092]
如图7所示,与正常空白组相比(各组特征基因表达倍数为该组基因qpcr的ct值与正常组的比值,其比值趋近于1时为该组基因的对应菌丰度接近正常组,大于或小于1分别表示为菌丰度升高或降低),模型组大鼠粪肠球菌、大肠杆菌数量明显增加,拟杆菌、乳杆菌数量明显降低,说明本次实验大鼠造模成功,相应肠道菌均有负面的变化。与自然恢复组相
比,各给药组特别是发酵组大鼠拟杆菌、乳杆菌数量略有增加,粪肠球菌、大肠杆菌含量有一定程度的减少,说明经给药后大鼠肠道中肠道菌群中的关键菌株有一定调节变化,显示出菌群结构恢复正常的趋势。
[0093]
前文的描述和图表包括例证的本发明实施方案。前述实施方案和方法基于本领域技术人员的能力、经验和优选性可以变化。以一定顺序列出的方法步骤并非限制本发明方法步骤的顺序。前文的描述和图表仅是解释和例证了本发明,除了权利要求书范围内的限制之外,本发明非限于这种限制。本领域技术人员在不偏离本发明范围的前提下可以对本发明进行修改和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1