一种可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物及其制备方法
本发明属于高分子化学与蛋白质工程技术领域,具体涉及一种可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物及其制备方法。
背景技术:
随着全球范围内食物过敏的发病率持续上升,食物过敏已成为21世纪人们日益关注的食品安全问题之一。据资料显示,世界范围内对各种食物过敏的人群在成年人中约占5%,在儿童中约占8%。根据国际食品法典委员会(cac)的数据显示,花生、牛奶、大豆、鸡蛋、坚果、鱼类、贝类和小麦这八种常见食物是90%的食物过敏的过敏原。其中,小麦是世界主要的粮食作物,是人类日常饮食中最重要的组成部分,但也是8种主要的食物过敏原之一,这主要是由于小麦中含有能诱发过敏反应的变应蛋白。在诸多小麦变应蛋白中,因醇溶蛋白富含脯氨酸残基和谷氨酰胺残基的组成的肽基重复序列,存在可与免疫球蛋白e(ige)结合的表位抗原,其可引发小麦过敏患者发生局部或全身性的免疫反应,如荨麻疹和小麦过敏(wa),贝克哮喘和小麦依赖运动诱发过敏反应(wdeia),因此醇溶蛋白是小麦蛋白中的主要过敏原。为了让更多的小麦过敏患者可以食用小麦产品,最有效的办法就是将小麦中的主要过敏原——醇溶蛋白最大限度的分离。因此,建立一种低成本、高效率获得高纯度小麦醇溶蛋白的分离手段,对小麦醇溶蛋白的应用以及过敏机理的研究具有重要意义。蛋白质分离方法主要是依据蛋白质分子量的大小、带电荷量、溶解度、亲水性等一些特殊的差异进行分离。而目前可用于小麦醇溶蛋白的分离手段主要有:层析法、沉淀法、色谱法和电泳法。其中,层析法和沉淀法简便易操作,但在分离过程中受蛋白浓度、溶液ph值及温度影响很大,导致分离得到的蛋白纯度低。而色谱法和电泳法目前分离效果较好,但仪器设备操作复杂,分离成本较高;且在分离过程中,很难保持蛋白的活性。此外,这些常规的蛋白质分离方法,共同存在的缺点还在于不能对蛋白质进行特异性的分离。目前,功能化的磁性材料具有优良的超顺磁性、生物兼容性及较大的结合容量等性能,已经被广泛用于蛋白、肽段以及小分子活性物质等分离富集。能否基于功能化材料提供一种对于醇溶蛋白具有高吸附量和吸附特异性的吸附材料是解决上述问题的一个有效思路。
技术实现要素:
本发明的目的是提供一种具有特异性吸附麦醇溶蛋白能力的磁性分子印迹聚合物及其制备方法。该聚合物对于麦醇溶蛋白的吸附饱和时间短、吸附量高、吸附特异性强,可实现在蛋白质混合溶液中对目标蛋白
‑‑
小麦醇溶蛋白的高效特异性吸附,为蛋白质的分离纯化及应用奠定良好的基础。为解决上述技术问题,本发明采用的技术方案如下:一种可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物,通过下法制备获得:先在
fe3o4磁性微球表面包裹二氧化硅,得到fe3o4@sio2磁性微球;然后对二氧化硅壳层进行修饰,得到双键功能化的fe3o4@sio
2-c=c磁性微球;之后在fe3o4@sio
2-c=c磁性微球外制备印迹层并去除印迹层中的模板分子即得所述可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物。制备所述印迹层时,以小麦醇溶蛋白为模板分子,以甲基丙烯酸、n-异丙基丙烯酰胺为功能单体,以fe3o4@sio
2-c=c磁性微球为磁性支撑材料,n,n-亚甲基双丙烯酰胺为交联剂,最后在引发体系过硫酸铵(aps)和四甲基乙二胺(temed)的作用下,于常温进行自由基聚合反应。进一步,小麦醇溶蛋白:甲基丙烯酸:n-异丙基丙烯酰胺:n,n-亚甲基双丙烯酰胺:fe3o4@sio
2-c=c的用量比为3-6:3-6:8-16:3-6:10-30,引发剂采用aps与temed的体积比为1:1-2.5的混合物。所述aps加入时可采用质量体积浓度为10%的溶液加入。具体的,先将小麦醇溶蛋白和maa、nipam加入到pbs缓冲液中于室温下进行预聚合;预聚合1-2h后,加入fe3o4@sio
2-c=c磁性微球和mba,将反应体系振荡混匀,再加入aps和temed于室温下水浴振荡反应。上述蛋白印迹合成方法是表面接枝共聚法,所采用的引发聚合体系是氧化还原引发。该法最大的优点在于功能单体可以在常温下对蛋白进行捕获,避免蛋白在印迹过程中因高温而发生构象转变,影响印迹效率。具体的说,所述制备小麦醇溶蛋白磁性分子印迹聚合物,包括以下步骤:1)采用水热合成法合成fe3o4磁性微球;2)利用溶胶-凝胶法在步骤1)得到的fe3o4磁性微球表面包裹二氧化硅,得到fe3o4@sio2磁性微球;3)采用乙烯基三乙氧基硅烷(kh-151)对步骤2)得到的二氧化硅壳层进行修饰,得到fe3o4@sio
2-c=c磁性微球。4)以小麦醇溶蛋白(gliadin)为模板分子,甲基丙烯酸(maa)、n-异丙基丙烯酰胺(nipam)为功能单体,fe3o4@sio
2-c=c微球为磁性支撑材料,n,n-亚甲基双丙烯酰胺(mba)为交联剂,最后在引发体系过硫酸铵(aps)和四甲基乙二胺(temed)的作用下,于常温进行自由基聚合反应。5)将步骤4)得到的聚合产物进行洗脱,在30-35℃下去除印迹层中的模板分子,得到小麦醇溶蛋白磁性分子印迹聚合物(fe3o4@sio2@mips)。进一步,步骤1)制备fe3o4磁性微球:将fecl3·
6h2o溶于乙二醇并磁力搅拌至完全溶解后,加入无水醋酸钠和聚乙二醇2000,充分搅拌后,将混合液移至水热反应釜中,置于鼓风干燥箱中于190-210℃下加热8-12h,取出反应釜,冷却10-12h;从反应釜中倒出反应所得的磁球,并用乙醇和蒸馏水充分洗涤,40-60℃下真空干燥,得到fe3o4磁性微球。所述步骤(1)中,六水合氯化铁:无水乙酸钠:聚乙二醇2000:乙二醇的用量比为(3-4)g:(3-8)g:(0-2)g:(60-80)ml。反应釜加热温度优选为205℃,加热时间优选为10h。步骤2)制备fe3o4@sio2磁性微球:将步骤1)得到的fe3o4磁性微球分散于乙醇-水溶
剂中,超声分散后,加入氨水,升温至30℃,在150r/min的转速下,逐滴加入teos溶液,之后继续反应6h,反应结束用乙醇和蒸馏水充分洗涤,40-60℃下真空干燥,得到fe3o4@sio2磁性微球。teos用量以3-6gfe3o4磁性微球加入10-20ml teos计。本步骤中,混合溶液中乙醇:蒸馏水:氨水的体积按照160ml:40ml:5ml计,氨水的质量浓度为25-28%。步骤3)fe3o4@sio2磁性微球的双键功能化:将fe3o4@sio2磁性微球充分分散于乙醇-水溶剂中,然后加入氨水,之后逐滴加入kh-151溶液,于室温下反应20-24h,反应结束分离,用乙醇和蒸馏水充分洗涤,40-60℃下真空干燥得到fe3o4@sio
2-c=c;kh-151的用量以3-6g fe3o4@sio2磁性微球加入2-4ml kh-151计。乙醇:蒸馏水:氨水的体积比为30:10:1,氨水的质量浓度为25-28%。步骤4):将小麦醇溶蛋白和maa、nipam加入到pbs缓冲液中,于室温下进行预聚合;预聚合完成后,加入fe3o4@sio
2-c=c磁性微球和mba,将反应体系振荡混匀,加入aps和temed于室温下(30℃)水浴振荡反应24h,反应结束后,倾去反应液,用蒸馏水反复振荡洗涤、磁性分离。pbs缓冲液的浓度优选为0.02mol/l,ph=7.2。步骤5):用含sds(1%左右,w/v)和乙酸(10%左右,v/v)的混合溶液振荡洗脱,以除去印迹层中的模板分子,即得小麦醇溶蛋白磁性分子印迹聚合物(fe3o4@sio2@mips)。可以按照1gsds与10ml乙酸、88-90ml蒸馏水的用量配制混合溶液。本发明制备的磁性分子印迹聚合物具有超顺磁性,可实现溶液中快速的磁性分离;该聚合物的印迹层厚度为10nm,薄且均匀,达到吸附平衡时间仅需60min。对于分子质量较大的小麦醇溶蛋白的饱和吸附量可达到73.55mg/g,印迹因子可达3.10,表现出了印迹聚合物对模板蛋白的高吸附量和吸附特异性。在特异性识别、吸附、分离麦醇溶蛋白中有很好的应用。本发明与现有技术相比,具有如下优点:本发明选用水热合成法合成fe3o4磁性微球,操作简单,绿色环保,反应产率高;加入醋酸钠用于提供静电作用力来稳定形成的纳米颗粒防止团聚;并利用聚乙二醇(peg)实现表面修饰以保证磁球获得较好的单分散性。fe3o4磁性微球表面功能基团种类单一、易被氧化,不利于分子印迹聚合物的合成。本发明在fe3o4磁性微球表面包覆选定的sio2壳层,具有良好的生物相容性及亲水性,且能抑制fe3o4内核被氧化或被酸性物质刻蚀。又在sio2壳层表面修饰不同种类的功能基团,以提高分子印迹聚合物对模板蛋白的识别和吸附能力。最终获得的磁性分子印迹聚合物对于麦醇溶蛋白吸附饱和时间短、吸附量高、吸附特异性强。
附图说明
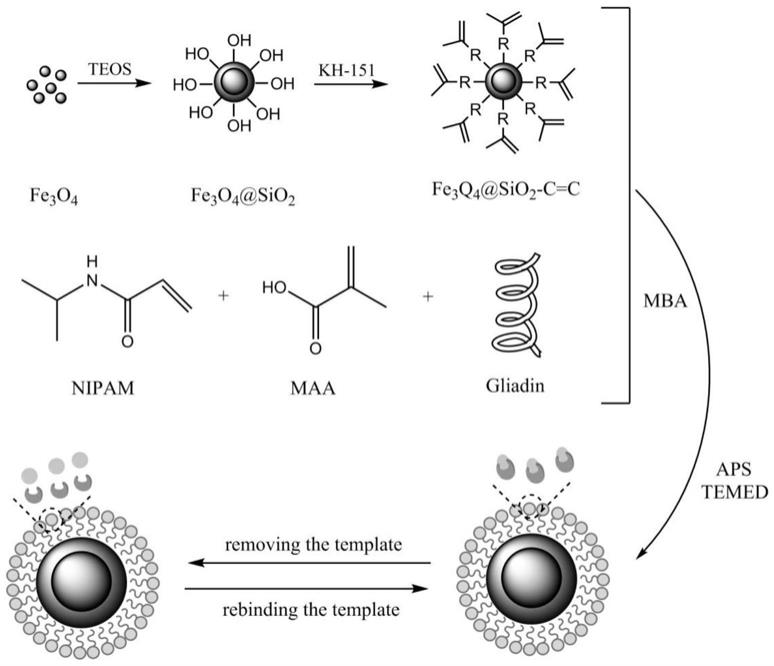
图1为可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物的制备过程示意图;图2为fe3o4(a,b)和fe3o4@sio2(c,d)磁性微球的扫描电镜图;图3为fe3o4、fe3o4@sio2和fe3o4@sio2@mips磁性微球的透射电镜图;图4为fe3o4(对应a)、fe3o4@sio2(对应b)、fe3o4@sio
2-c=c(对应c)、fe3o4@sio2@nips(对应d)和fe3o4@sio2@mips(对应e)磁性微球的红外光谱图;
图5为fe3o4(对应a)、fe3o4@sio2(对应b)、fe3o4@sio
2-c=c(对应c)、fe3o4@sio2@nips(对应d)和fe3o4@sio2@mips(对应e)的磁滞回线图;图6为fe3o4@sio2@mips在实际应用中的磁分离效果示意图;图7为fe3o4(对应a)、fe3o4@sio2(对应b)、fe3o4@sio
2-c=c(对应c)、fe3o4@sio2@nips(对应d)和fe3o4@sio2@mips(对应e)磁性微球的xrd衍射图;图8为fe3o4(对应a)、fe3o4@sio2(对应b)、fe3o4@sio
2-c=c(对应c)、fe3o4@sio2@nips(对应d)和fe3o4@sio2@mips(对应e)磁性微球的热重分析图;图9为fe3o4@sio2@mips和fe3o4@sio2@nips的吸附动力学曲线图;图10为fe3o4@sio2@mips和fe3o4@sio2@nips的等温吸附线曲线图;图11为fe3o4@sio2@mips和fe3o4@sio2@nips在不同蛋白溶液中的吸附性能对比图;图12为fe3o4@sio2@mips和fe3o4@sio2@nips对醇溶蛋白吸附分离的实际应用;其中,a为谷朊粉上清液色谱图,b为谷朊粉上清液经过mips吸附分离后的色谱图,c为mips洗脱后的上清液色谱图。
具体实施方式
以下以具体实施例来说明本发明的技术方案,但本发明的保护范围不限于此:实施例1可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物,制备方法如下:1)制备fe3o4磁性微球称取2.70g的fecl3·
6h2o溶于80ml乙二醇中,磁力搅拌至完全溶解后,加入3.6g的无水醋酸钠和2.0g聚乙二醇2000,充分搅拌后,将混合液移至水热反应釜中,置于鼓风干燥箱中于205℃下加热10h,取出反应釜,冷却12h;从反应釜中倒出反应所得的产物,并用乙醇和蒸馏水重复洗涤5次,50℃下真空干燥12h,得到fe3o4磁性微球。2)制备fe3o4@sio2磁性核壳微球取步骤1)得到的fe3o4磁性微球300mg分散于100ml乙醇-水(4/1,v/v)溶剂中,超声分散后加入2.5ml的浓氨水,升温至30℃,在150r/min的转速下,逐滴加入1ml的teos(正硅酸乙酯)溶液,之后继续反应6h,反应结束用乙醇和蒸馏水重复洗涤5次,50℃下真空干燥12h,得到fe3o4@sio2磁性微球。3)制备fe3o4@sio
2-c=c磁性微球将步骤2)得到的fe3o4@sio2磁性微球300mg分散于100ml乙醇-水(3/1,v/v)溶剂中,超声分散后,加入2.5ml的浓氨水,然后在150r/min的转速下,逐滴加入0.2ml的kh-151溶液,之后在室温下继续反应24h,反应结束用乙醇和蒸馏水充分洗涤,50℃下真空干燥12h,得到产物fe3o4@sio
2-c=c。4)fe3o4@sio2@mips印迹聚合物的制备将30mg小麦醇溶蛋白、34.4μl maa(甲基丙烯酸)和101.7mg nipam(n-异丙基丙烯酰胺)溶解在30ml pbs缓冲液(0.02mol/l,ph=7.2)中,于室温下进行预聚合1h后加入30.8mg mba和100mg fe3o4@sio
2-c=c磁性微球,将反应体系振荡混匀,加入100μl aps(10%,w/v)溶液和10μl temed溶液于30℃下水浴振荡反应24h,反应结束后,倾去反应液,用蒸馏水反复振荡洗涤、磁性分离。然后用含sds(1%,w/v)和乙酸(10%,v/v)的混合溶液振荡洗脱,以除去印迹层中的模板分子,得小麦醇溶蛋白磁性分子印迹聚合物(fe3o4@sio2@
mips)。本发明小麦醇溶蛋白磁性分子印迹聚合物(fe3o4@sio2@mips)的制备流程具体可参照图1。对比例1非印迹聚合物(fe3o4@sio2@nips)的制备:除了步骤4)中不加模板分子小麦醇溶蛋白,其他步骤皆同实施例1。实施例2可特异性吸附麦醇溶蛋白的磁性分子印迹聚合物,制备方法如下:1)制备fe3o4磁性微球称取2.70g的fecl3·
6h2o溶溶于80ml乙二醇中,磁力搅拌至完全溶解后,加入5.4g的无水醋酸钠和1.5g聚乙二醇2000,充分搅拌后,将混合液移至水热反应釜中,置于鼓风干燥箱中于205℃下加热10h,取出反应釜,冷却12h;从反应釜中倒出反应所得的产物,并用乙醇和蒸馏水重复洗涤5次,50℃下真空干燥12h,得到fe3o4磁性微球。2)制备fe3o4@sio2磁性核壳微球取步骤1)得到的fe3o4磁性微球300mg分散于100ml乙醇-水(4/1,v/v)溶剂中,超声分散后加入2.5ml的浓氨水,升温至30℃,在150r/min的转速下,逐滴加入1ml的teos(正硅酸乙酯)溶液,之后继续反应6h,反应结束用乙醇和蒸馏水重复洗涤5次,50℃下真空干燥12h,得到fe3o4@sio2磁性微球。3)制备fe3o4@sio
2-c=c磁性微球将步骤2)得到的fe3o4@sio2磁性微球300mg分散于100ml乙醇-水(3/1,v/v)溶剂中,超声分散后,加入2.5ml的浓氨水,然后在150r/min的转速下,逐滴加入0.2ml的kh-151溶液,之后在室温下继续反应24h,反应结束用乙醇和蒸馏水充分洗涤,50℃下真空干燥12h,得到的产物fe3o4@sio
2-c=c。4)fe3o4@sio2@mips印迹聚合物的制备将40mg小麦醇溶蛋白、48.2μl maa(甲基丙烯酸)和142.4mg nipam(n-异丙基丙烯酰胺)溶解在40ml pbs缓冲液(0.02mol/l,ph=7.0)中,于室温下进行预聚合1h后加入43.2mg mba和150mg fe3o4@sio
2-c=c磁性微球,将反应体系振荡混匀,加入100μl aps(10%,w/v)溶液和20μl temed溶液于30℃下水浴振荡反应24h,反应结束后,倾去反应液,用蒸馏水反复振荡洗涤、磁性分离。然后用含sds(1%,w/v)和乙酸(10%,v/v)的混合溶液振荡洗脱,以除去印迹层中的模板分子,得小麦醇溶蛋白磁性分子印迹聚合物(fe3o4@sio2@mips)。本发明小麦醇溶蛋白磁性分子印迹聚合物(fe3o4@sio2@mips)的制备流程具体可参照图1。对比例2非印迹聚合物(fe3o4@sio2@nips)的制备:除了步骤4)中不加模板分子小麦醇溶蛋白,其他步骤皆同实施例2。为验证分子印迹聚合物(mips)的成功制备,本发明通过扫描电镜(sem)、透射电镜(tem)、红外光谱(ft-ir)、x-射线衍射(xrd)、热重分析(tga)和振动样品磁力计(vsm)等一系列表征,对印迹聚合物进行了形貌、结构、热稳定性以及磁化强度等多维度的表征。在识
别与分离小麦醇溶蛋白的性能评价及应用时,包括以下手段:通过吸附动力学,吸附等温线,吸附选择性试验以及在实际样品中的吸附分离应用,对印迹聚合物的吸附特异性、吸附容量以及实际环境中的吸附性能进行了表征。磁性微球的小麦醇溶蛋白吸附性能磁性微球对小麦醇溶蛋白的吸附量q(mg/g)采用(2-1)式进行计算:q=(c
0-c)vm-1
ꢀꢀꢀ
(2-1)其中,c0为麦醇溶蛋白原溶液的浓度(mg/ml),c为吸附后上清液中麦醇溶蛋白的浓度(mg/ml),v为麦醇溶蛋白原溶液的体积(ml),m为印迹微球的质量(g)。印迹因子(if)和选择性因子(β)通常被用来衡量一种印迹材料的识别选择性能。其计算公式如下:q
mip
——印迹微球对蛋白的吸附量(mg/g)q
nip
——非印迹微球对蛋白的吸附量(mg/g)if
tem
——印迹微球对模板蛋白的印迹因子if
com
——印迹微球对竞争蛋白的印迹因子吸附动力学及模型分析:具体地,向10ml的离心管中,加入mips(10mg)和麦醇溶蛋白溶液(0.6mg/ml,5ml),然后置于恒温振荡器于30℃下震荡不同的时间:0、10、20、30、60、90、120、180min。实验结束后,进行磁性分离,采用hplc检测上清液中小麦醇溶蛋白的浓度。nips的吸附动力学实验在相同条件下进行。其吸附量q根据公式(2-1)计算。为了研究mips和nips在小麦醇溶蛋白的pbs缓冲溶液中的动力学机制,通过一级动力学方程和二级动力学方程对动力学曲线进行拟合,其方程如下:一级动力学:二级动力学:q
t
、qe——分别为t时刻和平衡状态下的吸附量,mg/g;k1为一级动力学方程吸附速率常数,min-1
;k2为二级动力学方程吸附速率常数,(g/(mg/min));吸附等温线及模型分析具体地,向25ml的离心管中,加入mips(10mg)和麦醇溶蛋白溶液(5ml),麦醇溶蛋白的浓度为0.2-2mg/ml,然后置于恒温振荡器中于30℃下震荡60min。实验结束后,进行磁性分离,采用hplc检测上清液中麦醇溶蛋白的浓度。nips的吸附动力学实验在相同条件下进行。其吸附量q根据公式(2-1)计算。通过langmuir方程和freundlich方程进行拟合来研究印迹微球的吸附行为,其方程如下:langmuir方程:qe=kq
mce
/(1+kce)
ꢀꢀꢀ
(4-1)freundlich方程:
qe、qm为各浓度下吸附平衡时的吸附量和理论的最大吸附量,mg/g;
84.1/n为异质因子;
85.ce为平衡时溶质的质量浓度,mg/ml;
86.k、kf一分别为langmuir,freundlich方程的平衡吸附常数。吸附选择性实验:选择性吸附实验主要考察的是mips/nips对模板蛋白的选择性识别能力。本实验选用了牛血清白蛋白(bsa)、卵清蛋白(ova)和溶菌酶(lys)三种蛋白作为参比蛋白来研究mips/nips对模板蛋白的选择吸附性能。具体地,分别准确称取4份10mg mips以及nips置于25ml的离心管,分别向各管中加入5ml浓度为0.6mg/ml的麦醇溶蛋白、bsa、ova、lys溶液,然后置于恒温振荡器中于30℃下震荡60min。实验结束后,进行磁性分离,采用hplc分别检测上清液中四种蛋白的浓度。其吸附量q根据公式(2-1)计算。印迹因子if根据公式(2-2)计算。实际样品中麦醇溶蛋白的吸附试验:为了考察mips纳米颗粒对实际样品中麦醇溶蛋白的选择性吸附性能,选用谷朊粉作为实际样品,并使用hplc进行分析,通过对比吸附前后对应峰面积的变化,可以定量反映出mips的特异性吸附能力。具体地,选用商业谷朊粉,将谷朊粉溶解于pbs缓冲液中,制备成2mg/ml的溶液,然后在4000r/min下离心15min,取上清液作为吸附液备用。称取10mgmips,加入处理好的谷朊粉吸附液5ml,置于恒温振荡器中于30℃下震荡60min。然后磁分离,取上清液进行hplc定量分析。具体的色谱条件为:色谱柱采用东曹(tosoh,japan)的tskgel g4000sw
xl
凝胶色谱柱,流动相为水:乙腈:三氟乙酸=80:20:0.1(v/v/v),紫外检测波长为280nm,流速为0.5ml/min,进样量为20μl,柱温为30℃。1、扫描电镜表征实施例1获得的fe3o4和fe3o4@sio2的扫描电镜如图2所示。图a、b为水热合成法制备的磁性fe3o4纳米颗粒,该颗粒表面粗糙,分散性较好,粒径较为均一。图c、d为溶胶-凝胶法制备的fe3o4@sio2纳米颗粒,包裹sio2的磁性fe3o4纳米颗粒表面由粗糙变为光滑,粒径较fe3o4纳米颗粒增大,说明在fe3o4表面成功进行了sio2壳层的包覆。2、透射电镜表征图3为fe3o4(对应a)、fe3o4@sio2(对应b)和fe3o4@sio2@mips(对应c、d)的透射电镜图。a中的磁性fe3o4纳米颗粒平均直径约为200nm左右,形貌呈椭圆至近似圆形,经过sio2壳层和mips壳层的包裹后,fe3o4@sio2和fe3o4@sio2@mips纳米颗粒都保持着良好的形貌和尺寸分布。c中心核是磁性fe3o4纳米颗粒,中间层是sio2壳层,最外面一层是mips壳层,sio2壳层的厚度在40nm左右,mip壳层的厚度在10nm左右。薄且均匀的mips壳层确保模板分子小麦醇溶蛋白不会完全被包裹在聚合物内部,并在对小麦醇溶蛋白的吸附过程中非常有利于质量传递。3、红外光谱分析:图4展示了fe3o4、fe3o4@sio2、fe3o4@sio
2-c=c、fe3o4@sio2@nips和fe3o4@sio2@mips的红外吸收光谱。曲线a中580cm-1
处的峰是fe-o基团的振动吸收峰,证明了内核的成功制备。在经过修饰之后,仍然可以观察到fe-o基团的特征峰,说明fe3o4内核保持良好。曲线b中
796、960、1090cm-1
分别si-o、si-o-h和si-o-si基团的伸缩振动特征吸收峰。这三个峰的存在表明sio2壳层成功包覆在fe3o4内核的表面。与曲线a和b相比,曲线c中2923、2852cm-1
处甲基和亚甲基特征峰的出现源于sio2壳层表面kh-151的修饰。曲线d和e中,2923、2852cm-1
处特征峰的进一步加强,这表明聚合物壳层成功的包裹。4、磁力学性质表征:图5为fe3o4、fe3o4@sio2、fe3o4@sio
2-c=c、fe3o4@sio2@nips和fe3o4@sio2@mips的磁滞回线。图中磁滞回线关于原点中心对称,当外加磁场强度为零时,磁化强度也为零,说明不存在剩磁和矫顽力现象,因此证明fe3o4、fe3o4@sio2、fe3o4@sio
2-c=c、fe3o4@sio2@nips和fe3o4@sio2@nips均为超顺磁性纳米颗粒。曲线a的饱和磁化强度高达70emu/g,从而表明通过溶剂热法制备的磁性内核具有非常强的磁响应特性。曲线b、c、d和e的饱和磁化强度分别为52.62、49.19、36.56、34.63emu/g,与曲线a相比,磁性有所降低,这是因为sio2壳层的包裹、c=c双键的修饰以及印迹层的包裹对内核fe3o4的磁性进行了部分的屏蔽,但是印迹微球的磁性仍然可以满足实际应用的快速分离。如图6所示,在外加磁场的作用下,实现印迹微球的磁性分离仅用15s就可以完成,说明制备的印迹微球具有足够的磁响应。5、x-射线衍射分析图7示出了fe3o4、fe3o4@sio2、fe3o4@sio
2-c=c、fe3o4@sio2@nips和fe3o4@sio2@mips的x-射线衍射图。曲线a的6个衍射峰为(220)、(311)、(400)、(422)、(511)和(440),其对应的2θ的分别为30.3
°
、35.5
°
、43.1
°
、53.4
°
、57.0
°
和62.6
°
,这与xrd数据库中fe3o4的标准pdf卡片(jcpds卡片,编号19-0629)一致。在包覆sio2和mips壳层后,纳米颗粒的衍射峰依旧保持着相同的峰位、峰形和峰宽,证明在包覆sio2和mips壳层过程中并没有影响fe3o4内核的晶体结构。6、热重分析:图8为fe3o4、fe3o4@sio2、fe3o4@sio
2-c=c、fe3o4@sio2@nips和fe3o4@sio2@mips的热重分析图。曲线a、b在加热过程中的质量损失均小于10wt%,这表明所制备的fe3o4、fe3o4@sio2具有良好的热稳定性。随着温度的进一步升高,所有曲线以不同的速率开始下降。曲线c与b对比,二者之间的质量损失差为2.4wt%,这也充分说明了硅烷偶联剂kh-151中c=c键被成功的接枝到了sio2壳层的表面。经计算,曲线d、e的无机物组份含量分别为82.1wt%和80.2wt%,相比无机物组份含量为91.5wt%的曲线b,质量损失差是非常显著的,这也证明了印迹壳层的成功制备。这个结果与图5磁滞回线中d和e所反映的磁化强度相互呼应。7、吸附动力学曲线fe3o4@sio2@mips和fe3o4@sio2@nips的吸附动力学曲线如图9所示。从mips的吸附曲线可以看出,在30min左右,吸附率达到了90%以上;从30-60min,吸附速率显著降低;在60min左右达到了吸附饱和。由此可知,mips的吸附动力学过程大致可以描述为三个阶段:第一阶段,吸附速率最大,这说明mips与模板蛋白的氨基和羧基相互作用形成了多重氢键,使得模板蛋白很快就吸附到了印迹层的表面;第二阶段,吸附速率明显减小,该阶段主要是由于模板蛋白与印迹位点相互匹配造成的,使得印迹层表面的模板蛋白向印迹层内部运动的速率下降,从而导致整体的吸附速率降低;第三阶段,吸附速率基本为零,这说明印迹聚合物(mips)的吸附基本达到了饱和状态。而从nips的吸附曲线上看,在吸附30min左右基本就达到了吸附饱和。nips吸附动力学过程相较mips而言,并没有印迹层内的印迹位点识别
模板蛋白的这一行为,所以也就不存在模板蛋白向nips印迹层内运动的现象,只存在单纯的非特异性吸附;因此,nips在吸附30min后,吸附量基本就不随时间变化。经计算得,mips的饱和吸附量为73.55mg/g,nips的饱和吸附量为23.45mg/g,印迹因子为3.10。这体现了mips对模板蛋白的特异性吸附,主要是由于mips印迹层中存在模板蛋白的印迹位点。8、吸附等温线:图10为fe3o4@sio2@mips和fe3o4@sio2@nips的吸附等温线。从mips和nips的吸附等温曲线曲线可以看出,当模板蛋白溶液的浓度低于0.6mg/ml时,吸附量随着溶液浓度的升高而增大,当溶液的浓度高于0.6mg/ml时,吸附量趋于平稳,此时mips、nips的吸附达到了饱和状态。从图8和图9可以得出,最佳的吸附条件为:蛋白溶液的浓度为0.6mg/ml,吸附时间为60min。9、吸附选择性图11展示了fe3o4@sio2@mips和fe3o4@sio2@nips在不同蛋白溶液中的吸附性能对比。此处,选择了ova(分子量为43kda,等电点为4.7)、bsa(分子量为66kda,等电点为4.9)、lys(分子量为4.4kda,等电点为10.8)三种蛋白作为gli(分子量为45kda附近,等电点为5.8)的参比蛋白。从图11可知,在三种参比蛋白中,mips对ova、bsa的吸附量较大,但低于对模板蛋白的吸附量,主要是因为在pbs缓冲液(ph=7.2)中,ova、bsa带负电,由于静电作用力,两种参比蛋白较易被吸附到带正电的印迹层表面;其中,ova与gli的等电点、分子量大小相接近,但mips对ova的吸附量及印迹因子均小于gli,这主要是因为印迹层中缺少与ova相匹配的印迹位点,这也说明了印迹层中的功能基团是影响吸附效果的一个重要影响因素;bsa与gli的等电点相近、分子量较大,但mips对bsa的吸附量及印迹因子均小于gli和ova,这主要是因为gli比bsa体积要小,所以印迹层的印迹空穴相对较小,导致bsa进入印迹层的阻力增大,这也说明了印迹层的空穴大小是影响吸附效果的另一个重要影响因素;mips对lys的吸附量最小,主要是因为在pbs缓冲液(ph=7.2)中,lys带正电,由于静电排斥作用,导致吸附量下降,由于lys体积远小于gli,所以印迹空穴对其几乎无影响,使得印迹因子仅为1.05。10、图12为fe3o4@sio2@mips和fe3o4@sio2@nips对醇溶蛋白吸附分离的实际应用;曲线a对应谷朊粉上清液色谱图,曲线b对应谷朊粉上清液经过mips吸附分离后的色谱图,曲线c对应mips洗脱后的上清液色谱图。由图可知,经mips吸附后的谷朊粉上清液中,麦醇溶蛋白的吸收峰明显降低,其余蛋白的吸收峰无明显变化,mips经过洗脱之后,可以观察到单一的麦醇溶蛋白吸收峰,这表明制备的mips对实际样品中的模板分子麦醇溶蛋白具有吸附特异性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1