一种具有显著抗光老化活性的羊栖菜多糖及其应用
1.本发明属于羊栖菜深加工领域,具体涉及一种具有显著抗光老化活性的羊栖菜多糖及其应用。
背景技术:
2.羊栖菜(sargassum fusiforme),又名鹿角菜、灯笼菜、玉海草等,隶属褐藻门,墨角藻目,马尾藻科,是一种大型经济药食两用类海藻。羊栖菜富含多糖、蛋白质、维生素、氨基酸、甘露醇等功能性成分,具有较高的开发和利用价值。多糖是羊栖菜中重要的活性成分之一。研究发现,羊栖菜多糖具有抗氧化、抗肿瘤、降血糖、降血脂、免疫调节、延缓衰老等多种功效,但羊栖菜多糖在抗光老化方面的研究与应用却鲜有报道。此外,羊栖菜多糖具有分子量大、水溶性差和不利于机体吸收等缺点,大大限制了其应用。因此,对羊栖菜多糖进行适度降解,可降低其分子量,提高其水溶性,拓宽其应用领域,有利于羊栖菜的进一步开发利用。
3.现有技术中,cn202110498160.3公开了一种羊栖菜多糖及寡糖的制备方法,该方法采用复合酶解的工艺制备羊栖菜多糖,制备效率高,成本低,但所得多糖分子量和活性均不明确。cn201810082292.6公开了一种低分子量羊栖菜多糖的制备方法,其将羊栖菜洗净、粉碎、过筛、回流脱脂、冷水浸提、醇沉、冷冻干燥、d101型大孔树脂脱色,再用三氟乙酸水解,该方法获得分子量均一、纯度较高的低分子量羊栖菜多糖,但是该方法制备步骤繁琐、耗时长,且制备过程用到了三氟乙酸,对环境不友好。cn201810038618.5公开了一种低分子量羊栖菜多糖的纯化方法,该方法将含有不同分子量的羊栖菜多糖溶液,通过截留分子量分别为10kda、5kda、1kda且依次串联连接的超滤系统,获得对应分子量区间的低分子量羊栖菜多糖,但同样所得多糖活性不明确,应用价值有限。季德胜的硕士论文《羊栖菜多糖分离纯化、结构鉴定及拮抗uvb辐射造成的皮肤光老化损伤研究》探讨了羊栖菜多糖对皮肤光老化氧化损伤的拮抗作用,但所制备多糖分子量大、不利于机体吸收利用,限制了其应用,且其主要是通过降低氧化损伤来发挥抗光老化活性,功效对比阳性对照(透明质酸)不显著。
技术实现要素:
4.为了克服现有技术存在的不足,本发明的目的是提供一种具有显著抗光老化活性的羊栖菜多糖及其应用。
5.本发明采用热水浸提、超声辅助提取、微波辅助提取、酶法提取、酸法提取和碱法提取中的一种或几种方法获得分子量为250-320kda,糖醛酸含量为4-12wt%,还原糖含量为1-2wt%的羊栖菜粗多糖;结合uv/h2o2的进一步处理制备分子量为28-130kda,糖醛酸含量为21-33wt%,还原糖含量为2-7wt%,单糖组成为岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸,且岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸的摩尔比为(39~46):(16~17):(2~3):(4~5):(10~16):(20-22)的羊栖菜降解多糖,降低多糖分子
量,提高多糖抗光老化活性。该制备方法简单高效、条件温和、绿色无污染,能提高羊栖菜的深加工技术,拓宽羊栖菜的应用范围,具有良好的应用前景。
6.本发明的目的至少通过如下技术方案之一实现。
7.一种具有显著抗光老化活性的羊栖菜多糖,所述羊栖菜多糖的分子量为28-130kda,糖醛酸含量为21-33wt%,还原糖含量为2-7wt%,单糖组成为岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸,且岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸的摩尔比为(39~46):(16~17):(2~3):(4~5):(10~16):(20-22),具有显著抗光老化活性。
8.优选的,所述羊栖菜多糖的分子量为29.21-57.14kda,糖醛酸含量为21-32wt%,还原糖含量为5-7wt%,单糖组成为岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸,且岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸的摩尔比为(43~46):(16~17):(2~3):(4~5):(10~12):(21-22)。
9.优选的,所述羊栖菜多糖的分子量为57.14kda,糖醛酸含量为29.88
±
1.83wt%,还原糖含量为5.66
±
0.48wt%,单糖组成为岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸,且岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸的摩尔比为43.84:16.24:2.20:4.54:11.27:21.91。
10.以上所述的一种具有显著抗光老化活性的羊栖菜多糖的制备方法,包括以下步骤:
11.将羊栖菜粗多糖、纯水和h2o2混合,置于uvb紫外辐射仪下进行uv/h2o2降解,获得降解后的羊栖菜多糖。
12.优选的,所述羊栖菜多糖的制备包括以下步骤:
13.将所述羊栖菜粗多糖、纯水和h2o2混合,得到混合液1;将所述混合液1置于uvb紫外辐射仪下进行降解,得到混合液2;加入mno2于所述混合液2中,得到混合液3,搅拌,待h2o2分解后,蒸发浓缩,得到浓缩液,离心取上清液;将所述上清液进行透析纯化,收集大分子截留液,蒸发浓缩,得到浓缩液,真空冷冻干燥,即得所述具有显著抗光老化活性的羊栖菜多糖。
14.优选的,所述紫外辐射降解的时间为30-105min,辐照功率为400-1800μw/cm2,辐照剂量为800-6300mj/cm2。
15.优选的,所述紫外辐射降解的时间为30-75min,辐照功率为825μw/cm2,辐照剂量为1485-3712.5mj/cm2。
16.优选的,所述混合液1中,羊栖菜粗多糖的浓度为1-10mg/ml,h2o2的浓度为80-120mmol/l。
17.优选的,所述混合液3中,mno2的浓度为5-30mg/l,搅拌时间为8-24h。
18.优选的,所述羊栖菜粗多糖的分子量为250-320kda,硫酸根含量为4-12wt%。优选的,所述羊栖菜粗多糖可通过热水浸提、超声辅助提取、微波辅助提取、酶法提取、酸法提取和碱法提取中的一种或几种获得。
19.以上所述的一种具有显著抗光老化活性的羊栖菜多糖在制备抗光老化型药物、功能食品及相关日化产品中的应用。
20.与现有技术相比,本发明具有如下优点和有益效果:
21.(1)本发明采用uv/h2o2制备羊栖菜多糖,操作简便,条件温和,无污染,且能显著降
低羊栖菜多糖的分子量,提高总糖含量。
22.(2)本发明所制备的羊栖菜多糖能够提高uvb辐射后人永生化表皮细胞hacat的存活率和羟脯氨酸含量,降低基质金属蛋白酶mmp-1和mmp-3的水平,具有显著的抗光老化活性。
附图说明
23.图1为本发明实施例1和对比例1制备的羊栖菜多糖的平均分子量图。
24.图2为本发明实施例1和对比例1制备的羊栖菜多糖对uvb辐射后hacat细胞羟脯氨酸含量的影响结果图。与模型组相比,*p<0.05,**p<0.01。
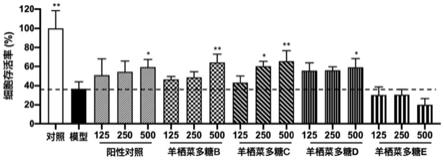
25.图3为本发明实施例2、3、4和对比例1制备的羊栖菜多糖对uvb辐射后hacat细胞存活率的影响结果图。与模型组相比,*p<0.05,**p<0.01。
26.图4为本发明实施例2、3、4和对比例1制备的羊栖菜多糖对uvb辐射后hacat细胞羟脯氨酸含量的影响结果图。与模型组相比,*p<0.05,**p<0.01。
27.图5为本发明实施例2、3、4和对比例1制备的羊栖菜多糖对uvb辐射后hacat细胞mmp-1含量的影响结果图。与模型组相比,*p<0.05,**p<0.01。
28.图6为本发明实施例2、3、4和对比例1制备的羊栖菜多糖对uvb辐射后hacat细胞mmp-3含量的影响结果图。与模型组相比,*p<0.05,**p<0.01。
具体实施方式
29.以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
30.实施例1
31.一种羊栖菜降解多糖,其制备方法如下:
32.(1)原料预处理:采用低温振动式细胞级超微粉碎机将洗净、烘干后的羊栖菜超微粉碎10min,温度设置为-20℃,得到羊栖菜超微粉,过60目筛;称取100g羊栖菜超微粉,加入400ml体积分数为95%乙醇,微沸状态下回流3次,共5h,收集沉淀,烘干,得到预处理的羊栖菜粉末。
33.(2)羊栖菜粗多糖的提取:将步骤(1)所述羊栖菜粉末按照质量体积比1:50g/ml加入纯水中,得到羊栖菜水溶液;采用热水浸提法提取羊栖菜粗多糖,提取温度为100℃,提取时间为4h,提取液抽滤去渣,取滤液进行蒸发浓缩,缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置12h,离心弃上清,所得沉淀于室温下放置,待乙醇挥发后,加入纯水复溶,真空冷冻干燥,得到羊栖菜粗多糖;
34.(3)uv/h2o2降解:将步骤(2)所述羊栖菜粗多糖溶于纯水中,再加入h2o2,得到混合液1,使得混合液1中羊栖菜粗多糖浓度为3mg/ml,h2o2浓度为100mmol/l;将所述混合液1置于uvb紫外辐射仪下分别进行辐射降解15、30、45、60、75、90、105和120min,辐照功率均为825μw/cm2,辐照剂量分别为742.5、1485、2227.5、2970、3712.5、4455、5197.5和5940mj/cm2,分别得到混合液2;加入mno2于所述混合液2中,分别得到混合液3,使得混合液3中mno2浓度为10mg/ml;分别搅拌12h,待h2o2分解后,蒸发浓缩,得到浓缩液,离心取上清液;分别使用截
留分子量为3000kda的透析袋透析纯化48h,收集大分子截留液,蒸发浓缩,得到浓缩液,真空冷冻干燥,即得所述具有显著抗光老化活性的羊栖菜降解多糖(标记为羊栖菜多糖a1、a2、a3、a4、a5、a6、a7和a8)。
35.实施例2
36.一种羊栖菜降解多糖,其制备方法如下:
37.(1)原料预处理:采用低温振动式细胞级超微粉碎机将洗净、烘干后的羊栖菜超微粉碎5min,温度设置为-17℃,得到羊栖菜超微粉,过60目筛;称取100g羊栖菜超微粉,加入400ml体积分数为95%乙醇,微沸状态下回流3次,共4h,收集沉淀,烘干,得到预处理的羊栖菜粉末。
38.(2)羊栖菜粗多糖的提取:将步骤(1)所述羊栖菜粉末按照质量体积比1:40g/ml加入纯水中,得到羊栖菜水溶液;采用超声辅助提取羊栖菜粗多糖,将羊栖菜多糖水溶液置于细胞超声破碎仪中,400w功率下超声40min,反应完成后再在80℃的水浴条件下提取3h。提取液抽滤去渣,取滤液进行蒸发浓缩,缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置12h,离心弃上清,所得沉淀于室温下放置,待乙醇挥发后,加入纯水复溶,真空冷冻干燥,得到羊栖菜粗多糖;
39.(3)uv/h2o2降解:将步骤(2)所述羊栖菜粗多糖溶于纯水中,再加入h2o2,得到混合液1,使得混合液1中羊栖菜粗多糖浓度为1mg/ml,h2o2浓度为90mmol/l;将所述混合液1置于uvb紫外辐射仪下进行辐射降解30min,辐照功率为452μw/cm2,辐照剂量为813.6mj/cm2,得到混合液2;加入mno2于所述混合液2中,得到混合液3,使得混合液3中mno2浓度为5mg/ml;搅拌10h,待h2o2分解后,蒸发浓缩,得到浓缩液,离心取上清液;使用截留分子量为3000kda的透析袋透析纯化48h,收集大分子截留液,蒸发浓缩,得到浓缩液,真空冷冻干燥,即得所述具有显著抗光老化活性的羊栖菜降解多糖(标记为羊栖菜多糖b)。
40.实施例3
41.一种羊栖菜降解多糖,其制备方法如下:
42.(1)原料预处理:采用低温振动式细胞级超微粉碎机将洗净、烘干后的羊栖菜超微粉碎10min,温度设置为-20℃,得到羊栖菜超微粉,过60目筛;称取100g羊栖菜超微粉,加入400ml体积分数为95%乙醇,微沸状态下回流3次,共5h,收集沉淀,烘干,得到预处理的羊栖菜粉末。
43.(2)羊栖菜粗多糖的提取:将步骤(1)所述羊栖菜粉末按照质量体积比1:50g/ml加入纯水中,得到羊栖菜水溶液;采用热水浸提法提取羊栖菜粗多糖,提取温度为100℃,提取时间为4h,提取液抽滤去渣,取滤液进行蒸发浓缩,缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置12h,离心弃上清,所得沉淀于室温下放置,待乙醇挥发后,加入纯水复溶,真空冷冻干燥,得到羊栖菜粗多糖;
44.(3)uv/h2o2降解:将步骤(2)所述羊栖菜粗多糖溶于纯水中,再加入h2o2,得到混合液1,使得混合液1中羊栖菜粗多糖浓度为5mg/ml,h2o2浓度为100mmol/l;将所述混合液1置于uvb紫外辐射仪下进行辐射降解45min,辐照功率为825μw/cm2,辐照剂量为2227.5mj/cm2,得到混合液2;加入mno2于所述混合液2中,得到混合液3,使得混合液3中mno2浓度为10mg/ml;搅拌12h,待h2o2分解后,蒸发浓缩,得到浓缩液,离心取上清液;使用截留分子量为3000kda的透析袋透析纯化48h,收集大分子截留液,蒸发浓缩,得到浓缩液,真空冷冻干燥,
即得所述具有显著抗光老化活性的羊栖菜降解多糖(标记为羊栖菜多糖c)。
45.实施例4
46.一种羊栖菜降解多糖,其制备方法如下:
47.(1)原料预处理:采用低温振动式细胞级超微粉碎机将洗净、烘干后的羊栖菜超微粉碎15min,温度设置为-20℃,得到羊栖菜超微粉,过60目筛;称取100g羊栖菜超微粉,加入500ml体积分数为95%乙醇,微沸状态下回流3次,共6h,收集沉淀,烘干,得到预处理的羊栖菜粉末。
48.(2)羊栖菜粗多糖的提取:将步骤(1)所述羊栖菜粉末按照质量体积比1:60g/ml加入纯水中,得到羊栖菜水溶液;采用酶法辅助提取羊栖菜粗多糖,往羊栖菜水溶液中加入最终溶液质量0.1%的纤维素酶,搅拌均匀,将其置于50℃水浴下反应4h。再加入去离子水,使最终料液比达到1:50g/ml,将其置于100℃灭酶并继续提取4h。提取液抽滤去渣,取滤液进行蒸发浓缩,缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置12h,离心弃上清,所得沉淀于室温下放置,待乙醇挥发后,加入纯水复溶,真空冷冻干燥,得到羊栖菜粗多糖;
49.(3)uv/h2o2降解:将步骤(2)所述羊栖菜粗多糖溶于纯水中,再加入h2o2,得到混合液1,使得混合液1中羊栖菜粗多糖浓度为10mg/ml,h2o2浓度为120mmol/l;将所述混合液1置于uvb紫外辐射仪下进行辐射降解90min,辐照功率为1012μw/cm2,辐照剂量为5464.8mj/cm2,得到混合液2;加入mno2于所述混合液2中,得到混合液3,使得混合液3中mno2浓度为25mg/ml;搅拌24h,待h2o2分解后,蒸发浓缩,得到浓缩液,离心取上清液;使用截留分子量为3000kda的透析袋透析纯化48h,收集大分子截留液,蒸发浓缩,得到浓缩液,真空冷冻干燥,即得所述具有显著抗光老化活性羊栖菜的降解多糖(标记为羊栖菜多糖d)。
50.对比例1
51.一种羊栖菜粗多糖,其制备方法如下:
52.(1)原料预处理:采用低温振动式细胞级超微粉碎机将洗净、烘干后的羊栖菜超微粉碎10min,温度设置为-20℃,得到羊栖菜超微粉,过60目筛;称取100g羊栖菜超微粉,加入400ml体积分数为95%乙醇,微沸状态下回流3次,共5h,收集沉淀,烘干,得到预处理的羊栖菜粉末。
53.(2)羊栖菜粗多糖的提取:将步骤(1)所述羊栖菜粉末按照质量体积比1:50g/ml加入纯水中,得到羊栖菜水溶液;采用热水浸提法提取羊栖菜粗多糖,提取温度为100℃,提取时间为4h,提取液抽滤去渣,取滤液进行蒸发浓缩,缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置12h,离心弃上清,所得沉淀于室温下放置,待乙醇挥发后,加入纯水复溶,得到羊栖菜粗多糖水溶液;
54.(3)透析纯化:将步骤(2)所述羊栖菜粗多糖水溶液使用截留分子量为3000kda的透析袋透析纯化48h,收集大分子截留液,蒸发浓缩,得到浓缩液,真空冷冻干燥,即得所述羊栖菜粗多糖(标记为羊栖菜多糖e)。
55.效果验证
56.本发明选择实施例1制得的羊栖菜降解多糖a1、a2、a3、a4、a5、a6、a7和a8对比了对比例1(热水浸提法)制得的羊栖菜粗多糖e的分子量和抗光老化活性(羟脯氨酸含量)。进一步选择实施例2、3和4方法制得的羊栖菜降解多糖b、c和d对比了对比例1(热水浸提法)制得
的羊栖菜粗多糖e的分子量、化学组成(总糖、糖醛酸和还原糖含量)、单糖组成和抗光老化活性(人永生化表皮细胞hacat细胞存活率、羟脯氨酸含量、基质金属蛋白酶mmp-1和mmp-3含量)。具体实验步骤如下:
57.1、多糖分子量的测定
58.多糖分子量采用凝胶渗透色谱法进行测定,具体实验步骤如下:称取4mg羊栖菜多糖充分溶解于0.02mol/l的kh2po4溶液中,用0.22μm无菌水相滤膜过膜,滤液备用。色谱条件:色谱柱:tsk g-5000pwxl(7.8
×
300mm)和tsk g-3000pwxl(7.8
×
300mm)串联使用,柱温为35℃;检测器:waters 2414示差折光检测器;流动相为0.02mol/l的kh2po4缓冲液,流速为0.5ml/min,进样量为25μl。以不同分子量的葡聚糖(4.66、12.6、63.3、126和556kda)绘制标准曲线。多糖样品的分子量根据其洗脱体积对照标准曲线计算得到。
59.2、多糖总糖含量的测定
60.多糖总糖含量采用苯酚-硫酸法进行测定,具体实验步骤如下:以岩藻糖为标准品,取0.1mg/ml的岩藻糖标准溶液0.2、0.4、0.6、0.8、1.0ml,以去离子水补足至1ml,依次加入5%(w/v)苯酚溶液1ml和浓硫酸5ml,摇匀,反应20min,于490nm处测定反应液的吸光值。以去离子水作为空白,平行测定3次,取平均值。以岩藻糖浓度为横坐标、吸光值为纵坐标绘制标准曲线。准确吸取0.1mg/ml的羊栖菜多糖溶液1ml,按照上述方法进行显色反应后测定反应液的吸光值,将其代入上述标准曲线,计算多糖样品的总糖含量。
61.3、多糖糖醛酸含量的测定
62.多糖糖醛酸含量采用间羟基联苯法进行测定,具体实验步骤如下:以半乳糖醛酸为标准品,取0.1mg/ml半乳糖醛酸标准液0.1、0.2、0.4、0.6、0.8ml,以去离子水补足至0.8ml,混匀后于冰水浴中预冷,然后加入0.0125mol/l硼砂硫酸溶液5ml,混匀后沸水浴5min,取出后立即冷水浴至室温,加入0.15%(w/v)间羟联苯溶液0.1ml,混匀后静置10min,于520nm处测定反应液的吸光值。以去离子水作空白,平行测定3次,取平均值。以半乳糖醛酸浓度为横坐标、吸光值为纵坐标绘制标准曲线。准确吸取0.1mg/ml的羊栖菜多糖溶液0.8ml,按照上述方法进行显色反应后测定反应液的吸光值,将其代入上述标准曲线,计算多糖样品的糖醛酸含量。
63.4、多糖还原糖含量的测定
64.多糖还原糖含量采用二硝基水杨酸(dns)法进行测定,具体实验步骤如下:以葡萄糖为标准品,取1mg/ml葡萄糖标准液0.2、0.4、0.6、0.8、1.0ml,以去离子水补足至1ml,加入dns溶液2ml,混匀后沸水浴2min,取出后常温水浴至室温,补水至15ml,于520nm处测定反应液的吸光值。以去离子水作空白,平行测定3次,取平均值。以葡萄糖浓度为横坐标、吸光值为纵坐标绘制标准曲线。准确吸取1mg/ml的羊栖菜多糖溶液1ml,按照上述方法进行显色反应后测定反应液的吸光值,将其代入上述标准曲线,计算多糖样品的还原糖含量。
65.5、多糖单糖组成的测定
66.多糖单糖组成采用离子色谱法进行,具体实验步骤如下:称取10mg羊栖菜多糖充分溶解于5ml 2mol/l的三氟乙酸中,在105℃下水解6h,通过减压蒸发除去三氟乙酸;加入5ml甲醇充分溶解水解物,再旋干,重复该步骤5次。加入超纯水充分溶解水解产物,转移并定容至100ml,采用0.22μm无菌水相滤膜过膜备用。色谱条件:色谱柱:carbopac pai(250
×
4mm,id.5μm)和离子交换柱(dionex ics 3000)串联,柱温:30℃;流动相a:纯水,流动相b:
naoh(500mmol/l);流速:0.5ml/min;进样量:20μl。准确称取单糖标品(葡萄糖、岩藻糖、半乳糖、木糖、果糖、半乳糖醛酸和葡萄糖醛酸),混合作为混标,过膜进行色谱分析,根据峰面积和摩尔浓度绘制单糖标准曲线。多糖样品中各单糖含量对照标准曲线计算得到。
67.6、uvb辐射后hacat细胞存活率的测定
68.hacat细胞以2
×
104个/孔接种于96孔细胞培养板后,置于37℃,含有5%co2的恒温培养箱中,用含有10%胎牛血清的完全培养基培养12h,吸弃培养基,pbs清洗一遍,用不含血清的基础培养基培养12h。吸弃培养基,对照组和模型组加入基础培养基0.1ml,阳性对照组加入用基础培养基配制的透明质酸溶液(125、250和500μg/ml)0.1ml,实验组加入用基础培养基配制的羊栖菜多糖溶液(125、250和500μg/ml)0.1ml。培养24h后,吸弃培养基,每孔加入0.05ml pbs,对照组不辐照,模型组、阳性对照组和实验组于uvb辐射仪下辐照3mj/cm2。吸弃pbs,用完全培养基继续孵育24h。吸弃培养基,每孔加入0.05ml1
×
mtt溶液,在37℃孵育4h,使mtt还原为甲臜。吸弃培养基,每孔加入0.15ml dmso使甲臜溶解,用平板摇床摇匀。采用酶标仪在570nm波长处检测每孔的吸光度,计算不同浓度与对照组吸光度的比值,根据细胞活力值来判断药物对uvb辐射后hacat细胞存活率的影响。
69.7、uvb辐射后hacat细胞羟脯氨酸、基质金属蛋白酶mmp-1和mmp-3含量的测定
70.hacat细胞以2.5
×
105个/孔接种于12孔细胞培养板后,置于37℃,含有5%co2的恒温培养箱中,用含有10%胎牛血清的完全培养基培养12h,吸弃培养基,pbs清洗一遍,用不含血清的基础培养基培养12h。吸弃培养基,对照组和模型组加入基础培养基1ml,阳性对照组加入用基础培养基配制的透明质酸溶液(500μg/ml)1ml,实验组加入用基础培养基配制的羊栖菜多糖溶液(500μg/ml)1ml。培养24h后,吸弃培养基,每孔加入0.5ml pbs,对照组不辐照,模型组、阳性对照组和实验组于下辐照3mj/cm2。吸弃pbs,用完全培养基继续孵育24h,收集上清液测定羟脯氨酸、基质金属蛋白酶mmp-1和mmp-3的含量。羟脯氨酸的测定采用羟脯氨酸试剂盒(消化法),mmp-1和mmp-9的测定采用elisa试剂盒。
71.如图1所示,随着降解时间的延长,羊栖菜多糖分子量逐渐降低,说明uv/h2o2降解可有效降低羊栖菜多糖的分子量。
72.羟脯氨酸是胶原组织的主要成分之一,且为胶原中特有的氨基酸,可作为结缔组织分解情况指标。如图2所示,经uvb辐射后,模型组hacat细胞羟脯氨酸含量较正常组显著降低(p<0.01),表明辐射后细胞胶原发生降解。透明质酸和羊栖菜多糖a2、a3、a4和a5处理后,hacat细胞羟脯氨酸含量均显著上升,说明分子量在28-130kda范围内的羊栖菜多糖具有显著抗光老化活性。
73.表1 uv/h2o2处理对羊栖菜多糖分子量和化学组成的影响
[0074][0075]
由表1可知,uv/h2o2处理可显著降低羊栖菜多糖的分子量和糖醛酸含量,提高多糖的总糖含量和还原糖含量。结合表2、图3和图4可知,分子量为28-130kda,糖醛酸含量为21-33wt%,还原糖含量为2-7wt%的羊栖菜多糖具有显著抗光老化活性。
[0076]
表2 uv/h2o2处理对羊栖菜多糖单糖组成的影响
[0077][0078][0079]
如表2所示,uv/h2o2处理可显著提高羊栖菜多糖单糖组成中岩藻糖和半乳糖含量,降低葡萄糖、木糖和半乳糖醛酸含量。结果显示,单糖组成为岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸,且岩藻糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸的摩尔比为(39~46):(16~17):(2~3):(4~5):(10~16):(20-22)的羊栖菜多糖具有显著抗光老化活性。
[0080]
如图3所示,经uvb辐射后,模型组hacat细胞存活率较正常组显著降低(p<0.01),表明细胞受到了光老化损伤。阳性对照(透明质酸)和羊栖菜多糖b、c和d处理后,hacat细胞存活率均显著上升,说明羊栖菜多糖b、c和d具有显著抗光老化活性,且羊栖菜多糖c和d的效果优于透明质酸。未经uv/h2o2降解的羊栖菜多糖e不具有显著抗光老化活性。
[0081]
如图4所示,经uvb辐射后,模型组hacat细胞羟脯氨酸含量较正常组显著降低(p<0.01),表明辐射后细胞胶原发生降解。透明质酸和羊栖菜多糖b、c和d处理后,hacat细胞羟脯氨酸含量均显著上升,说明羊栖菜多糖b、c和d能够拮抗胶原降解,具有显著抗光老化活性。未经uv/h2o2降解的羊栖菜多糖e不具有显著抗光老化活性。
[0082]
基质金属蛋白酶(mmps)是一类锌依赖性内肽酶,可降解多种细胞外基质成份。其中mmp-1可以降解i型和iii型胶原纤维,mmp-3可以降解基底膜中的iv型胶原纤维,并部分降解其他胶原纤维,与皮肤光老化密切相关。如图5和图6所示,经uvb辐射后,模型组hacat细胞mmp-1和mmp-3含量较正常组均显著升高(p<0.01),表明紫外辐射能诱导mmp-1和mmp-3的表达增高,导致细胞外基质中纤维结缔组织类物质降解。羊栖菜多糖b、c和d处理后,hacat细胞mmp-1和mmp-3含量均显著降低,说明羊栖菜多糖b、c和d能抑制mmp-1和mmp-3的表达,具有显著抗光老化活性。透明质酸能抑制mmp-1的表达,但抑制效果比羊栖菜多糖c和d差,且不能抑制mmp-3的表达。未经uv/h2o2降解的羊栖菜多糖e不能抑制mmp-1和mmp-3的表达。
[0083]
uv/h2o2制备的羊栖菜多糖能显著提高uvb辐射后hacat细胞存活率和羟脯氨酸含量,降低基质金属蛋白酶mmp-1和mmp-3的水平,表明其具有显著的抗光老化活性,且抗光老化活性优于阳性对照(透明质酸)和未经uv/h2o2降解的羊栖菜粗多糖。
[0084]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1