低ADCC/CDC功能性单抗及其制备方法与应用与流程
低adcc/cdc功能性单抗及其制备方法与应用
1.本技术是申请日为2019年7月5日,申请号为:2019106055706,发明名称为“低adcc/cdc功能性单抗及其制备方法与应用”的专利申请之分案申请。并且,申请号为:2019106055706的申请要求以下中国专利申请的优先权:2018年7月6日提交中国国家知识产权局、申请号为201810738565.8、发明名称为“低adcc/cdc功能性抗pd-l1全人源单抗及其应用”;2018年8月14日提交中国国家知识产权局、申请号为201810924249.x、发明名称为“针对人程序性死亡受体pd-1的igg1亚型低adcc/cdc功能性抗体”以及2019年5月7日提交中国国家知识产权局、申请号为201910376852.3、发明名称为“针对人ctla4的igg1亚型低adcc/cdc功能性抗体”的中国专利申请,其全部内容通过引用结合在本技术中。
技术领域
2.本发明涉及治疗用抗体的制备及应用,主要涉及低adcc/cdc功能性单抗的应用,以及降低抗体的adcc/cdc功能的方法。
背景技术:
3.抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,adcc)是指表达igg fc受体的nk细胞、巨噬细胞和中性粒细胞等,通过与已结合在靶细胞表面的igg抗体的fc段结合,而杀伤这些靶细胞的作用。igg抗体可介导这些细胞发挥adcc作用,其中nk细胞是能发挥adcc作用的主要细胞。在抗体介导的adcc作用的发生过程中,抗体只能与靶细胞上的相应抗原表位特异性结合,而nk细胞等效应细胞可杀伤任何已与抗体结合的靶细胞,故抗体与靶细胞上的抗原结合是特异性的,nk细胞等对靶细胞的杀伤作用是非特异性的。
4.cdc指补体系统被激活后,在靶细胞表面形成mac,导致靶细胞溶解,这种效应称为补体依赖的细胞毒作用。补体能导致多种细菌和其他病原生物细胞的溶解,是机体抵抗病原生物感染的重要防御机制。尤其是对防止革兰阴性菌的感染有重要作用。在某些病例情况下,补体系统可引起机体组织或细胞损伤,参与超敏反应和自身免疫病的致病过程。
5.抗体药的应用并不局限于传染病和肿瘤,为了避免抗体结合靶蛋白后诱导不利的adcc和cdc功能,目前采取的主要方法有对抗体重链进行了糖基化位点氨基酸n(297)突变成a的去糖基化突变或将抗体重链改为igg2/4亚型。但是抗体重链去糖基化,导致了产品中多聚体含量过高,药物免疫原性显著增强,病人多次给药后产生抗药抗体(ada)发生率高。igg2亚型的抗体仍能够通过与fcγriia的结合引发单核细胞介导的adcc与巨噬细胞介导的adcp。此外,igg2的铰链区上游存在额外的cys残基,因此会形成二硫键异构体影响igg2分子的空间构象与功能。而将抗体重链改为igg4亚型,igg4亚型的抗体药重链在血液中会自动发生和其他人igg4重链交换,形成半分子以及双特异的功能单价的抗体。同时,igg2/4亚型抗体半衰期比igg1亚型显著缩短。
6.pd-1主要在激活的t细胞和b细胞中表达,功能是抑制免疫细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的t/b细胞激活会引起自身免疫病,所以pd-1是我们
人体的一道护身符。但是,肿瘤微环境会诱导浸润的t细胞高表达pd-1分子,肿瘤细胞会高表达pd-1的配体pd-l1和pd-l2,导致肿瘤微环境中pd-1通路持续激活,t细胞功能被抑制,无法杀伤肿瘤细胞。
7.2014年9月4日美国食品药品监督管理局(fda)授权加速批准美国默克(merck)公司pembrolizumab(商品名:keytruda)上市,用于治疗对其他不再反应的晚期或不可切除黑色素瘤。2017年5月27日,美国食品药品监督管理局(fda)批准keytruda用于治疗微卫星不稳定的实体瘤,成为首个可以治疗多种癌症的抗体药物。该抗体药为了避免诱导抗体依赖的细胞毒性作用(adcc)和补体依赖的细胞毒性作用(cdc)功能,使用了对于fcγr受体具有较弱亲和力且缺乏激活补体能力的igg4亚型。由于igg4亚型抗体本身存在fab臂置换,因此有形成半抗体或双特异抗体的几率,增加用药的潜在风险,且igg4亚型的抗体的生产工艺不如igg1亚型抗体成熟(主要表现在结构稳定性、理化特性、抗聚合能力、表达量等方面)。
8.这给临床患者的使用带来了风险和不便,同时药物半衰期也相对较短,使用的过程中也需要增大药物剂量来弥补该方面的缺陷。基于此,若能够在不影响抗体亲和力和特异性的前提下,通过对抗体恒定区域进行改造,在降低抗体的adcc/cdc功能的同时,避免抗体药形成大量多聚体,减少抗体药的免疫原性,则一方面可使单抗的安全性得到提高;另一方面可增加药物半衰期,在减少其用剂量同时也能起到提高疗效的作用。
9.目前未见通过插入氨基酸序列来减少抗体药中多聚体含量和它的免疫原性的报道。
技术实现要素:
10.本发明的第一目的在于提供一种降低抗体的adcc/cdc功能的方法及其应用。
11.本发明的第二目的在于提供了一系列低adcc/cdc、低多聚体、低免疫原性的治疗性抗体包括抗pd-l1、抗pd-1和抗ctla-4等多种单克隆抗体及其应用。
12.为完成上述发明目的,本发明采取如下技术方案。
13.本发明提供一种降低或去除igg1亚型抗体的adcc/cdc功能的方法,该方法在原始igg1抗体重链的恒定区插入一段柔性氨基酸序列。
14.在本发明的一些具体实施方案中,该方法在原始igg1亚型抗体重链的cdr3与ch2区之间插入一段柔性氨基酸序列。
15.进一步的,所述插入一段柔性氨基酸序列,阻断了抗体可变区结合抗原后产生的机械应力传递,使抗体重链恒定区与fc受体和/或补体结合位点不能充分暴露出来,弱化抗体与nk细胞、巨噬细胞和中性粒细胞表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号。
16.在本发明的一些具体实施方案中,所述igg1抗体单抗为pd-l1、pd-1、ctla4、tnf-α、pcsk9、ngf、c5、aβ、il-6、il-17a、il23a、hgf、cmet、notch1、ccl11、il6r、il-31r、il-1b、il-20、cd40、cd47、dkk1/2、tigit、4-1bb、igf-1r、ll4、pdgfr2、her3、igf1/2、rankl、sclerostin、gcgr、cgrp、angptl3、il-13、il-4r、csf-1r、tfpi、fcgrt、cd47抗体,例如atezolizumab单抗、pembrolizumab单抗、ipilimumab单抗、eculizumab单抗、evolocumab单抗、erenumab单抗、fulranumab单抗、crenezumab单抗、brodalumab单抗、ixekizumab单抗、satralizumab单抗、gevokizumab单抗、denosumab单抗、blosozumab单抗、crotedumab单抗、
fasinumab单抗、fremanezumab单抗、evinacumab单抗、lebrikizumab单抗、dupilumab单抗、cabiralizumab单抗、concizumab单抗、rozanolixizumab单抗、magrolimab单抗等抗体药的igg1亚型改进。
17.在本发明的一些具体实施方案中,所述柔性氨基酸序列包括但不限于ggsggs、gsggsgg、gsggsggg、ggggsggg、gsgsg、ggsgg、ggs、ggsgs和gggs。
18.在本发明的一些具体实施方案中,所述柔性氨基酸序列插入位点包括但不限于gg(138/139)、ss(177/178)、sg(178/179)、ss(184/185)、sss(191/192/193)、ll(235/236)、gg(237/238)。
19.本发明还提供一种柔性氨基酸序列在提高抗体稳定性/降低抗体免疫原性/延长抗体半衰期中的应用。
20.在本发明的一些具体实施方案中,所述柔性氨基酸序列插入原始igg1抗体重链的恒定区中。
21.在本发明的一些具体实施方案中,所述柔性氨基酸序列插入原始igg1抗体重链的cdr3与ch2之间。
22.本发明还提供一类低adcc/cdc、低多聚体、低免疫原性的治疗性抗体包括抗pd-l1的单克隆抗体。
23.本发明的还提供一类制备低adcc/cdc、低多聚体、低免疫原性治疗性抗体包括抗pd-l1的单克隆抗体的方法。
24.本发明基于抗体诱导adcc/cdc的作用机理,通过在抗体重链的恒定区插入一段柔性氨基酸序列,切断抗体可变区结合抗原后产生的机械应力传递,使抗体药重链恒定区与fc受体和/或结补体合位点不能充分暴露出来,弱化抗体药与nk细胞、巨噬细胞和中性粒细胞等表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号。
25.本发明还通过在基因泰克(genentech)公司的atezolizumab抗体药的297位氨基酸a突变回n恢复糖基化的基础上,在igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列来阻断抗体结合抗原后抗体可变区及恒定区间的应力传递,从而达到在降低adcc/cdc功能的同时不显著增加多聚体形成。
26.本发明的低免疫原性抗pd-l1单克隆抗体,是在原始atezolizumab序列中非抗原结合区进行氨基酸改造,降低其免疫原性,所述原始atezolizumab序列的重链全长和轻链可变区的氨基酸序列分别如seq id no.1、2所示。
27.进一步地,本发明提供的低免疫原性抗pd-l1单克隆抗体,其重链的氨基酸序列为seq id no.3或4所示,其轻链的氨基酸序列为seq id no.2。
28.本发明提供的抗人pd-l1单克隆抗体,其轻链如l0(seq id no.2)所示,重链全长具有h-1(seq id no.3),h-2(seq id no.4)这2条碱基序列所示的任一个序列。
29.具备上述轻链可变区和重链可变区的组合中,本发明筛选得到2个单抗序列,它们既保持了原有与人pd-l1结合的亲和力,可特异性地阻断pd-1与pd-l1的结合,又降低了多聚体的含量,这可使它们的免疫原性得到有效的降低,同时在改造过程中adcc活性验证结果显示本发明筛选获得的2个单抗序列的adcc活性与原始atezolizumab一致。
30.本发明得到的2个低免疫原性的抗pd-l1的单克隆抗体,分别为h-1l0、h-2l0。
31.本发明提供的上述单克隆抗体或含有该抗体的生物材料在治疗以pd-l1或pd-1为
靶标的疾病中的应用。
32.本发明提供的上述单克隆抗体或含有该抗体的生物材料在杀伤肿瘤细胞或治疗免疫能力退行疾病中的应用。
33.所述生物材料为表达盒、表达载体、工程菌或细胞。
34.本发明提供上述2个低免疫原性的抗pd-l1的单克隆抗体在制备治疗疾病药物中的应用。
35.所述的疾病为肿瘤,免疫功能退下等。
36.本发明提供了上述抗pd-l1单克隆抗体在制备以pd-l1为靶标的疾病治疗药物中的应用。
37.所述的药物为抗肿瘤,免疫功能退下疾病的药物。
38.本发明提供了含有上述抗pd-l1单克隆抗体的药物或检测试剂。
39.本发明提供了上述低adcc/cdc功能性抗pd-l1单抗在治疗以pd-l1或pd-1为靶标的疾病中的应用。
40.本发明提供了上述低adcc/cdc功能性抗pd-l1单抗在杀伤肿瘤细胞或治疗免疫能力退行疾病中的应用。
41.本发明的抗pd-l1单抗可与第二治疗剂或治疗形式组合。抗pd-l1抗体可与包括施用ctla-4抗体或cd47抗体的癌症治疗组合。组合的非限制性实例包括抗pd-l1抗体与抗ctla-4的抗体联合用于治疗黑素瘤或非小细胞肺癌。
42.用本发明的抗pd-l1抗体的治疗可与化疗组合。使用细胞毒剂的化疗将导致癌细胞死亡,由此增加肿瘤抗原的释放。所述增加肿瘤抗原的有效性可导致与抗pd-l1治疗的协同作用。
43.用本发明的pd-l1单抗治疗可与手术组合以从受治疗者中去除癌细胞。
44.本发明的抗pd-l1抗体可与能同pd-l1阻断产生协同作用的疗法组合,所述疗法包括用于激素消除或抑制血管生成的靶向药物,或靶向在肿瘤细胞中具有活性的蛋白质的靶向药物,所有这些均导致肿瘤细胞死亡增加和免疫刺激性肿瘤抗原的有效性提高。
45.本发明的抗pd-l1单抗可与用于治疗癌症或感染性疾病的另一种治疗性抗体联合。具体实例可有:抗pd-l1抗体与靶向pd-1或靶向ctla-4的抗体的组合。
46.本发明提供了制备上述抗pd-l1单克隆抗体的方法,包括以下步骤:
47.(1)本发明利用pymol软件对基因泰克(genentech)公司的atezolizumab的结构进行分析,在抗体可变区与恒定区之间寻找相对柔性的区域,并在相应区域插入柔性氨基酸序列,对相应序列进行基因合成,测序,选择测序正确的序列。
48.(2)根据已知的抗体重链糖基化信息,本发明对相应修改后的序列进行全基因合成,对合成的基因进行测序同时选择测序正确的序列进行下一步操作,将轻链可变区设计酶切位点为kpn i+bamh i,重链可变区设计酶切位点为kpni+agei,分别与表达载体pjh16载体连接,同时转化大肠杆菌dh5α,得到重链、轻链嵌合抗体表达载体。同时对构建的抗体进行测序和序列对比;
49.(3)对上述表达的载体进行质粒大提工作,选取qiagen的无内毒素质粒大提试剂盒;
50.(4)对选取的质粒进行优化组合,同时利用cho细胞进行瞬时转染表达,对表达的
抗体进行亲和力和ec50检测(详见图2)根据检测结果来选定哪些组合进行稳定转染;
51.(5)根据上述检测结果,本发明选取相应的组合利用电转染方式构建稳定株,同时利用mtx进行抗体表达程度的筛选,对于加压后的稳定株进行单克隆筛选,最终挑选出抗体产量较高的稳定株,用于后续实验所用;
52.(6)本发明生产的单克隆抗体在小鼠体内的免疫反应比atezolizumab低。
53.本发明提供的抗pd-l1抗体和atezolizumab针对的是pd-l1相同位点,但其免疫原性和抗体构象同atezolizumab不同,同atezolizumab相比其稳定性显著提高、免疫原性大大降低、动物体内药物半衰期延长,有望成为非常理想的生物靶向治疗抗体。本发明通过对atezolizumab单抗恒定区序列进行改造,将显著降低该抗体药在病人体内产生免疫原性的风险。本发明实施例显示本发明的改进型atezolizumab抗体与pd-l1结合的亲和力和原始atezolizumab相近,并显著降低了ada滴度,延长抗体药的半衰期,提高疗效。
54.本发明还提供针对人pd-1的igg1亚型低adcc/cdc功能性单克隆抗体及该单克隆抗体的应用。
55.本发明基于抗体诱导adcc/cdc的作用机理,通过对原始pembrolizumab单抗氨基酸序列进行改造,将抗体由igg4亚型更换为igg1亚型,并在igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列,使单抗重链恒定区与fc受体和/或补体结合位点不能充分暴露出来,弱化单抗与nk细胞、巨噬细胞和中性粒细胞表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号,所述原始pembrolizumab单抗的重链全长的氨基酸序列如seq id no.5所示,轻链全长的氨基酸序列如seq id no.6所示。
56.进一步地,本发明提供的igg1亚型低adcc/cdc功能性pd-1单抗,其重链全长含有seq id no.7所示的氨基酸序列或seq id no.7所示的氨基酸序列的变体,其轻链全长含有seq id no.6所示的氨基酸序列或seq id no.6所述氨基酸序列的变体。
57.在上述任何实施方案中,抗体重链恒定区或其变体为igg1。
58.本发明抗体可包含:igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列,阻断抗体结合抗原后抗体可变区及恒定区间的应力传递,达到在降低adcc/cdc功能的同时降低抗体后续生产工艺开发的难度,提高抗体的抗聚合性、表达量及稳定性。
59.具体地,本发明提供的igg1亚型低adcc/cdc功能性pd-1单抗,其轻链全长氨基酸如l0(seq id no.6)所示,重链全长氨基酸序列具有h1(seq id no.7)所示的序列。
60.具备上述轻链可变区和重链可变区的组合中,本发明筛选得到h2l0单抗序列。它既保持了原有与人pd-1结合的亲和力,可特异性地阻断pd-1与pd-l1的结合,又降低了adcc和cdc功能活性,且由于为igg1亚型单抗,相对于作为igg4亚型的原始pembrolizumab单抗,本发明单抗生产工艺成熟,难度低,抗体的抗聚合性、表达量和稳定性均得以提高。
61.本发明提供了含有上述任一个igg1亚型低adcc/cdc功能性pd-1单抗轻链和重链基因的表达载体。含有所述表达载体的宿主菌、宿主细胞或表达盒也在本发明的保护范围内。
62.本发明提供了提高免疫细胞活性的方法,所述方法包括将治疗有效量的本发明抗体给予需要治疗的对象。所述方法可用于治疗癌症、可用于治疗免疫能力低下疾病。本发明还包括进一步给予第二种治疗剂或治疗形式。
63.本发明还包括上述抗pd-1单抗在用于制备提高免疫功能的药物中的用途。
64.本发明的抗pd-1单抗可与第二治疗剂或治疗形式组合。抗pd-1抗体可与包括施用重组细胞因子或分泌免疫因子的癌症治疗组合。组合的非限制性实例包括抗pd-1抗体与重组il-2或重组ifn2联合用于治疗黑素瘤或肾细胞癌。重组il-2增加癌症患者中的t细胞产生。重组ifn2在被治疗患者中不但抑制癌细胞生长,同时还提高癌细胞、抗原呈递细胞和其他体细胞上的pd-1的抑制性配体的表达。本发明的抗pd-1单抗可与被认为可用于治疗癌症或感染性疾病的其他细胞因子组合。
65.本发明的抗pd-1单抗或抗体片段可与疫苗组合以预防或治疗癌症或感染性疾病。作为非限制性实例,抗pd-1单抗可与以下物质组合:含有与待治疗的癌症或感染有关的一种或多种抗原的蛋白质、肽或dna疫苗或由用所述抗原刺激的树突细胞组成的疫苗。本发明提供了抗pd-1与(弱化的)癌细胞或全病毒疫苗的用途。本发明提供了抗pd-1疗法与经基因工程改造而分泌gm-csf的全细胞癌症疫苗组合。
66.本发明的抗pd-1单抗可与被认为是癌症或感染性疾病中的护理标准的治疗组合。所述组合的基本原理是,由抗pd-1并行提高的免疫活化作用将诱导或促进对护理治疗标准的初始临床反应、诱导长期的临床反应和对疾病的长期免疫控制。
67.用本发明的抗pd-1抗体的治疗可与化疗组合。使用细胞毒剂的化疗将导致癌细胞死亡,由此增加肿瘤抗原的释放。所述增加肿瘤抗原的有效性可导致与抗pd-1治疗的协同作用。
68.用本发明的pd-1单抗治疗可与手术组合以从受治疗者中去除癌细胞。
69.本发明的抗pd-1抗体可与能同pd-1阻断产生协同作用的疗法组合,所述疗法包括用于激素消除或抑制血管生成的靶向药物,或靶向在肿瘤细胞中具有活性的蛋白质的靶向药物,所有这些均导致肿瘤细胞死亡增加和免疫刺激性肿瘤抗原的有效性提高。在于抗pd-1抗体联合的情况下,t细胞活化作用的提高可导致对癌症的持久免疫控制。
70.本发明的抗pd-1单抗可与用于治疗癌症或感染性疾病的另一种治疗性抗体联合。具体实例可有:抗pd-1抗体与靶向her2/neu或靶向egf受体的抗体的组合;抗pd-1抗体与抗ctla-4组合;抗pd-1抗体或抗体片段与靶向ox40的抗体组合。
71.本发明提供的上述单克隆抗体或含有该单抗的生物材料在治疗以pd-l1或pd-1为靶标的疾病中的应用。
72.发明提供的上述单克隆抗体或含有该单抗的生物材料在杀伤肿瘤细胞或治疗免疫能力退行疾病中的应用。
73.所述生物材料为表达盒、表达载体、工程菌或细胞。
74.本发明提供上述igg1亚型低adcc/cdc功能性pd-1单抗在制备治疗疾病药物或提高免疫功能药物中的应用。
75.所述的疾病为肿瘤,免疫功能退下等。
76.本发明提供了上述igg1亚型低adcc/cdc功能性pd-1单抗在制备以pd-l1为靶标的疾病治疗药物中的应用。
77.所述的药物为抗肿瘤,免疫功能退下疾病的药物。
78.本发明提供了含有上述igg1亚型低adcc/cdc功能性pd-1单抗的药物或检测试剂。
79.本发明提供了上述igg1亚型低adcc/cdc功能性pd-1单抗在治疗以pd-l1或pd-1为靶标的疾病中的应用。
80.本发明提供了上述igg1亚型低adcc/cdc功能性pd-1单抗在杀伤肿瘤细胞或治疗免疫能力退行疾病中的应用。
81.本发明利用pymol软件对美国默克(merck)公司的pembrolizumab的结构进行分析,将抗体由igg4亚型更换为igg1亚型,并在igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列,达到在降低adcc/cdc功能的同时降低抗体后续生产工艺难度,提高抗体的抗聚合性、表达量和稳定性,避免igg4亚型的重链置换特性导致的半抗体和双特异性抗体的形成。本发明的单抗与人pd-1结合的亲和力和原始pembrolizumab抗体相近,可特异性地阻断pd-1与细胞表面pd-l1的结合,延长抗体药的半衰期,提高疗效,具有优异的临床应用价值。
82.本发明还提供针对人ctla4的igg1亚型低adcc/cdc功能性单克隆抗体及其该单克隆抗体的应用。
83.本发明基于抗体诱导adcc/cdc的作用机理,通过对原始ipilimumab单抗氨基酸序列进行改造,在igg1亚型抗体ipilimumab重链cdr3与ch2区之间插入一段柔性氨基酸序列,使单抗重链恒定区与fc受体和/或补体结合位点不能充分暴露出来,弱化单抗与nk细胞、巨噬细胞和中性粒细胞表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号,所述原始ipilimumab单抗的重链全长的氨基酸序列如seq id no.8所示,轻链全长的氨基酸序列如seq id no.9所示。
84.本发明利用pymol软件对美国百时美施贵宝(bms)公司的ipilimumab的结构进行分析,在igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列,达到在降低adcc/cdc功能的同时降低抗体在治疗中的副作用,提高抗体的抗聚合性、表达量和稳定性。本发明的单抗与人ctla4结合的亲和力和原始ipilimumab抗体相近,可特异性地阻断ctla4与cd80及cd86的结合,降低抗体药治疗副作用,提高抗体药疗效,具有优异的临床应用价值。
85.进一步地,本发明提供的igg1亚型低adcc/cdc功能性ctla4单抗,其重链全长含有seq id no.10所示的氨基酸序列,其轻链全长含有seq id no.9所示的氨基酸序列。
86.在上述任何实施方案中,抗体重链恒定区为igg1亚型。
87.本发明抗体可包含:igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列,阻断抗体结合抗原后抗体可变区及恒定区间的应力传递,达到在降低adcc/cdc功能的同时降低抗体后续生产工艺开发的难度,提高抗体的抗聚合性、表达量及稳定性。
88.具体地,本发明提供的igg1亚型低adcc/cdc功能性ctla4单抗,其轻链全长氨基酸如l0(seq id no.9)所示,重链全长氨基酸序列如h1(seq id no.10)序列所示。
89.本发明筛选h1l0单抗序列。它既保持了原有与人ctla4结合的亲和力,可特异性地阻断ctla4与其配体的结合,又降低了adcc和cdc功能活性。
90.本发明提供了含有上述任一个igg1亚型低adcc/cdc功能性ctla4单抗轻链和重链基因的表达载体。含有所述表达载体的宿主菌、宿主细胞或表达盒也在本发明的保护范围内。
91.本发明提供了提高免疫细胞活性的方法,所述方法包括将治疗有效量的本发明抗体给予需要治疗的对象。所述方法可用于治疗癌症、可用于治疗免疫能力低下疾病。本发明还包括进一步给予第二种治疗剂或治疗形式。
92.本发明还包括上述抗ctla4单抗在用于制备提高免疫功能的药物中的用途。
93.本发明的抗ctla4单抗可与第二治疗剂或治疗形式组合。抗ctla4抗体可与包括施用pd-1抗体或pd-l1抗体的癌症治疗组合。组合的非限制性实例包括抗ctla4抗体与抗pd-1的抗体联合用于治疗黑素瘤或非小细胞肺癌。
94.用本发明的抗ctla4抗体的治疗可与化疗组合。使用细胞毒剂的化疗将导致癌细胞死亡,由此增加肿瘤抗原的释放。所述增加肿瘤抗原的有效性可导致与抗ctla4治疗的协同作用。
95.用本发明的ctla4单抗治疗可与手术组合以从受治疗者中去除癌细胞。
96.本发明的抗ctla4抗体可与能同ctla4阻断产生协同作用的疗法组合,所述疗法包括用于激素消除或抑制血管生成的靶向药物,或靶向在肿瘤细胞中具有活性的蛋白质的靶向药物,所有这些均导致肿瘤细胞死亡增加和免疫刺激性肿瘤抗原的有效性提高。在于抗ctla4抗体联合的情况下,t细胞活化作用的提高可导致对癌症的持久免疫控制。
97.本发明的抗ctla4单抗可与用于治疗癌症或感染性疾病的另一种治疗性抗体联合。具体实例可有:抗ctla4抗体与靶向pd-1或靶向pd-l1的抗体的组合。
98.本发明提供的上述单克隆抗体或含有该单抗的生物材料在治疗以ctla4为靶标的疾病中的应用。
99.发明提供的上述单克隆抗体或含有该单抗的生物材料在杀伤肿瘤细胞或治疗免疫能力退行疾病中的应用。
100.所述生物材料为表达盒、表达载体、工程菌或细胞。
101.本发明提供上述igg1亚型低adcc/cdc功能性ctla4单抗在制备治疗疾病药物或提高免疫功能药物中的应用。
102.所述的疾病为肿瘤,免疫功能退行等。
103.本发明提供了上述igg1亚型低adcc/cdc功能性ctla4单抗在制备以ctla4为靶标的疾病治疗药物中的应用。
104.所述的药物为抗肿瘤,免疫功能退行疾病的药物。
105.本发明提供了上述igg1亚型低adcc/cdc功能性ctla4单抗在治疗以pd-l1或pd-1为靶标的疾病中的联合应用。
106.本发明提供了上述igg1亚型低adcc/cdc功能性ctla4单抗在杀伤肿瘤细胞或治疗免疫能力退行疾病中的应用。
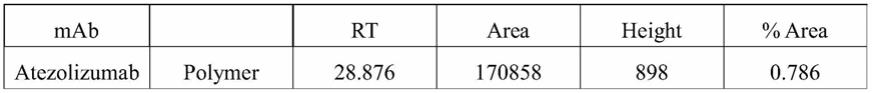
107.综上,本发明的降低抗体的adcc/cdc功能的方法,可降低adcc/cdc功能,同时不显著增加多聚体形成。改造后单抗和原始单抗针对相同位点,均去除了adcc功能,但抗体构象不同,稳定性显著提高,免疫原性显著降低,半衰期延长。有效避免因adcc/cdc功能造成的副反应,提高疗效,具有优异的临床应用价值。
附图说明
108.图1本发明改造后的pd-l1单抗(h-1l0)与原始atezolizumab抗体重链的序列比对结果。
109.图2本发明改造后的pd-l1单抗和原始atezolizumab抗体亲和力评价结果。横坐标为抗体的浓度(m),纵坐标为450nm下的吸光度。
110.图3本发明改造后的两个pd-l1单抗(h-1l0、h-2l0)和原始atezolizumab抗体adcc
活性实验,纵坐标为raji-pdl1细胞裂解百分率,横坐标为样品浓度,imm25为adcc阳性抗体作为阳性对照,atezolizumab原研药作为adcc实验阴性对照。
111.图4本发明改造后的pd-l1单抗抑制pd-l1与pd-1活性细胞实验结果。横坐标为抗体的浓度(m),纵坐标为荧光素酶活性单位均值。
112.图5本发明改造后的pd-l1单抗和原始atezolizumab抗体ada评价对比。横坐标为血清稀释比例,纵坐标为450nm下的吸光度。
113.图6a和图6b分别为原始atezolizumab抗体和本发明改造后pd-l1单抗的hplc-sec结果图。
114.图7a和图7b为本发明改造后pd-l1单抗的糖型分析。其中图7a为原研atezolizumab的糖型分析质谱结果,图7b为改造后pd-l1单抗的糖型分析质谱结果。
115.图8本发明改造后pd-l1单抗和原始atezolizumab抗体热稳定性实验结果。图中横坐标为抗体的浓度(m),纵坐标为450nm下的吸光度。
116.图9本发明改造后的pd-1单抗与原始pembrolizumab抗体重链的序列比对结果。
117.图10本发明改造后的pd-1单抗与原始pembrolizumab抗体亲和力评价结果。横坐标为抗体的浓度(m),纵坐标为450nm下的吸光度。
118.图11本发明改造后的pd-1单抗与原始pembrolizumab抗体adcc活性实验,纵坐标为raji-pd-1细胞裂解百分率,横坐标为样品浓度,pembrolizumab原研药作为adcc实验对照,替换为igg1亚型的pembrolizumab单抗作为adcc实验阳性对照,h1l0为本发明改造后的pd-1单抗。
119.图12本发明改造后的pd-1单抗与原始pembrolizumab抗体抑制pd-l1与pd-1活性细胞实验结果。横坐标为抗体的浓度(m),纵坐标为荧光素酶活性单位均值。
120.图13本发明改造后的ctla4单抗与原始ipilimumab抗体重链的序列比对结果。
121.图14本发明改造后的ctla4单抗与原始ipilimumab抗体亲和力评价结果。横坐标为抗体的浓度(m),纵坐标为450nm下的吸光度。
122.图15本发明改造后的ctla4单抗与原始ipilimumab抗体adcc活性实验,纵坐标为raji-ctla4细胞裂解百分率,横坐标为样品浓度,ipilimumab原研药作为adcc实验阳性对照,h1l0为本发明改造后的ctla4单抗。
123.图16本发明改造后的ctla4单抗与原始ipilimumab抗体抑制ctla4与cd80及cd86结合活性实验。横坐标为抗体的浓度(m),纵坐标为450nm下的吸光度。
124.图17本发明改造后的ctla4单抗和原始ipilimumab抗体与cd80和cd86竞争结合人ctla4转染的cho细胞结果。横坐标为抗体的浓度(m),纵坐标为450nm下的吸光度。
具体实施方式
125.缩写和定义
[0126]“抗体”,是指表现所需生物学活性(例如抑制配体与其受体的结合或通过抑制配体诱导的受体信号传递)的抗体的任何形式。因此,所述抗体以最广泛的意义使用,并明确包括但不限于单克隆抗体、多克隆抗体和多特异性抗体。
[0127]“fab片段”由一条轻链和一条重链的ch1及可变区构成。fab分子的重链不能与另一个重链分子形成二硫键。
[0128]“fc”区域为含有抗体的ch1和ch2结构域的两个重链片段。两个重链片段由两个或多个二硫键并通过ch3结构域的疏水作用保持在一起。
[0129]“fab’片段”含有一条轻链和包含vh结构域和ch1结构域以及ch1和ch2结构域之间区域的一条重链的部分,由此可在两个fab’片段的两条重链之间形成链间二硫键以形成f(ab’)2分子。
[0130]
本技术所用术语“单克隆抗体”是指从基本上同种抗体群中获得的抗体,即除了可能少量存在的可能的天然突变体外,构成所述群的各个抗体是一致的。单克隆抗体具有高度特异性,可针对单个的抗原位点。此外,与通常包括针对多个不同的决定簇(表位)的多种不同抗体的常规(多克隆)抗体制备物相反,每种单克隆抗体仅针对抗原上的单个决定簇。修饰语“单克隆”表示从基本上同种抗体群获得的抗体的特性,不能理解为需要通过任何特定方法来制备所述抗体。
[0131]
本文所用术语“柔性氨基酸序列”是指由侧链较小的氨基酸组成的一段连接多肽,用于防止或降低其两端的结构域之间在空间构象上的相互干扰,其序列包括但不限于ggsggs、gsggsgg、gsggsggg、ggggsggg、gsgsg、ggsgg、ggs、ggsgs和gggs。
[0132]
本文所用术语“免疫细胞”包括具有造血的起源并在免疫应答中起作用的细胞。免疫细胞包括:淋巴细胞,例如淋巴b细胞和淋巴t细胞;天然杀伤细胞;髓样细胞,例如单核细胞、巨噬细胞、嗜曙红细胞、肥大细胞、嗜碱细胞和粒细胞。
[0133]
本文所用术语“约”是指数值在由本领域一般技术人员所测定的具体值的可接受误差范围内,所述数值部分取决于怎样测量或测定(即测量体系的限度)。例如,在本领域每一次实行中“约”可意味着在1内或超过1的标准差。或者,“约”或“基本上包含”可意味着至多20%的范围。此外,特别对于生物学系统或过程而言,该术语可意味着至多一个数量级或数值的至多5倍。除非另外说明,否则当具体值在本技术和权利要求中出现时,“约”或“基本上包含”的含义应该假定为在该具体值的可接受误差范围内。
[0134]
当提及配体/受体、抗体/抗原或其他结合对时,“特异性”结合是指在蛋白和/或其他生物试剂的异质群体中确定是否存在所述蛋白例如pd-1的结合反应。因此,在所指定的条件下,特定的配体/抗原与特定的受体/抗体结合,并且并不以显著量与样品中存在的其他蛋白结合。
[0135]
当用“给予”和“治疗”提及动物、人、实验对象、细胞、组织、器官或生物液时,是指将外源性药物、治疗剂、诊断剂或组合物与动物、人、受治疗者、细胞、组织、器官或生物液接触。“给予”和“治疗”可指例如治疗方法、药动学方法、诊断方法、研究方法和实验方法。治疗细胞包括让试剂与细胞接触以及让试剂与流液接触,其中所述流液与细胞接触。“给予”和“治疗”还意味着例如通过试剂、诊断剂、结合组合物或通过其他细胞对细胞进行体外和离体治疗。
[0136]“有效量”包括足以改善或防止医学疾病的症状或病症的量。有效量还意指足以使得可以诊断或促进诊断的量。对具体受治疗者的有效量可视多种因素而变化,例如待治疗的疾病、患者的整体健康状况、给药的方法途径和剂量及副作用的严重性。有效量可为避免显著副作用或毒性作用的最大剂量或给药方案。单克隆抗体制备,可将本发明所涉及到抗体dna置于表达载体中,然后将载体转染到宿主细胞中以在重组宿主细胞中实现单克隆抗体的合成,所述宿主细胞例如有大肠杆菌细胞、中国仓鼠卵(cho)细胞或不会另外产生免疫
球蛋白的骨髓瘤细胞。抗体的重组制备将在下文更详细地阐述。
[0137]
合适的给药途径包括胃肠外给药(例如肌肉注射、静脉内或皮下给药)及口服给药。可按多种常规方式给予用于药物组合物或用于实践本发明方法的抗体,这些方法例如有经口摄取、吸入、局部施用或经皮肤、皮下、腹膜内、胃肠外、动脉内或静脉内注射。人们可以以局部而非全身方式(通常为长效制剂或缓释制剂)给予抗体,例如经由将抗体直接注射到作用位点。此外,人们可在靶向药物递送系统中给予抗体。
[0138]
本文所用“抑制”或“治疗(treat或treatment)”包括延缓与疾病有关的症状的发展和/或减轻所述疾病将要或预期发展的这些症状的严重程度。所述术语还包括减缓已有症状、防止另外的症状和减缓或防止这些症状的潜在原因。因此,所述术语表示业已将有益结果赋予患有疾病的脊椎动物对象。
[0139]
本文所用术语“治疗有效量”或“有效量”是指当将抗体或其片段单独给予或与另外的治疗剂联合给予细胞、组织或受治疗者时,其有效防止或减缓待治疗的疾病或病症的量。治疗有效剂量进一步指所述化合物足以导致症状减缓的量,所述减缓症状例如为治疗、治愈、防止或减缓相关医学状态,或提高对所述病征的治疗率、治愈率、防止率或减缓率。当施用给个体单独给予的活性成分时,治疗有效量是指该单独的成分。当施用组合时,治疗有效量是指产生治疗效果的活性成分的联合的量,而不论其实联合给予、连续给予还是同时给予。治疗有效量将减轻症状通常至少10%;通常至少20%;优选至少约30%;更优选至少40%和最优选至少50%。
[0140]
本发明药物组合物还可含有其他药剂,包括但不限于细胞毒剂、细胞生长抑制剂、抗血管形成药物或抗代谢药物、靶向肿瘤药物、免疫刺激剂或免疫调节剂或与细胞毒剂、细胞生产抑制剂或其它毒性药物缀合的抗体。也可与其它治疗形式(例如手术、化疗及放射疗法)一起施用所述药物组合物。
[0141]
本发明抗体的治疗应用如下:
[0142]
与人pd-1/l1及ctla4特异性结合的本发明抗体可用于增加、提高、刺激或上调免疫应答。本发明抗体尤其适用于治疗罹患可通过提高t细胞介导的免疫应答来治疗的疾病的受治疗者。优选的受治疗者包括需要提高免疫应答的人患者。
[0143]
癌症,本发明抗体可用于治疗癌症(即抑制肿瘤细胞的生长或存活)。可用本发明抗体抑制其生长的优选的癌症包括通常对免疫疗法有反应的癌症,但还包括迄今与免疫疗法尚无关联的癌症。用于治疗的优选癌症的非限制性实例包括黑素瘤(例如恶性转移性黑素瘤)、肾癌(例如透明细胞癌)、前列腺癌(例如激素难控制的前列腺腺癌)、胰腺腺癌、乳腺癌、结肠癌、肺癌(例如非小细胞肺癌)、食道癌、头颈鳞状细胞癌、肝癌、卵巢癌、宫颈癌、甲状腺癌、胶质母细胞瘤、神经胶质瘤、白血病、淋巴瘤和其它恶性肿瘤。另外,本发明包括可用本发明抗体抑制其生长的难治性或复发性癌。
[0144]
本发明抗体可单独使用或与以下其它物质联合使用:抗肿瘤药或免疫原剂(例如减弱的癌细胞、肿瘤抗原(包括重组蛋白质、肽和糖类分子)、抗原呈递细胞例如用来源于肿瘤的抗原或核酸刺激的树突细胞、免疫刺激细胞因子(例如il-2、ifna2、gm-csf)和用编码免疫刺激细胞因子(例如但不限于gm-csf)的基因转染的细胞);标准癌症治疗(例如化疗、放疗或手术);或其它抗体(包括但不限于针对以下物质的抗体:vegf、egfr、her2/neu、vegf受体、其它生长因子受体、cd20、cd40、ctla-4、ox-40、4-ibb和icos)。
[0145]
免疫低下性疾病,本发明抗体还可用于防止或治疗免疫低下疾病。抗体可单独使用,或与药物联合使用,以刺激针对病原体、多聚体的免疫应答。抗体可用于刺激对感染人的病毒的免疫应答,这些病毒例如但不限于人免疫缺陷病毒、甲、乙、丙型肝炎病毒、爱泼斯坦巴尔病毒、人巨细胞病毒、人乳头瘤病毒、疱疹病毒。抗体可用于刺激对细菌或真菌寄生虫及其它病原体引起的感染的免疫应答。抗体可用于刺激对体内多聚体的免疫应答和去除,治疗老年痴呆等疾病。
[0146]
本发明所涉及到的抗体针对靶点包括但不限于pd-l1、pd-1、ctla4、tnf-α、pcsk9、ngf、c5、aβ、il-6、il-17a、il23a、hgf、cmet、notch1、ccl11、il6r、il-31r、il-1b、il-20、cd40、cd47、dkk1/2、tigit、4-1bb、igf-1r、ll4、pdgfr2、her3、igf1/2、rankl、sclerostin、gcgr、cgrp、angptl3、il-13、il-4r、csf-1r、tfpi、fcgrt、cd47等,可用于治疗癌症、哮喘、自身免疫疾病、偏头痛、老年痴呆、高血脂症、骨关节炎、丛集性头痛、骨质疏松等疾病。
[0147]
实施例1低adcc/cdc功能的降低免疫原性的pd-l1单抗的分析及设计
[0148]
本发明利用pymol软件对基因泰克(genentech)公司的atezolizumab的结构进行分析,在抗体可变区与恒定区之间寻找相对柔性的区域,并在相应区域插入柔性氨基酸序列,切断抗体可变区结合抗原后产生的机械应力传递,使抗体药重链恒定区与fc受体和/或结补体合位点不能充分暴露出来,弱化抗体药与nk细胞、巨噬细胞和中性粒细胞等表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号。
[0149]
具体是在基因泰克(genentech)公司的atezolizumab抗体药的297位氨基酸a突变回n恢复糖基化的基础上,在igg1抗体重链cdr3与ch2区之间插入一段柔性氨基酸序列来阻断抗体结合抗原后抗体可变区及恒定区间的应力传递,从而达到在降低adcc/cdc功能的同时不显著增加多聚体形成。原始atezolizumab序列的重链全长和轻链可变区的氨基酸序列分别如seq id no.1、2所示。
[0150]
本发明提供的低免疫原性抗pd-l1单克隆抗体,其重链的氨基酸序列为seq id no.3、4所示,其轻链的氨基酸序列为seq id no.2,分别命名为h-1l0、h-2l0。
[0151]
根据已知的抗体重链糖基化信息,本发明对相应修改后的序列进行全基因合成,对合成的基因进行测序同时选择测序正确的序列进行下一步操作,将轻链设计酶切位点为ecor i+hind iii,重链设计酶切位点为ecor i+hind iii,分别与表达载体pee6.4及pee12.4载体连接,同时转化大肠杆菌dh5α,得到抗体重链、轻链表达载体。同时对构建的抗体进行测序和序列对比,改造后的pd-l1单抗与原始atezolizumab抗体重链的序列比对结果见图1。
[0152]
实施例2低adcc/cdc功能的pd-1单抗的分析及设计
[0153]
本发明对美国默克(merck)公司pembrolizumab进行改造,首先将其重链亚型由igg4变更为igg1,利用pymol软件进行结构分析,在抗体可变区与恒定区之间寻找相对柔性的区域,并在相应区域插入柔性氨基酸序列,对相应序列进行基因合成,测序,选择测序正确的序列,筛选得到单抗h1l0。本发明尝试在原始igg1亚型抗体重链的cdr3与ch2区之间插入一段柔性氨基酸序列,所插入的柔性氨基酸序列,阻断了抗体可变区结合抗原后产生的机械应力传递,使抗体重链恒定区与fc受体和/或补体结合位点不能充分暴露出来,弱化抗体与nk细胞、巨噬细胞和中性粒细胞表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号。柔性氨基酸序列由侧链较小的氨基酸组成的一段连接多肽,
用于防止或降低其两端的结构域之间在空间构象上的相互干扰,其序列包括但不限于ggsggs、gsggsgg、gsggsggg、ggggsggg、gsgsg、ggsgg、ggs、ggsgs和gggs。按照本发明所述方法进行改造后重链的氨基酸序列如seq id no.7所示。
[0154]
本发明对相应修改后的序列进行全基因合成,对合成的基因进行测序同时选择测序正确的序列进行下一步操作,将轻链设计酶切位点为ecor i+hind iii,重链设计酶切位点为ecor i+hind iii,分别与表达载体pee6.4及pee12.4载体连接,同时转化大肠杆菌dh5α,得到抗体重链、轻链表达载体。同时对构建的抗体进行测序和序列比对,改造后的pd-1单抗与原始pembrolizumab抗体重链的序列比对结果见图9。
[0155]
实施例3低adcc/cdc功能的ctla4单抗的分析及设计
[0156]
本发明对美国百时美施贵宝(bms)公司ipilimumab进行改造,利用pymol软件进行结构分析,在抗体可变区与恒定区之间寻找相对柔性的区域,并在相应区域插入柔性氨基酸序列,对相应序列进行基因合成,测序,选择测序正确的序列,筛选得到单抗h1l0。本实施例尝试在ipilimumab单抗igg1亚型抗体重链的cdr3与ch2区之间插入一段柔性氨基酸序列,所插入的柔性氨基酸序列,阻断了抗体可变区结合抗原后产生的机械应力传递,使抗体重链恒定区与fc受体和/或补体结合位点不能充分暴露出来,弱化抗体与nk细胞、巨噬细胞和中性粒细胞表达igg fc受体的杀伤细胞结合或和补体结合,无法或降低诱导adcc和cdc的信号。柔性氨基酸序列由侧链较小的氨基酸组成的一段连接多肽,用于防止或降低其两端的结构域之间在空间构象上的相互干扰,其序列包括但不限于ggsggs、gsggsgg、gsggsggg、ggggsggg、gsgsg、ggsgg、ggs、ggsgs和gggs。改造后重链的氨基酸序列如seq id no.10所示。
[0157]
本发明对相应修改后的序列进行全基因合成,对合成的基因进行测序同时选择测序正确的序列进行下一步操作,将轻链设计酶切位点为ecor i+hind iii,重链设计酶切位点为ecor i+hind iii,分别与表达载体pee6.4及pee12.4载体连接,同时转化大肠杆菌dh5α,得到抗体重链、轻链表达载体。同时对构建的抗体进行测序和序列比对,改造后的ctla4单抗与原始ipilimumab抗体重链的序列比对结果见图13。
[0158]
实施例4改良型抗体的adcc功能验证
[0159]
为了评估本发明中抗体的adcc功能,本发明通过检测fcr-tank细胞对靶蛋白(pd-l1、pd-1、ctla4)过表达细胞的杀伤能力来评价抗体adcc活性。
[0160]
以pd-l1抗体的adcc活性检测为例:使用靶蛋白过表达细胞用cfse染色后,将细胞密度调整至6
×
105/ml,将改良型抗体(h-1l0,h-2l0)与atezolizumab以及阳性对照抗体imm25(购自宜明昂科公司)以一定比例梯度(最高浓度为4μg/ml,用培养基三倍稀释12个梯度)进行稀释,同时对fcr-tank细胞进行计数并将细胞密度调整至6
×
105/ml;将抗体、靶细胞和效应细胞共孵育:取上述不同稀释梯度的抗体各50μl,靶细胞50μl,fcr-tank细胞100μl加入到96孔板中,每个梯度进行复孔操作,同时设置空白对照(培养基150μl+靶细胞50μl及培养基50μl+靶细胞50μl+fcr-tank细胞100μl)。于37℃,5%co2条件下孵育4h。孵育结束后,将细胞培养板于室温放置10min,加入pi染色液(终浓度为5μg/ml)并混合均匀。流式细胞术分析不同浓度下细胞pi染色阳性率,进而计算抗体介导的adcc强度,计算公式为adcc%=【(sample%pi positive cell-no antibody%pi positive cell)/(100-no antibody%pi positive cell)】
×
100,并绘制adcc%与浓度的关系曲线。
[0161]
本发明改造后的pd-l1单抗与原研药atezolizumab抗体adcc活性实验显示,本发明的两个pd-l1单抗h-1l0、h-2l0与原研药atezolizumab抗体的adcc活性一致,见图3。由于h-1l0及h-2l0均证明去除了adcc效应,因此后续研究主要使用h-1l0同原研药atezolizumab进行对比验证。
[0162]
本发明改造后的pd-1单抗与原研药pembrolizumab抗体adcc活性实验显示,本发明的改造后pd-1单抗h1l0的adcc活性消失,而原研药pembrolizumab抗体存在较弱的adcc活性,见图11。
[0163]
本发明改造后的ctla4单抗与原研药ipilimumab抗体adcc活性实验显示,本发明的ctla4单抗h1l0的adcc活性消失,而原研药ipilimumab抗体的adcc活性正常,见图15。
[0164]
实施例5改良型抗体的亲和力评价
[0165]
对实施例1-3构建的载体进行质粒大提工作,选取qiagen的无内毒素质粒大提试剂盒;对选取的质粒进行优化组合,同时利用cho细胞进行瞬时转染表达,基于蛋白质的elisa实验用于测定表观结合亲和力(报告为ec
50
值)。比较改良型抗体与原研抗体的结合能力。
[0166]
蛋白质elisa用于测定抗体与人pd-l1的相对结合。通过4℃过夜将pd-l1固定化在酶标版上,通过与含3%bsa的pbs室温孵育1小时来阻断非特异性结合位点。包被后,用pbs洗涤所述板,并制备抗pd-l1抗体的稀释液,将其与固定化的蛋白在25℃下孵育1小时。结合后用pbs洗涤所述板3次,在25℃下用含稀释至1/2000的过氧化物酶标记的山羊抗人igg的结合缓冲液孵育1小时,再次洗涤后使用tmb显色。elisa结果示于图2中。用半最大结合浓度表示相对结合亲和力的量值。对表达的抗体进行亲和力和ec50检测(见表1),亲和力elisa结果显示h-1l0与pd-l1的亲和力同原研药atezolizumab抗体相近,见图2。
[0167]
表1抗体亲和力评价结果
[0168]
mabec
50
(pm)atezolizumab320.3h-1l0219.4
[0169]
蛋白质elisa用于测定抗体与人pd-1的相对结合。通过4℃过夜将pd-1固定化在酶标版上,通过与含3%bsa的pbs室温孵育1小时来阻断非特异性结合位点。包被后,用pbs洗涤所述板,并制备抗pd-1抗体的稀释液,将其与固定化的蛋白在25℃下孵育1小时。结合后用pbs洗涤所述板3次,在25℃下用含稀释至1/2000的过氧化物酶标记的山羊抗人igg的结合缓冲液孵育1小时,再次洗涤后使用tmb显色。elisa结果示于图10中。用半最大结合浓度表示相对结合亲和力的量值。对表达的抗体进行亲和力和ec50检测(见表2),亲和力elisa结果显示h1l0与pd-1的亲和力同原研药pembrolizumab抗体相近,见图10。
[0170]
表2抗体亲和力评价结果
[0171]
mabec
50
(pm)pembrolizumab54.5h1l043.7
[0172]
蛋白质elisa用于测定抗体与人ctla4的相对结合。通过4℃过夜将pd-1固定化在酶标版上,通过与含3%bsa的pbs室温孵育1小时来阻断非特异性结合位点。包被后,用pbs洗涤所述板,并制备抗ctla4抗体的稀释液,将其与固定化的蛋白在25℃下孵育1小时。结合
后用pbs洗涤所述板3次,在25℃下用含稀释至1/2000的过氧化物酶标记的山羊抗人igg的结合缓冲液孵育1小时,再次洗涤后使用tmb显色。elisa结果示于图14中。用半最大结合浓度表示相对结合亲和力的量值。对表达的抗体进行亲和力和ec50检测(见表3),亲和力elisa结果显示h1l0与ctla4的亲和力同原研药ipilimumab抗体相近,见图14。
[0173]
表3抗体亲和力评价结果
[0174]
mabec
50
(pm)ipilimumab155.0h1l0134.9
[0175]
实施例6改良型pd-1、pd-l1抗体的生物活性检测
[0176]
本方法基于两种细胞系,cho-pd-l1-cd3l细胞系及jurkat-pd-1-nfat细胞系。cho-pd-l1-cd3l细胞系稳定表达pd-l1和anti-cd3-scfv,作为靶细胞;jurkat-pd-1-nfat细胞系稳定表达pd-1和荧光素酶(luciferase),荧光素酶基因受nfat元件(转录因子)调控(il-2启动子),作为效应细胞。pd-1与pd-l1结合可以阻断cd3下游信号的转导,从而抑制荧光素酶的表达,当加入pd-1抗体或者pd-l1抗体时,这种block效应被反转,荧光素酶可以表达,从而检测到荧光信号。具体实验步骤如下:
[0177]
1、细胞培养:jurkat-pd-1-nfat细胞使用含有10%fbs,1%neaa以及抗生素的rpmi1640培养基;cho-pd-l1-cd3l细胞使用含有10%fbs,1%neaa以及抗生素的dmem或f12培养基。
[0178]
2、细胞接种:cho-pd-l1-cd3l细胞以50000个/孔接种于96孔板中,在37℃,5%co2条件下培养12-14小时。之后去除培养基后,将含有100000个jurkat-pd-1-nfat细胞的50μl分析培养液(含有2%fbs的rpmi1640培养基)加入各孔。
[0179]
3、抗体条件筛选:将本发明改造抗体或原研抗体药从10μg/ml浓度以1:3的比例梯度稀释(使用分析培养液)。之后将稀释后的抗体加入各孔,并于37℃,5%co2孵育6小时。
[0180]
4、加入100μl荧光底物(promega bio-glotm luciferase assay)并用荧光光度计(spectramax m5)计算相对荧光素酶活性单位。
[0181]
结果显示本发明改造pd-l1抗体h-1l0与原研药atezolizumab抗体生物活性对比显示h-1l0与原研atezolizumab抑制pd-1/pd-l1效果相近(如图4),绘制表格并计算抗体抑制pd-1、pd-l1的ic50数值如表4所示。
[0182]
表4抗体抑制力评价结果
[0183]
mabic
50
(nm)atezolizumab1.988h-1l01.945
[0184]
结果显示本发明改造pd-1抗体h1l0与原研药pembrolizumab抗体生物活性对比显示h1l0和原研pembrolizumab抑制pd-1/pd-l1效果相近(如图12),绘制表格并计算抗体抑制pd-1、pd-l1的ic50数值如表5所示。
[0185]
表5抗体抑制力评价结果
[0186]
mabic
50
(nm)pembrolizumab1.986
h1l01.943
[0187]
实施例7改良型ctla4抗体抑制ctla4与cd80或cd86结合活性验证及竞争性实验
[0188]
使用elisa方法检测本发明单抗抑制ctla4与cd80或cd86结合效率。通过4℃过夜将hcd80或hcd86固定化在酶标版上,通过与含3%bsa的pbs室温孵育1小时来阻断非特异性结合位点。包被后,用pbs洗涤所述板,并制备抗ctla4抗体与biotin-ctla4混合稀释液(biotin-ctla4为1μg/ml的固定浓度,本发明抗ctla4抗体梯度稀释,最高浓度为1μg/ml,最低浓度为0),将其与固定化的蛋白在25℃下孵育1小时。结合后用pbs洗涤所述板3次,在25℃下用含稀释至1/8000的过氧化物酶标记的亲和素的结合缓冲液孵育1小时,再次洗涤后使用tmb显色。elisa结果示于图16中,显示本发明的ctla4单抗能够抑制ctla4与cd80或cd86的结合。
[0189]
本发明使用celisa方法来评估抗体与cd80及cd86竞争结合人ctla4转染的cho细胞的效果。首先构建表达hctla4的cho细胞,在50μl培养及中将cho-hctla4细胞培养到80%-100%覆盖度。之后加入50μl含有固定浓度(1μg/ml)biotin-cd80或biotin-cd86及不同稀释浓度(最高浓度为1μg/ml,最低浓度为0,梯度稀释)的抗ctla4抗体的混合培养基,在37℃孵育1小时。之后用pbs洗涤3次后,加入100μl的1/8000稀释比例的过氧化物酶标记的亲和素,于37℃孵育1小时。再用pbs洗涤数次后使用tmb显色。elisa结果示于图17中。
[0190]
实施例8改良型pd-l1抗体及原研atezolizumab抗体小鼠体内免疫原性评价
[0191]
将改良型抗体h-1l0及原研atezolizumab分别免疫小鼠评价小鼠产生ada的滴度。使用balb/c小鼠进行分组实验,每组5只,具体免疫方法如下:1)基础免疫:将抗原与福氏完全佐剂等体积混合并充分乳化,分点皮下注射。2)加强免疫:加强免疫采用抗原与福氏不完全佐剂的乳化液。每只balb/c小鼠总注射量为70μg。
[0192]
对免疫后小鼠分别取免疫前、免疫后7天、免疫后14天、免疫后21天血清,评价小鼠ada的滴度,结果见图5。结果显示本发明生产的单克隆抗体h-1l0在小鼠体内的ada滴度比atezolizumab降低了80%。
[0193]
实施例9改良型pd-l1抗体的稳定细胞株构建及小试表达
[0194]
对本发明改造的pd-l1抗体及原研atezolizumab抗体同时进行cho稳定细胞库的构建并按照本领域公知的抗体药物生产规范对改良pd-l1抗体及原研atezolizumab进行了5g的小试表达及纯化。并对获得的抗体进行了hplc-sec的对比,见图6a和图6b。原研atezolizumab及改良型pd-l1抗体h-1l0的上样量(50μl)及浓度(60mg/ml)均相同。从图中可见,在上样量相同的情况下,原研atezolizumab抗体的主峰面积较改良型pd-l1抗体h-1l0减少了近10%,因此,可以判断原研atezolizumab中多聚体含量较多,因此在进行hplc-sec上样时,多聚体被滤膜除去而导致峰面积下降。两个抗体的hplc-sec的峰面积计算结果见表6。同时,hplc-sec结果显示改良型pd-l1抗体h-1l0出峰位置较原研atezolizumab靠前,可以判断是由于恢复了抗体的糖基化导致抗体的分子量增大,进而出峰位置更为靠前。
[0195]
表6抗体hplc-sec结果
[0196]
[0197][0198]
实施例10改良型pd-l1抗体的糖型分析
[0199]
基于实施例9得到的结果,进一步将改良型pd-l1抗体进行了糖型的验证。主要采用该领域公知的方法进行:将抗体上的寡糖进行酶切及收集后,利用质谱的方式进行糖型的分析及鉴定。经鉴定原研atezolizumab未检测到n糖修饰,而改良型pd-l1抗体是正常糖基化修饰,见图7。改良型pd-l1抗体的糖型分析结果如表7所示。
[0200]
表7改良型pd-l1抗体糖型分析结果
[0201][0202]
实施例11改良型pd-l1抗体及原研atezolizumab抗体的稳定性验证
[0203]
对本发明改造的pd-l1单抗及原研atezolizumab抗体进行稳定性的对比验证。将改良性pd-l1抗体及原研atezolizumab抗体同时进行快速热处理,并验证其稳定性主要操作流程如下:
[0204]
将两个不同抗体分别取等量体积,并在4℃静置10小时后取小样;第一次取样后,将两个抗体放入60℃恒温水浴10分钟,观察外观变化并第二次取小样;取样后将两个抗体于4℃,10000rpm离心5分钟,观察离心管管底是否出现肉眼可见的沉淀,并再次对上清取样;对第三次取样后的上清使用0.2μm的滤膜进行过滤处理后,再次取样;取样完成后,将过滤后的上清放置于4℃下,持续观察;对所有获得的样本进行抗体浓度及抗体结合pd-l1能力的检测。
[0205]
改良型pd-l1抗体及原研atezolizumab的结合pd-l1能力的elisa检测结果见图8,两个抗体各样本浓度数据见表8。可见改良型pd-l1抗体较原研atezolizumab稳定性更好。
[0206]
表8改良型pd-l1抗体糖型分析结果
[0207]
[0208][0209]
可见,本发明筛选得到针对多个不同靶点的改良型去adcc功能单抗,它们既保持了原有与靶蛋白结合的亲和力,同时去除了其adcc功能,可特异性地阻断靶蛋白与其相应配体的结合。同时对于改良型pd-l1抗体,通过利用本发明的去adcc功能方法,不仅达到了去除adcc效应的目的,又解决了原研抗体药由于改造导致的多聚体含量较高、免疫原性强的问题。
[0210]
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1