红豆杉转录因子TcMYB29在调控红豆杉愈伤中紫杉醇生物合成中的应用
红豆杉转录因子tcmyb29在调控红豆杉愈伤中紫杉醇生物合成中的应用
技术领域
1.本发明属于生物技术领域,特别涉及一种红豆杉转录因子tcmyb29的新用途。
背景技术:
2.红豆杉(taxus sp.)又称紫杉,是红豆杉科红豆杉属的常绿乔木或灌木。红豆杉属植物在全世界约有11个种200多个栽培种,我国有4个种、1个变种和1个杂交种,即东北红豆杉、喜马拉雅红豆杉、云南红豆杉、中国红豆杉、变种南方红豆杉和杂交种曼地亚红豆杉等。红豆杉是珍贵的用材树种并具有较高的园艺观赏价值,同时还具有很高的药用价值。红豆杉中的抗癌活性成分紫杉醇能够有效抑制癌细胞的增生繁殖,是治疗癌症的珍贵药物。但红豆杉生长缓慢,且紫杉醇含量极低,因此在不破坏野生森林资源的前提下,利用现代生物技术手段提高紫杉醇产量具有重要意义。
3.myb转录因子家族,含有myb结构域,是植物中描最大的转录因子家族之一。很多研究表明,myb转录因子在调控植物数量的生物过程中发挥着重要作用,包括植物的生长、发育和胁迫响应、初级和次级代谢。
技术实现要素:
4.本发明的目的是提供一种红豆杉转录因子tcmyb29在调控红豆杉愈伤中紫杉醇生物合成中的应用,以提高红豆杉愈伤中紫杉醇的产量。
5.为实现上述目的,本发明采用如下技术方案:
6.红豆杉转录因子tcmyb29在调控红豆杉愈伤中紫杉醇生物合成中的应用。
7.进一步的,所述红豆杉转录因子tcmyb29基因调控紫杉醇生物合成基因t5oh的转录。
8.进一步的,所述红豆杉转录因子tcmyb29结合紫杉醇生物合成基因t5oh的启动子上的b1位点。
9.进一步的,所述红豆杉转录因子tcmyb29通过myb基序直接结合t5oh的启动子。
10.进一步的,所述红豆杉转录因子tcmyb29基因过表达转基因红豆杉愈伤紫杉醇含量增加。
11.有益效果:tcmyb29转基因红豆杉愈伤能够显著提高愈伤中紫杉醇含量,经过一系列实验分析发现,tcmyb29能够调控紫杉醇生物合成基因t5oh的转录。本发明挖掘了tcmyb29的功能,对基因工程技术提高紫杉醇含量提供了重要的理论依据,具有广阔的应用前景。
附图说明
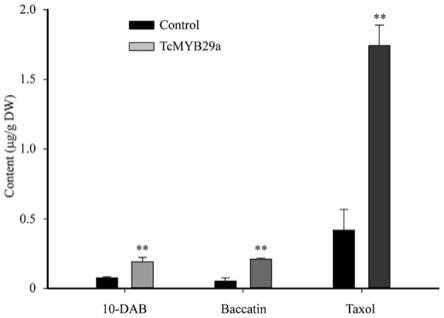
12.图1为转tcmyb29和空白质粒愈伤中紫杉醇及中间代谢物含量;
13.图2为t5oh启动子上的预测到的两个可能的myb29结合位点;
14.图3为chip实验验证t5oh启动子上两个位点与是否与tcmyb29蛋白结合;
15.图4为emsa实验验证t5oh启动子上b1位点与tcmyb29蛋白的结合。
具体实施方式
16.下面结合实施例对本发明做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。
17.以下实施例通过分子生物学、生物化学、遗传学等手段验证tcmyb29能够直接结合紫杉醇生物合成相关基因的启动子并促进其转录,从而调控紫杉醇的生物合成。
18.实施例1:
19.红豆杉转录因子tcmyb29的生物学功能验证
20.以过表达空质粒红豆杉愈伤,过表达35s:tcmyb29愈伤为材料,冷冻干燥后用甲醇进行提取,用lc-ms测定其中10-dab,巴卡亭及紫杉醇含量,结果过表达35s:tcmyb29愈伤中10-dab,巴卡亭及紫杉醇含量都显著提高,如图1。
21.实施例2:tcmyb29调控紫杉醇生物合成相关基因转录活性的验证:
22.(1)紫杉醇相关生物合成基因序列分析
23.根据基因步移及红豆杉基因组序列分析获得紫杉醇生物合成途径中的t5oh基因启动子区2000bp的序列,找到t5oh基因2000bp启动子区内存在2个可能的myb结合位点(cngttr)如图2所示。
24.(2)chip-qpcr实验验证tcmyb29结合紫杉醇生物合成基因t5oh的启动子采用过表达35s:tcmyb29:gfp的红豆杉愈伤进行chip实验,实验步骤参照文献(yoo et al.2010)。采用gfp标记特异性单克隆抗体进行chip分析。chip产物通过qpcr进行dna分析。两对引物(f1和r1,f2和r2)分别用于扩增150bp左右带可能的myb结合位点的片段(图2中r-3和r-4片段),另外一对引物(f3和r3)用于扩增远离两个结合位点的150bp左右的cds区片段(图2中的cds-2片段)。chip-qpcr结果分析如图3所示,表明tcmyb29结合紫杉醇生物合成基因t5oh的启动子上的b1位点。
25.正向引物f1:5'-acaattcttctcaccccctgccat-3'
26.反向引物r1:5'-ggtagcgctaaaggtgggggaa-3'
27.正向引物f2:5'-gtatccattgcattacccacgtgc-3'
28.反向引物r2:5'-ccaaggtcatttcaaacgttagattccat-3'
29.正向引物f3:5'-agatgtcgtggcccgctcaa-3'
30.反向引物r3:5'-agcgcaccagggccgaaaaa-3'
31.(3)emsa实验验证tcmyb29直接结合紫杉醇生物合成基因t5oh的启动子
32.(3.1)纯化带有gst标签的tcmyb29蛋白:将tcmyb29的orf连入带有gst标签的质粒转化大肠杆菌rosetta中,挑取单克隆于5ml含氨苄抗生素的液体lb培养基中,37℃震荡过夜。将活化好的菌液按1:100的比例接入新的含氨苄抗生素的液体lb培养基中,37℃震荡,培养至菌液od值为0.5时,加入iptg至终浓度0.5mm,然后转入18℃120rpm震荡培养14h。4000rpm,4℃离心10min,收集菌体,弃掉上清,用column buffer悬浮,大约500ml菌液加入10ml column buffer,加入pmsf至终浓度为1mm,冰上放置30min。将悬浮好的菌液进行超声
波破裂,加入终浓度为1%的tritionx-100,12000rpm,4℃离心1h,留上清。将洗好的gst的beads与上清共同4℃孵育2-3h,然后1000rpm,4℃离心2min,留下beads,再将beads用wash buffer清洗7-8次,然后加入到淋洗液中,孵育30min。加入1
×
loading buffer,煮沸5min,高速离心10min;上样,进行sds-page电泳;电泳结束后,考马斯亮蓝染色进行检测。
33.(3.2)根据t5oh(正向引物f4与反向引物r4、正向引物f5与反向引物r5)启动子区的myb基序(图2中的r-2片段)设计相应的结合探针与突变探针,参照购买自碧云天公司的emsa探针生物素标记试剂盒的操作手册标记生物素探针。
34.(3.3)然后参照购买自碧云天公司的化学发光法emsa试剂盒的操作手册进行实验。结果如图2所示,tcmyb29可以通过myb基序直接结合t5oh的启动子。
35.正向引物f4:
36.5'-tacaatcccccgagtactcccccctccgttaagttaagcatcctcctcttccccca-3'
37.反向引物r4:
38.5'-tgggggaagaggaggatgcttaacttaacggaggggggagtactcgggggattgta-3'
39.正向引物f5:
40.5'-tacaatcccccgagtactcccccctccgaatagttaagcatcctcctcttccccca-3'
41.反向引物r5:
42.5'-tgggggaagaggaggatgcttaactattcggaggggggagtactcgggggattgta-3'
43.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1