TRPV1在筛选或制备预防、缓解和/或治疗肝脏疾病的药物中的应用的制作方法
trpv1在筛选或制备预防、缓解和/或治疗肝脏疾病的药物中的应用
技术领域
1.本发明涉及基因的功能和应用领域,具体涉及trpv1在筛选或制备预防、缓解和/或治疗肝脏疾病的药物中的应用。
背景技术:
2.肝脏是身体内以代谢功能为主的一个器官,具有非常复杂的生理、生化功能,包括去氧化、储存肝糖、分泌性蛋白质的合成等作用。常见的肝病包括病毒性肝炎、非酒精性脂肪性肝病、酒精性脂肪肝、自身免疫性肝病等,由这些疾病引起的肝损伤以及导致肝纤维化,甚至进展成肝硬化、肝癌是影响人类健康的重要病因,严重威胁人体的身体健康。
3.随着人们生活习惯的改变,脂肪性肝病近年来发病率呈逐年攀升的趋势,随病程进展可发展成肝纤维化、肝硬化、肝癌等,已成为近十年来影响公众健康的全球广泛分布性疾病。脂肪肝可以分为酒精性脂肪肝病(ald)和非酒精性脂肪性肝病(nafld),其中,非酒精性脂肪性肝病是以肝细胞脂肪过度沉积为主要病理特征的一种临床综合征,随着病程的发展,脂肪肝的肝细胞的损伤逐渐加重,可发展为非酒精性脂肪性肝炎(nash)、肝硬化和肝细胞癌(hcc),严重威胁着人类的健康。
4.肝纤维化是大多数慢性肝病的共同病理过程,是各种慢性肝病向肝硬化演变的中间环节。近年来,肝纤维化的发病率居高不下,肝纤维化如不及时治疗,严重者将导致肝硬化甚至肝癌,而肝硬化是临床上常见疾病和主要死亡原因之一,严重危害着国人的身体健康。已经证实,如果在病程早期肝纤维化阶段给予适当治疗不仅能够阻止病情的进一步发展,甚至可使肝纤维化逆转,对阻止慢性肝病向肝硬化进展有着积极的意义。
5.然而,目前尚无优质抗肝纤维化治疗的药物应用于临床,这意味着寻找有效的抗纤维化靶点是未来治疗肝纤维化的重要方向,因此,本领域亟需研究和寻找新的治疗靶点,以开发新型且安全性高的治疗肝损伤、肝纤维化等疾病的药物。
6.瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,trpv1)是瞬时受体感受器电位通道的成员之一,广泛分布在哺乳动物的组织和器官中,是一种非选择性阳离子通道,主要分布在感觉神经末梢,激活后可以释放多种神经递质,从而引发一系列生物学作用。近年来,随着对trpv1的深入研究发现,其具有血管保护作用和抗血管纤维化的作用,但在肝脏炎症、纤维化以及脂肪变中trpv1的作用尚未见到相关的研究报道。
技术实现要素:
7.为解决现有技术中,有效治疗肝纤维化等肝脏疾病的药物不多的问题,本发明的目的在于研究并确定trpv1基因的表达与肝纤维化等疾病之间的相互关系,并提供一种trpv1作为药物靶标或靶基因在筛选、制备治疗肝脏疾病的药物中的应用,为临床治疗肝纤维化等肝脏疾病提供新的思路和方法。
8.为了达到上述目的,本发明首先提供trpv1上调剂在制备预防、缓解和/或治疗肝脏疾病的药物中的应用。
9.所述的trpv1上调剂具有促进trpv1的mrna水平,或提高trpv1蛋白质活性或水平,或增强trpv1作用的效果。具体地,可以采用各种化学、物理、生物的方法达到前述目的,包括但不限于:
10.(1)调节trpv1代谢通路以提高trpv1表达水平;
11.(2)采用过表达方式来提高trpv1表达水平。
12.一种可能的实施方式中,调节trpv1代谢通路可以是采用trpv1激动剂来提高trpv1的活性或促进trpv1的转录或表达,从而上调trpv1水平;
13.促进trpv1转录或表达是指:使trpv1过表达,或者提高trpv1转录活性。本领域技术人员可以使用常规方法对trpv1转录或表达进行调控。
14.另一种可能的实施方式中,可通过转染trpv1过表达体系的形式提高trpv1表达水平;
15.进一步地,所述的trpv1过表达体系为通过慢病毒体系、腺病毒体系或质粒作为载体构建的trpv1蛋白过表达体系。
16.本发明另一方面还提供了trpv1作为药物靶标在筛选或制备预防、缓解和/或治疗肝脏疾病的药物中的应用。
17.优选地,所述的治疗肝脏疾病的药物是增强trpv1表达的药物;
18.优选地,本发明所述的肝脏疾病包括急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝。
19.相对于现有技术,本发明具有以下有益效果:
20.(1)本发明发现trpv1基因的新功能,即trpv1基因具有保护急性肝损伤、肝纤维化以及非酒精性脂肪肝、酒精性脂肪肝的作用。
21.(2)基于trpv1的此新功能,将trpv1作为药物靶点构建药物筛选模型,用于筛选预防、缓解和/或治疗肝脏炎症、肝纤维化等肝脏疾病的药物;另外,trpv1可作为基因治疗中的靶基因,设计并制备预防、缓解和/或治疗肝脏炎症、纤维化等肝脏疾病的药物或生物试剂,最终达到治疗相关肝脏疾病的目的。
附图说明
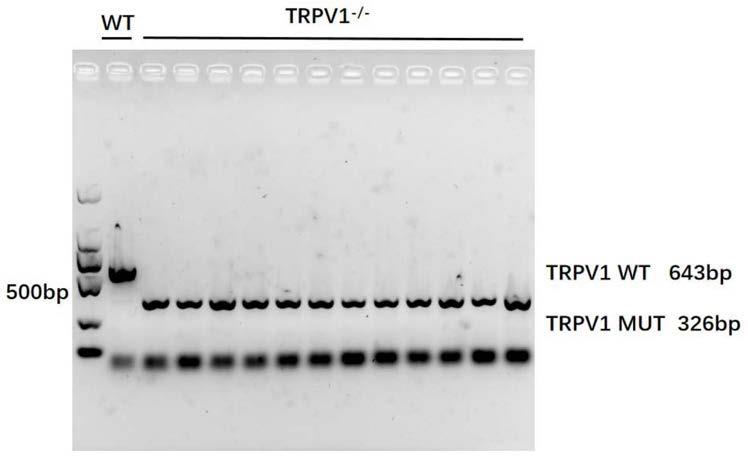
22.图1表示trpv1敲除小鼠的构建及鉴定结果图。
23.图2表示trpv1敲除对急性肝损伤的影响,其中:
24.a为wt和trpv1-/-小鼠的he染色图;
25.b为wt和trpv1-/-小鼠的血清alt检测结果;
26.c为wt和trpv1-/-小鼠的脾重、脾体比值等统计结果;
27.d为wt和trpv1-/-小鼠肝脏相关炎症因子的基因表达检测结果。
28.图3表示trpv1敲除对小鼠ccl4肝纤维化的影响,其中:
29.a为wt和trpv1-/-小鼠的病理染色图以及半定量分析结果;
30.b为wt和trpv1-/-小鼠肝脏相关纤维化指标的基因表达检测结果;
31.c为wt和trpv1-/-小鼠肝脏相关炎症因子指标的基因表达检测结果。
32.图4表示trpv1过表达对肝纤维化的影响,其中:
33.a为lv-con和lv-sma-trpv1小鼠的表达检测结果;
34.b为lv-con和lv-sma-trpv1小鼠trpv1和α-sma蛋白表达半定量分析结果;
35.c-d为lv-con和lv-sma-trpv1小鼠的肝脏天狼星红染色及统计结果、α-sma免疫组化检测及统计结果;
36.e为lv-con和lv-sma-trpv1血清alt、ast检测结果;
37.f为lv-con和lv-sma-trpv1小鼠肝脏相关纤维化指标的基因表达检测结果;
38.g为lv-con和lv-sma-trpv1小鼠肝脏相关炎症因子指标的基因表达检测结果。
39.图5表示trpv1敲除对mcd诱导的非酒精性脂肪肝的影响,其中:
40.a为wt和trpv1-/-小鼠的肝脏天狼星红染色及半定量分析结果;
41.b为wt和trpv1-/-小鼠的油红染色图以及半定量分析结果;
42.c为wt和trpv1-/-小鼠的血清alt、ast检测结果;
43.d为wt和trpv1-/-小鼠肝脏相关纤维化指标的基因表达检测结果;
44.e为wt和trpv1-/-小鼠肝脏相关炎症因子指标的基因表达检测结果;
45.f为wt和trpv1-/-小鼠α-sma的蛋白印迹及灰度分析统计结果。
46.图6表示trpv1过表达对mcd诱导的非酒精性脂肪肝的影响,其中:
47.a为lv-con和lv-sma-trpv1小鼠的肝脏天狼星红染色及半定量分析结果;
48.b为lv-con和lv-sma-trpv1小鼠的油红染色图以及半定量分析结果;
49.c为lv-con和lv-sma-trpv1小鼠的肝重、肝体比值及血清alt和ast检测结果;
50.d为lv-con和lv-sma-trpv1小鼠肝脏相关纤维化指标的基因表达检测结果;
51.e为lv-con和lv-sma-trpv1小鼠肝脏相关炎症因子指标的基因表达检测结果;
52.f为lv-con和lv-sma-trpv1小鼠α-sma的蛋白印迹及灰度分析统计结果。
53.图7表示trpv1敲除对cdaa诱导的非酒精性脂肪肝的影响,其中:
54.a为wt和trpv1-/-小鼠的肝脏天狼星红病理染色及半定量分析结果;
55.b为wt和trpv1-/-小鼠的肝脏α-sma免疫组化染色及半定量分析结果;
56.c为wt和trpv1-/-小鼠的肝脏tc和血清tg检测结果;
57.d为wt和trpv1-/-小鼠肝脏相关纤维化指标的基因表达检测结果;
58.e为wt和trpv1-/-小鼠肝脏相关炎症因子指标的基因表达检测结果;
59.f为wt和trpv1-/-小鼠α-sma的蛋白印迹检测及灰度分析统计结果。
60.图8表示trpv1在酒精性脂肪肝中的表达检测结果,其中:
61.a为对照组(pair-fed)组和酒精组(alcohol)组小鼠的trpv1染色图以及半定量分析结果;
62.b为pair-fed组和alcohol组小鼠trpv1及纤维化指标的基因表达检测结果;
63.c为pair-fed组和alcohol组小鼠trpv1的蛋白印迹检测结果。
具体实施方式
64.以下结合附图和实施例对本发明的技术方案做进一步的说明。
65.本技术的发明人在研究和分析临床肝活检基因芯片时发现:trpv1蛋白在肝纤维化组织中表达下调。基于此发现,本技术的发明人继续研究trpv1在肝纤维化等肝脏疾病中
的表达、分布、功能等,以trpv1基因过表达和敲除的c57/bl小鼠为实验对象,通过急性肝损伤模型、肝纤维化模型、非酒精性脂肪肝模型和酒精性脂肪肝模型的研究,结果发现,与非过表达小鼠相比,trpv1基因过表达小鼠的肝脏损伤明显被抑制,肝功能明显好转,而与正常小鼠相比,trpv1基因敲除小鼠的肝脏病理损伤明显加剧,炎症、肝纤维化等明显加重,肝功能损伤明显加剧。
66.因此,本发明提出trpv1基因可作为药物靶点构建药物筛选模型(包括细胞模型或动物模型),用于筛选预防、缓解和/或治疗急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝等肝脏疾病的药物。发现其中能够特异性激动trpv1的分子,从而为急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝等肝脏疾病的治疗提供新的治疗性分子。
67.trpv1基因也可作为基因治疗中的靶基因,设计并制备预防、缓解和/或治疗急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝等肝脏疾病的药物和/或生物试剂,通过基因工程技术达到预防、缓解和/或治疗肝纤维化等肝脏疾病的目的。
68.因此,本发明提出trpv1的上调剂在制备保护肝脏功能,或预防、缓解和/或治疗急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝等肝脏疾病的药物中的应用。所述的trpv1上调剂优选为trpv1基因的过表达质粒、病毒介导的trpv1过表达转染或者其他能够促进trpv1表达的激动剂或者生物制剂中的一种。
69.以下是本发明的详细实验过程和数据。以下实施例所用化学试剂都是常规试剂,均可商购获得。未做特殊说明的实验方法都是采用本领域已知的常规方法。
70.在以下实施例中所采用的动物及各研究指标的检测方法如下:
71.(一)实验动物
72.实验动物:选用8周龄、体重在18g-20g、背景为雄性c57/bl品系的小鼠,包括野生型小鼠(wt)和本技术构建的trpv1基因敲除小鼠(trpv1-/-)。图1表示trpv1敲除小鼠的构建及鉴定结果图,wb结果显示本技术成功构建trpv1基因敲除小鼠。
73.动物饲养及模型构造在上海中医药大学普陀医院医院动物中心和上海大学生命科学院动物中心实施。
74.(二)检测方法
75.1、标本留取
76.造模结束后,用2%戊巴比妥钠(2ml/kg小鼠体重)腹腔注射麻醉,仰卧固定,打开腹腔,在下腔静脉处进针取血,血液静置1h后,4℃、3000rpm离心10min,分离血清,-80℃保存,用于检测肝功能、血脂等指标。
77.摘取肝脏,制备冰冻组织和10%中性福尔马林固定用于组织病理学检测,剩余肝组织-80℃冻存用于real-time pcr、免疫印迹等指标检测。
78.2、检测指标
79.动物一般情况:包括体重、肝重、脾重等;小鼠肝功能(alt、ast)和血脂(tc、tg)测定;肝组织he、油红染色;炎症因子、纤维化指标real-time pcr;α-sma免疫组化和免疫印迹等。
80.3、肝组织病理染色
81.(1)he染色
82.小鼠肝组织以10%福尔马林固定,经脱水石蜡包埋后切片,置于全自动染色机中
进行he染色,荧光显微镜观察肝组织病理形态变化,image软件统计分析。
83.(2)油红染色
84.小鼠肝组织冰冻包埋后切片,室温静置15min,油红与蒸馏水按3:2配比稀释,60%异丙醇清洗,油红染色15min,晾干,蒸馏水清洗,苏木素复染核,甘油明胶封片,镜检。
85.(3)免疫组化
86.小鼠肝组织以10%福尔马林固定,经脱水石蜡包埋后切片,脱蜡至水,高于92℃微波修复,冷却,pbs洗5min
×
3次,5%bsa37℃封闭30min,滴加一抗,4℃过夜,pbs洗3min
×
3次,加二抗室温1h。滴加sabc,37℃,20min。pbs洗5min
×
3次,dab显色,蒸馏水清洗,苏木素复染,无水乙醇脱水、二甲苯透明后封片,镜检。
87.4、实时荧光定量pcr(real-time pcr)法检测炎症相关因子的基因表达
88.称取约50mg小鼠肝组织,trizol法提取总rna,核酸定量分析仪测定总rna的浓度和纯度,a260 nm/a280 nm值在1.8-2.1之间即可。参照逆转录试剂盒说明书进行逆转录合成cdna。用cdna为模板对目的基因分别进行pcr扩增,引物序列由上海生工生物工程有限公司合成。反应条件:95℃30sec,95℃5sec,60℃30sec 45个循环,导出数据,进行统计分析。
89.5、western blot检测蛋白表达
90.取100mg肝组织,加入预冷的ripa(含蛋白酶抑制剂)匀浆,4℃、12000rpm离心15分钟,离心半径6cm,留取上清液进行蛋白定量。取20μg样品,12%sds-page电泳,100v转移1小时至pvdf膜,封闭1小时;一抗4℃过夜,二抗室温孵育45分钟,ecl显影,采用image j分析western blot蛋白表达灰度值。
91.6、统计学方法
92.采用spss 23.0软件进行统计学分析。数据以均数
±
标准差表示,组间比较用单样本t检验,p<0.05为差异有统计学意义,p<0.01提示有显著性统计学差异。
93.实施例1、trpv1敲除加重急性肝损伤
94.(一)实验过程
95.构建trpv1敲除的小鼠急性肝损伤模型:4只8周龄的雄性c57/bl野生型小鼠作为wt组(对照组),4只同周龄雄性trpv1-/-小鼠作为trpv1-/-组(trpv1基因敲除组)。
96.两组小鼠给予脂多糖lps(10mg/kg小鼠体重)腹腔注射,18h后处死取材。称取小鼠体重及脾重,计算脾体比。留取血清、肝脏进行相关检测:小鼠肝功能检测及炎症因子的表达。
97.(二)实验结果
98.结果如图2所示,相较于wt组,trpv1-/-组小鼠的脾重明显减轻,脾体比值明显降低(图2的c),血清肝功能(alt)也明显低于wt组(图2的b);另外,he染色结果显示:wt组小鼠的肝细胞排列整齐,汇管区炎细胞浸润较少;而trpv1-/-组小鼠的肝细胞排列松散,中央静脉结构变形,汇管区有大量炎细胞浸润(图2的a);pcr检测结果显示:相较于wt组,trpv1-/-组炎症因子(tnf-α、mcp1、il-1β、cxcr1、ccl19、cxcl9、cxcl11、cxcl19、ccl3等)的表达明显升高,trpv1-/-组小鼠的炎症反应明显加重。
99.以上结果表明,trpv1的敲除会加重急性肝损伤,反面证明trpv1在急性肝损伤中具有保护作用。
100.实施例2、trpv1敲除加重肝纤维化
101.(一)实验过程
102.构建trpv1敲除的小鼠肝纤维化模型:4只8周龄的雄性c57/bl小鼠作为wt组,4只同周龄雄性trpv1-/-小鼠作为trpv1-/-组。腹腔注射ccl4(10%ccl4,0.04ml/只),每周3次,连续6周。末次注射72小时后处死取材,取肝脏、血清进行相关检测:病理检测天狼星红染色及α-sma表达;pcr检测炎症因子和纤维化指标的表达。
103.(二)实验结果
104.结果如图3所示,天狼星红染色显示:wt组小鼠肝组织的纤维间隔较窄、排列疏松而不连续,而trpv1-/-组可见增生的胶原纤维分割肝小叶形成较粗大的间隔,肝小叶结构异常,形成假小叶;半定量分析和免疫组化显示:与wt组相比,trpv1-/-组天狼星红阳性染色面积显著增加,α-sma表达显著增加,差异有统计学意义(图3的a);另外,pcr检测结果显示:相较于wt组,trpv1-/-组的纤维化指标(α-sma、col1(α)1、col4(α)1、desmin、timp1)和炎症因子(tnf-α、cd68、il-1β、il-6、mcp1、cxcr1)的表达显著升高(图3的b、c),表明trpv1-/-组小鼠的炎症反应和纤维化程度明显加重。
105.以上结果表明,trpv1敲除会加重小鼠的肝纤维化,证明trpv1对肝纤维化具有保护作用。
106.实施例3、trpv1过表达缓解肝纤维化
107.(一)实验过程
108.构建trpv1过表达的小鼠肝纤维化模型:8周龄的雄性c57/bl小鼠12只,随机分为对照组(lv-con)和过表达组(lv-sma-trpv1),每组各6只。两组小鼠注射10%的ccl4橄榄油,0.04ml/只,每周3次,连续6周;小鼠注射ccl4造模2周后,lv-sma-trpv1组再尾静脉注射trpv1慢病毒(lv-sma-trpv1);lv-con组小鼠注射等体积等量的对照病毒(lv-con)。末次注射ccl4橄榄油72小时后处死取材,进行相关检测:检测小鼠肝功能及病理学改变;免疫组化检测α-sma表达;pcr检测纤维化指标和炎症因子的表达。
109.(二)实验结果
110.结果如图4所示,相较于lv-con组,lv-sma-trpv1组小鼠的trpv1表达显著提升,表明lv-sma-trpv1病毒成功表达(图4的a);病理染色结果显示,lv-sma-trpv1组的天狼星红染色显著减少,α-sma表达显著减少(图4的c、d);且与lv-con组相比,lv-sma-trpv1组小鼠的血清alt、ast显著降低,过表达trpv1小鼠的肝功能明显改善(图4的e);另外,pcr检测结果显示:相较于lv-con组,lv-sma-trpv1组的纤维化指标(α-sma、col1(α)1、col4(α)1、desmin)和炎症因子(tnf-α、cd68、il-1β、il-6、mcp1、cxcr1、cxcl15)的表达也显著降低(图4的f、g),lv-sma-trpv1组小鼠的炎症反应和纤维化程度明显缓解。
111.以上结果表明,过表达trpv1可显著减轻肝纤维化,trpv1过表达对肝纤维化具有保护作用。
112.实施例4、trpv1敲除加重mcd诱导的非酒精性脂肪肝
113.(一)实验过程
114.构建trpv1敲除的小鼠非酒精性脂肪肝模型(mcd诱导):4只8周龄的雄性c57/bl小鼠作为wt组,4只同周龄雄性trpv1-/-小鼠作为trpv1-/-组。小鼠给予mcd饲料(购自南通特洛菲)喂养,连续6周后处死取材,进行相关检测:检测小鼠血清生化指标;病理检测天狼星红染色和油红染色;pcr检测炎症因子和纤维化指标的表达;免疫印迹检测α-sma的蛋白表达。
115.(二)实验结果
116.结果如图5所示,与wt组相比,trpv1-/-组小鼠的alt、ast值明显升高(图5的c);天狼星红染色和油红染色显示:相较于wt组,trpv1-/-组天狼星红染色明显增多,脂滴明显增多、增大,脂质沉积明显(图5的a、b);另外,pcr结果显示:trpv1-/-组小鼠的纤维化指标(α-sma、col1(α)1、col4(α)1、timp1)和炎症因子(tnf-α、cd68、il-1β、mcp1、ccl3、cxcr1、cxcl2)的表达较wt组明显升高(图5的d、e),trpv1-/-组小鼠的炎症反应和纤维化程度明显加重;同时wb结果显示,trpv1-/-组的纤维化指标α-sma表达明显升高,差异有统计学意义(图5的f)。
117.以上结果表明,在mcd非酒精性脂肪肝模型中,trpv1的敲除加重小鼠肝脏脂肪变和纤维化,反面证明trpv1对肝脏脂肪变和纤维化具有保护作用。
118.实施例5、trpv1过表达减轻mcd诱导的非酒精性脂肪肝
119.(一)实验过程
120.构建trpv1过表达的小鼠非酒精性脂肪肝模型(mcd诱导):8周龄的雄性c57/bl小鼠10只,随机分为2组,记为对照组(lv-con)和trpv1病毒过表达组(lv-sma-trpv1),每组各5只。两组给予mcd饲料喂养,连续6周;小鼠在喂养mcd饲料1周后,lv-sma-trpv1组经尾静脉注射lv-sma-trpv1病毒(每只小鼠1.5
×
10^7tu);lv-con组注射等体积等量的对照病毒。6周后处死取材,进行相关检测:称取小鼠体重、肝重并计算肝体比;检测小鼠血清生化指标;病理检测天狼星红染色和油红染色;pcr检测炎症因子和纤维化指标;免疫印迹检测α-sma的蛋白表达。
121.(二)实验结果
122.结果如图6所示,相较于lv-con组,lv-sma-trpv1组小鼠的肝重、肝体比值显著降低,血清alt、ast显著降低,过表达trpv1小鼠的肝功能明显改善(图6的c);天狼星红染色显示:对照组小鼠天狼星红染色明显,而过表达组天狼星红染色显著减少;油红染色显示:对照组脂滴较多,大小不一,脂肪沉积明显,而过表达trpv1组脂滴显著减少(图6的a、b);pcr结果显示:与lv-con组相比,lv-sma-trpv1组纤维化指标(α-sma、col1(α)1、desmin、timp1)和炎症因子(tnf-α、cd68、il-1β、il-6、mcp1、cxcr1、cxcl2)的表达显著降低,表明lv-sma-trpv1组小鼠的炎症反应和纤维化程度明显缓解(图6的d、e);同时,wb结果显示:过表达trpv1后,α-sma表达明显下调(图6的f),进一步证明,过表达trpv1可减轻mcd非酒精性脂肪肝模型中小鼠的肝脏脂肪变、炎症和纤维化。
123.以上结果表明,过表达trpv1可显著减轻肝脏脂肪变、炎症和纤维化,trpv1过表达对肝脏脂肪变和纤维化具有保护作用。
124.实施例6、trpv1敲除加重cdaa诱导的非酒精性脂肪肝
125.(一)实验过程
126.构建trpv1敲除的小鼠非酒精性脂肪肝模型(cdaa诱导):6只8周龄的雄性c57/bl小鼠作为wt组,6只同周龄雄性trpv1-/-小鼠作为trpv1-/-组。小鼠给予cdaa(购自南通特洛菲)饲料喂养,连续18周后处死取材,进行相关检测:检测小鼠血清学指标;病理学检测天狼星红和α-sma免疫组化的阳性表达;pcr检测炎症因子和纤维化指标;免疫印迹检测α-sma的蛋白表达。
127.(二)实验结果
128.结果如图7所示,与wt组相比较,trpv1-/-组的tg、tc水平明显升高(图7的c);trpv1-/-组肝脏天狼星红染色明显,脂肪空泡明显增多;α-sma染色显著增多,差异有统计学意义(图7的a、b)。pcr检结果显示:trpv1-/-组小鼠的纤维化指标(α-sma、col1(α)1、col4(α)1、desmin、timp1)和炎症因子(tnf-α、il-1β、il-6、cxcr1等)的表达明显升高,trpv1-/-组小鼠的炎症反应和纤维化程度明显加重(图7的d、e);同时,wb结果显示,trpv1-/-组的α-sma表达明显升高,差异有统计学意义(图7的f)。
129.以上结果表明,在cdaa诱导的非酒精性脂肪肝模型中,trpv1的敲除加重了小鼠肝纤维化与脂肪变,反面证明trpv1对肝纤维化、脂肪变具有保护作用。
130.实施例7、trpv1在酒精性脂肪肝中的表达
131.(一)实验过程
132.构建酒精性脂肪肝模型:8周龄的雄性c57/bl小鼠12只,随机分为对照组(pair-fed)组和酒精组(alcohol),每组6只。饲料购自南通特洛菲饲料科技有限公司,按照说明书配制液体饲料:lieber-decarli对照液体饲料(tp4030c)与lieber-decarli酒精液体饲料(tp4030b)。pair-fed组造模过程中全程给予液体对照饲料(36%高脂肪饲料)喂养,alcohol组采用4周慢性乙醇喂养加急性乙醇灌胃的方法:先给予alcohol组小鼠对照液体饲料适应三天,随后给予对照饲料与酒精饲料按2:1、1:1、1:2比例混匀喂养3天,之后进入完全酒精饲料喂养期(共4周)。第32日灌胃:alcohol组以31.5%乙醇灌胃,剂量为5g/每千克体重;pair-fed组以45%糊精灌胃,剂量为9g/每千克体重,9h后处死小鼠,进行相关检测:免疫组化检测trpv1的阳性表达;pcr检测trpv1、α-sma、col1(α)1的表达,并统计其相关性;wb检测trpv1的蛋白表达。
133.(二)实验结果
134.结果如图8所示,通过免疫组化检测trpv1蛋白的表达,结果显示:与pair-fed组相比,alcohol组trpv1表达明显减少,差异有统计学意义(图7的a);pcr结果进一步显示:alcohol组trpv1表达显著降低,纤维化指标α-sma、col1(α)1的表达显著增加,与trpv1表达呈显著性负相关(图8的b)。wb结果同样显示:alcohol组trpv1蛋白表达明显减少(图8的c)。
135.以上结果表明,trpv1在酒精性脂肪肝中表达下调,反面证明trpv1对酒精性脂肪肝具有保护作用。
136.综上研究结果表明,trpv1基因的过表达可以改善急性肝损伤、肝纤维化以及非酒精性脂肪肝、酒精性脂肪肝的炎症和纤维化程度,促进肝功能恢复;trpv1基因的敲除会加重急性肝损伤、肝纤维化以及非酒精性脂肪肝、酒精性脂肪肝的炎症和纤维化程度,加重肝损伤。证明trpv1在急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝中具有保护作用。
137.鉴于此,本发明提供:trpv1作为药物靶标制备预防、缓解和/或治疗急性肝损伤、肝纤维化、非酒精性脂肪肝和酒精性脂肪肝的trpv1激动剂,包括trpv1基因的过表达质粒、病毒介导的trpv1过表达转染或者其他能够促进trpv1表达的药物或者生物制剂。
138.尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1