一种四氢吲嗪类化合物及其制备方法与应用
1.本发明属于有机合成技术领域,具体涉及一种四氢吲嗪类化合物及其制备方法与应用。
背景技术:
2.四氢吲嗪广泛存在于天然产物和药物中,在抗肿瘤、放疗增敏、抗病毒、抗炎、止吐、免疫调节等方面有广泛的应用。因此,通过简便、绿色、条件温和的方法高效构筑四氢吲嗪类化合物引起了药物化学研究人员的关注。
3.自由基参与的化学反应是合成杂环的有效手段,其中可见光条件下的自由基接力环化反应因其具有反应条件温和、底物范围广、原子经济性高等特点而受到化学家们的青睐。吡咯衍生物可通过光敏剂三(2,2'-联吡啶)二氯化钌的催化,经单电子还原活化的c-br键,再通过分子内加成得到四氢吲嗪类化合物(org.lett.2010,12,2,368
–
371)。类似的,应用光敏剂面式-三(2-苯基吡啶)合铱催化活化的c-br键,经分子间加成和环化可获得四氢吲嗪类化合物(j.org.chem.2018,83,4,2425
–
2437)。光敏剂面式-三(2-苯基吡啶)合铱也可催化n-羟基邻苯二甲酰亚胺酯,经分子内加成得到四氢吲嗪类化合物(chem.eur.j.2020,26,31,7004-7007.)。应用这些方法均能在光照下高效合成四氢吲嗪类化合物,然而均需要含铱、钌等贵金属催化剂的参与。这些含贵金属光敏剂价格高、回收困难、而且存在重金属残留的问题,限制了该类光反应的广泛应用。
技术实现要素:
4.本发明的第一目的是提供一种四氢吲嗪类化合物。
5.本发明的第二目的是提供一种四氢吲嗪类化合物的制备方法。
6.为实现上述目的,本发明采用以下技术方案:
7.一种四氢吲嗪类化合物,所述化合物由结构式(ⅲ)表示:
[0008][0009]
其中:
[0010]
r1、r2、r3分别独立地选自h、取代或未取代的c1~c
18
烷基、取代或未取代的c6~c
10
芳基、取代或未取代的c5~c
18
杂芳基、卤素、氰基、or5、sr5、nr5r6、cor5、coor5;
[0011]
r2和r3可连接环合形成取代或未取代的c5~c
18
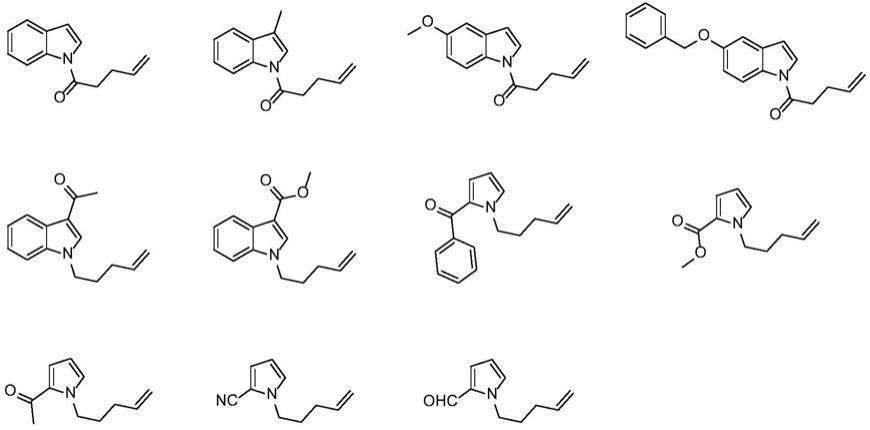
环烷基、取代或未取代的c6~c
10
芳基、取代或未取代的c5~c
18
杂芳基;
[0012]
r4、r5、r6分别独立地选自取代或未取代的c1~c
18
烷基、取代或未取代的c6~c
10
芳基、取代或未取代的c5~c
18
杂芳基;
[0013]
且在r1~r6中,所述杂芳基的杂原子为n、o或s,所述杂原子个数为1~3个,所述取代基选自c1~c8烷基、c3~c8环烷基、c1~c8烷氧基、c1~c8烷硫基、c1~c8烷氧羰基、c1~c8氨基甲酰基、c1~c8烷基羰基、氰基、三氟甲基、卤素、硝基、苯基或苯氧基;
[0014]
x选自亚甲基、羰基。
[0015]
进一步地,
[0016]
r1选自h、c1~c5烷基、c1~c5烷基羰基、c1~c5烷氧羰基;
[0017]
r2选自h、与r3环合形成的苯环;
[0018]
r3选自甲酰基、氰基、c1~c5烷基羰基、c1~c5烷氧羰基、c6~c
10
芳基羰基、与r2环合形成的苯环;
[0019]
r4选自取代或未取代的c1~c8烷基、取代或未取代的c6~c
10
芳基、取代或未取代的c5~c8杂芳基;
[0020]
且在r1~r4中,所述杂芳基的杂原子为n、o或s,所述杂原子个数为1~3个,所述取代基选自c1~c4烷基、c3~c8环烷基、c1~c4烷氧基、c1~c4烷硫基、c1~c4烷氧羰基、c1~c4氨基甲酰基、c1~c4烷基羰基、氰基、三氟甲基、卤素。
[0021]
进一步地,所述制备方法的具体步骤如下:
[0022]
在惰性气体保护条件下,以1.0~2.0当量的吡咯类化合物(i)和1.0~4.0当量的磺酰氯类化合物(ii)为原料,与1.0~4.0当量的碱混合,在光照下条件下,于有机溶剂中反应6~60h,反应结束后,减压除去溶剂、柱层析分离纯化,得到结构式(iii)所示的四氢吲嗪类化合物;
[0023]
其中,所述吡咯类化合物如结构式(i)所示,所述磺酰氯类化合物如结构式(ii)所示;
[0024][0025]
进一步地,所述吡咯类化合物为1当量、磺酰氯类化合物为2当量、碱为2当量,所述惰性气体为氩气,所述反应温度为25℃。
[0026]
进一步地,所述有机溶剂选自二氯甲烷、六氟异丙醇、乙腈、四氢呋喃。
[0027]
进一步地,所述吡咯类化合物的结构式选自:
[0028][0029]
所述磺酰氯类化合物结构式选自:
[0030][0031]
进一步地,所述有机溶剂为乙腈,所述碱为磷酸氢二钠,所述光源为蓝光。
[0032]
进一步地,所述的一种四氢吲嗪类化合物在制备医药用品、化工原料中的应用。
[0033]
由于采用了上述技术方案,本发明具有如下的优点:
[0034]
1、本发明中所制备的产物均为结构新颖的四氢吲嗪类化合物,并经核磁共振波谱仪检测确证。
[0035]
2、本发明以吡咯类化合物和磺酰氯类化合物为原料,原料价廉易得,反应过程无金属催化剂参与、操作简便、条件温和、底物范围广、官能团耐受性好、产品易纯化、收率高达94%、适合大规模生产。
[0036]
本发明的其它优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书和权利要求书来实现和获得。
附图说明
[0037]
本发明的附图说明如下:
[0038]
图1为本技术的合成流程图;
[0039]
图2为本发明的实施例2制备得到的化合物的核磁共振图;
[0040]
图3为本发明的实施例3制备得到的化合物的核磁共振图;
[0041]
图4为本发明的实施例4制备得到的化合物的核磁共振图;
[0042]
图5为本发明的实施例5制备得到的化合物的核磁共振图;
[0043]
图6为本发明的实施例6制备得到的化合物的核磁共振图;
[0044]
图7为本发明的实施例7制备得到的化合物的核磁共振图;
[0045]
图8为本发明的实施例8制备得到的化合物的核磁共振图;
[0046]
图9为本发明的实施例9制备得到的化合物的核磁共振图;
[0047]
图10为本发明的实施例10制备得到的化合物的核磁共振图;
[0048]
图11为本发明的实施例11制备得到的化合物的核磁共振图;
[0049]
图12为本发明的实施例12制备得到的化合物的核磁共振图;
[0050]
图13为本发明的实施例13制备得到的化合物的核磁共振图;
[0051]
图14为本发明的实施例14制备得到的化合物的核磁共振图;
[0052]
图15为本发明的实施例15制备得到的化合物的核磁共振图;
[0053]
图16为本发明的实施例16制备得到的化合物的核磁共振图;
[0054]
图17为本发明的实施例17制备得到的化合物的核磁共振图;
[0055]
图18为本发明的实施例18制备得到的化合物的核磁共振图;
[0056]
图19为本发明的实施例19制备得到的化合物的核磁共振图;
[0057]
图20为本发明的实施例20制备得到的化合物的核磁共振图;
[0058]
图21为本发明的实施例21制备得到的化合物的核磁共振图。
具体实施方式
[0059]
下面结合附图和实施例对本发明作进一步说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
[0060]
根据如图1所示的合成流程图制备四氢吲嗪类化合物。
[0061]
实施例1:2-甲氧基-9-(对甲苯磺酰甲基)-8,9-二氢吡啶[1,2-a]吲哚-6(7h)-酮的制备
[0062][0063]
1、实验方法
[0064]
在氩气保护下,依次将1-(5-甲氧基-1h-吲哚-1-基)戊-4-烯-1-酮(45.9mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应39小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0065]
2、实验结果
[0066]
由图2所示,图2中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固
体,收率75%;
[0067]
产物表征:1h nmr(400mhz,cdcl3)δ8.30(d,j=8.9hz,1h),7.86(d,j=8.2hz,2h),7.40(d,j=8.0hz,2h),6.93
–
6.83(m,2h),6.26(s,1h),3.82(s,3h),3.71
–
3.57(m,2h),3.34(dd,j=13.9,8.8hz,1h),2.91
–
2.71(m,2h),2.60
–
2.50(m,1h),2.47(s,3h),2.12
–
2.01(m,1h).
13
c nmr(101mhz,cdcl3)δ168.11,156.79,145.38,139.14,136.46,130.28,130.07,129.73,127.92,117.21,112.83,105.35,103.21,59.05,55.65,32.44,29.85,26.91,21.76.
[0068]
实施例2:10-甲基-9-(对甲苯磺酰甲基)-8,9-二氢吡啶[1,2-a]吲哚-6(7h)-酮的制备
[0069][0070]
1、实验方法
[0071]
在氩气保护下,依次将1-(3-甲基-1h-吲哚-1-基)戊-4-烯-1-酮(42.7mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应42小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=8:1)分离得到产物。
[0072]
2、实验结果
[0073]
由图3所示,图3中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为黄色固体,收率70%;
[0074]
产物表征:1h nmr(400mhz,cdcl3)δ8.43
–
8.38(m,1h),7.84(d,j=8.2hz,2h),7.43
–
7.36(m,3h),7.33
–
7.23(m,2h),3.97
–
3.90(m,1h),3.44(dd,j=14.4,10.7hz,1h),3.13(dd,j=14.4,2.6hz,1h),2.93
–
2.74(m,2h),2.64
–
2.54(m,1h),2.47(s,3h),2.27
–
2.15(m,1h),2.07(s,3h).
13
c nmr(101mhz,cdcl3)δ168.12,145.33,136.41,134.51,133.26,130.50,130.24,127.93,125.12,124.04,118.26,116.52,113.54,57.05,29.35,26.21,23.71,21.75,8.24.
[0075]
实施例3:2-(苄氧基)-9-(对甲苯磺酰甲基)-8,9-二氢吡啶[1,2-a]吲哚-6(7h)-酮的制备
[0076][0077]
1、实验方法
[0078]
在氩气保护下,依次将1-(5-(苄氧基)-1h-吲哚-1-基)戊-4-烯-1-酮(61.1mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈
(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应48小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=3:1)分离得到产物。
[0079]
2、实验结果
[0080]
由图4所示,图4中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为黄色固体,收率72%;
[0081]
产物表征:1h nmr(400mhz,cdcl3)δ8.30(d,j=9.7hz,1h),7.85(d,j=8.2hz,2h),7.48
–
7.28(m,7h),7.01
–
6.92(m,2h),6.23(s,1h),5.07(s,2h),3.69
–
3.54(m,2h),3.32(dd,j=14.0,8.8hz,1h),2.90
–
2.70(m,2h),2.57
–
2.48(m,1h),2.46(s,3h),2.12
–
1.99(m,1h).
13
c nmr(101mhz,cdcl3)δ168.07,155.97,145.35,139.19,137.11,136.54,130.26,130.06,129.93,128.60,127.96,127.92,127.50,117.25,113.71,105.36,104.61,70.48,59.09,32.43,29.86,26.92,21.73.
[0082]
实施例4:1-(9-(对甲苯磺酰甲基)-6,7,8,9-四氢吡啶[1,2-a]吲哚-10-基)乙烷-1-酮的制备
[0083][0084]
1、实验方法
[0085]
在氩气保护下,依次将1-(1-(戊-4-烯-1-基)-1h-吲哚-3-基)乙烷-1-酮(45.5mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应19小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0086]
2、实验结果
[0087]
由图5所示,图5中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率93%;
[0088]
产物表征:1h nmr(400mhz,cdcl3)δ7.91(d,j=8.2hz,1h),7.83(dd,j=5.7,3.2hz,1h),7.39
–
7.32(m,2h),7.31
–
7.26(m,1h),4.36
–
4.23(m,1h),3.97
–
3.82(m,1h),3.33(dd,j=13.7,11.4hz,1h),2.80(dd,j=12.1,2.2hz,1h),2.63(s,2h),2.43(s,2h),2.35
–
2.21(m,1h),2.21
–
2.08(m,1h),1.95
–
1.81(m,1h).
13
c nmr(101mhz,cdcl3)δ193.68,145.10,144.50,136.97,136.19,129.77,128.07,125.87,122.61,122.30,120.41,112.59,109.87,56.11,42.60,31.56,29.93,22.29,21.67,17.70.
[0089]
实施例5:9-((4-氟苯基)磺酰基)甲基)-8,9-二氢吡啶[1,2-a]吲哚-6(7h)-酮的制备
[0090][0091]
1、实验方法
[0092]
在氩气保护下,依次将1-(1h-吲哚-1-基)戊-4-烯-1-酮(39.9mg,0.2mmol)、对氟苯磺酰氯(78.0mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应14小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0093]
2、实验结果
[0094]
由图6所示,图6中a为核磁共振1h谱图,b为核磁共振
13
c谱图,c为核磁共振
19
f谱图,所得产物为绿色固体,收率68%;
[0095]
产物表征:1h nmr(400mhz,cdcl3)δ8.42(d,j=8.1hz,1h),8.04
–
7.96(m,2h),7.43(d,j=7.4hz,1h),7.34
–
7.20(m,5h),6.33(s,1h),3.76
–
3.67(m,1h),3.62(dd,j=14.1,3.8hz,1h),3.36(dd,j=14.1,9.0hz,1h),2.94
–
2.76(m,2h),2.61
–
2.51(m,1h),2.15
–
2.03(m,1h).
13
c nmr(101mhz,cdcl3)δ168.36,166.03(d,j=257.4hz),138.16,135.58(d,j=3.2hz),135.09,130.80(d,j=9.7hz),128.91,124.98,124.24,120.14,117.00(d,j=22.7hz),116.45,105.47,59.18,32.51,29.73,26.84.
19
f nmr(376mhz,cdcl3)δ-102.22.
[0096]
实施例6:(8-(对甲苯磺酰甲基)-5,6,7,8-四氢吲哚嗪-3-羧酸甲酯的制备
[0097][0098]
1、实验方法
[0099]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-羧酸甲酯(38.6mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应24小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=4:1)分离得到产物。
[0100]
2、实验结果
[0101]
由图7所示,图7中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率91%;
[0102]
产物表征:1h nmr(400mhz,cdcl3)δ7.84(d,j=8.2hz,2h),7.39(d,j=8.1hz,2h),6.87(d,j=4.1hz,1h),5.84(d,j=4.0hz,1h),4.51
–
4.42(m,1h),4.18
–
4.08(m,1h),3.77(s,3h),3.54
–
3.45(m,2h),3.27(dd,j=14.7,10.2hz,1h),2.47(s,3h),2.38
–
2.29(m,1h),2.12
–
2.01(m,1h),1.97
–
1.83(m,1h),1.80
–
1.68(m,1h).
13
c nmr(101mhz,cdcl3)δ161.47,145.04,136.95,136.66,130.15,127.91,121.47,117.52,105.85,61.22,51.01,45.31,
30.19,26.03,21.73,21.56.
[0103]
实施例7:8-(对甲苯磺酰甲基)-5,6,7,8-四氢吲哚嗪-3-碳腈的制备
[0104][0105]
1、实验方法
[0106]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-碳腈(32.0mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应42小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=4.5:1)分离得到产物。
[0107]
2、实验结果
[0108]
由图8所示,图8中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率81%;
[0109]
产物表征:1h nmr(400mhz,cdcl3)δ7.83(d,j=8.1hz,2h),7.39(d,j=8.0hz,2h),6.71(d,j=4.0hz,1h),5.87(d,j=3.9hz,1h),4.15
–
4.04(m,1h),3.98
–
3.87(m,1h),3.54
–
3.41(m,2h),3.24(dd,j=14.2,9.4hz,1h),2.47(s,3h),2.42
–
2.33(m,1h),2.18
–
2.07(m,1h),2.04
–
1.91(m,1h),1.84
–
1.72(m,1h).
13
c nmr(101mhz,cdcl3)δ145.15,136.59,135.91,130.16,127.86,119.54,113.72,106.47,102.74,60.89,44.33,29.81,26.43,21.68,21.17.
[0110]
实施例8:8-(对甲苯磺酰甲基)-5,6,7,8-四氢吲哚嗪-3-碳醛的制备
[0111][0112]
1、实验方法
[0113]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-碳醛(32.6mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应42小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=4:1)分离得到产物。
[0114]
2、实验结果
[0115]
由图9所示,图9中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为黄色固体,收率88%;
[0116]
产物表征:1h nmr(400mhz,cdcl3)δ9.43(s,1h),7.84(d,j=8.2hz,2h),7.40(d,j=8.0hz,2h),6.84(d,j=4.1hz,1h),5.97(d,j=4.1hz,1h),4.54
–
4.44(m,1h),4.24
–
4.14(m,1h),3.58
–
3.46(m,2h),3.28(dd,j=14.1,9.2hz,1h),2.47(s,3h),2.38
–
2.28(m,1h),
2.11
–
2.01(m,1h),1.97
–
1.85(m,1h),1.83
–
1.72(m,1h).
13
c nmr(101mhz,cdcl3)δ178.97,145.14,140.06,136.65,131.40,130.17,127.91,124.20,107.56,61.00,45.47,30.00,26.03,21.70,21.21.
[0117]
实施例9:1-(8-(对甲苯磺酰甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0118][0119]
1、实验方法
[0120]
在氩气保护下,依次将1-(1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应28小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0121]
2、实验结果
[0122]
由图10所示,图10中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率94%;
[0123]
产物表征:1h nmr(400mhz,cdcl3)δ7.84(d,j=8.2hz,2h),7.39(d,j=8.1hz,2h),6.88(d,j=4.2hz,1h),5.89(d,j=4.1hz,1h),4.54
–
4.43(m,1h),4.24
–
4.13(m,1h),3.57
–
3.45(m,2h),3.27(dd,j=14.6,9.8hz,1h),2.47(s,3h),2.36(s,3h),2.33
–
2.24(m,1h),2.08
–
1.99(m,1h),1.93
–
1.80(m,1h),1.78
–
1.67(m,1h).
13
c nmr(101mhz,cdcl3)δ187.98,145.04,138.32,136.72,130.27,130.14,127.90,119.66,106.18,61.22,46.05,30.16,27.15,25.85,21.69,21.54.
[0124]
实施例10:苯基(8-(对甲苯磺酰甲基)-5,6,7,8-四氢吲哚嗪-3-基)甲酮的制备
[0125][0126]
1、实验方法
[0127]
在氩气保护下,依次将(1-(戊-4-烯-1-基)-1h-吡咯-2-基)(苯基)甲酮(47.8mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应24小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0128]
2、实验结果
[0129]
由图11所示,图11中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率81%;
[0130]
产物表征:1h nmr(400mhz,cdcl3)δ7.85(d,j=8.2hz,2h),7.73(d,j=7.2hz,2h),7.51(t,j=7.3hz,1h),7.47
–
7.33(m,4h),6.65(d,j=4.1hz,1h),5.91(d,j=4.1hz,1h),4.62
–
4.49(m,1h),4.41
–
4.23(m,1h),3.63
–
3.48(m,2h),3.31(dd,j=14.2,9.5hz,1h),2.47(s,3h),2.42
–
2.32(m,1h),2.16
–
2.04(m,1h),2.02
–
1.87(m,1h),1.85
–
1.74(m,1h).
13
c nmr(101mhz,cdcl3)δ185.65,145.06,140.06,139.06,136.64,131.26,130.13,129.91,129.05,128.01,127.89,122.98,106.39,61.22,46.01,30.22,26.03,21.69,21.65.
[0131]
实施例11:9-(对甲苯磺酰甲基)-6,7,8,9-四氢吡啶[1,2-a]吲哚-10-羧酸甲酯的制备
[0132][0133]
1、实验方法
[0134]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吲哚-3-羧酸甲酯(48.6mg,0.2mmol)、对甲苯磺酰氯(76.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应9小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=6:1)分离得到产物。
[0135]
2、实验结果
[0136]
由图12所示,图12中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率78%;
[0137]
产物表征:1h nmr(400mhz,cdcl3)δ8.15
–
8.09(m,1h),7.89(d,j=8.2hz,2h),7.38(d,j=8.1hz,2h),7.33
–
7.23(m,3h),4.50
–
4.37(m,1h),4.35
–
4.26(m,1h),3.97
–
3.84(m,4h),3.79(dd,j=13.8,2.4hz,1h),3.41(dd,j=13.8,11.6hz,1h),2.80(d,j=14.1hz,1h),2.47(s,3h),2.33
–
2.12(m,2h),2.06
–
1.87(m,1h).
13
c nmr(101mhz,cdcl3)δ165.30,144.66,144.59,137.18,135.94,129.85,127.93,126.39,122.51,122.44,121.51,109.20,102.80,57.16,50.87,42.53,29.13,22.48,21.67,17.76.
[0138]
实施例12:9-((2,3-二氢苯并呋喃-5-基)磺酰基)甲基)-8,9-二氢吡啶[1,2-a]吲哚-6(7h)-酮的制备
[0139][0140]
1、实验方法
[0141]
在氩气保护下,依次将1-(1h-吲哚-1-基)戊-4-烯-1-酮(39.9mg,0.2mmol)、2,3-二氢苯并呋喃-5-磺酰氯(91.6mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于
25℃反应24小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=3:1)分离得到产物。
[0142]
2、实验结果
[0143]
由图13所示,图13中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为黄色固体,收率75%;
[0144]
产物表征:1h nmr(400mhz,cdcl3)δ8.43(d,j=8.0hz,1h),7.76(d,j=7.2hz,2h),7.44(d,j=7.4hz,1h),7.33
–
7.21(m,2h),6.95
–
6.88(m,1h),6.33(s,1h),4.71(t,j=8.9hz,2h),3.74
–
3.65(m,1h),3.61(dd,j=14.1,3.8hz,1h),3.39
–
3.25(m,3h),2.95
–
2.75(m,2h),2.62
–
2.53(m,1h),2.16
–
2.03(m,1h).
13
c nmr(101mhz,cdcl3)δ168.52,165.08,138.56,135.14,131.00,129.71,129.07,129.03,125.10,124.92,124.22,120.12,116.49,110.08,105.41,72.57,59.42,32.64,29.99,28.97,26.86.
[0145]
实施例13:9-((乙基磺酰基)甲基)-8,9-二氢吡啶[1,2-a]吲哚-6(7h)-酮的制备
[0146][0147]
1、实验方法
[0148]
在氩气保护下,依次将1-(1h-吲哚-1-基)戊-4-烯-1-酮(39.9mg,0.2mmol)、乙基磺酰氯(51.6mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应48小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=8:1)分离得到产物。
[0149]
2、实验结果
[0150]
由图14所示,图14中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为黄色固体,收率72%;
[0151]
产物表征:1h nmr(400mhz,cdcl3)δ8.45(d,j=7.9hz,1h),7.48(d,j=7.3hz,1h),7.39
–
7.20(m,2h),6.45(s,1h),3.80(s,1h),3.52(dd,j=13.7,3.6hz,1h),3.21(dd,j=13.6,9.1hz,1h),3.10(dd,j=14.7,7.3hz,2h),2.96
–
2.76(m,2h),2.57(dd,j=13.0,5.0hz,1h),2.21
–
2.02(m,1h),1.46(t,j=7.4hz,3h).
13
c nmr(101mhz,cdcl3)δ168.47,138.43,135.19,128.99,125.03,124.30,120.22,116.52,105.54,54.36,49.13,32.50,28.96,27.03,6.76.实施例14:1-(8-((乙基磺酰基)甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0152][0153]
1、实验方法
[0154]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、乙基磺酰氯(51.6mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)
加入干燥的schlenk管(10ml)中,反应管在10w蓝色led光照射下(距离光源约2cm),于25℃反应16小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=8:1)分离得到产物。
[0155]
2、实验结果
[0156]
由图15所示,图15中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率68%;
[0157]
产物表征:1h nmr(400mhz,cdcl3)δ6.96(d,j=4.2hz,1h),6.06(d,j=4.1hz,1h),4.58
–
4.49(m,1h),4.29
–
4.19(m,1h),3.73
–
3.64(m,1h),3.41(dd,j=13.9,3.5hz,1h),3.21
–
3.04(m,3h),2.44
–
2.33(m,4h),2.15
–
2.04(m,1h),2.00
–
1.88(m,1h),1.85
–
1.74(m,1h),1.47(t,j=7.5hz,3h).
13
c nmr(101mhz,cdcl3)δ188.11,138.15,130.43,119.68,106.23,56.47,48.93,46.12,29.30,27.22,26.04,21.51,6.77.
[0158]
实施例15:1-(8-((4-氟苯基)磺酰基)甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0159][0160]
1、实验方法
[0161]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、对氟苯磺酰氯(78.0mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在10w蓝色led光照射下(距离光源约2cm),于25℃反应24小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0162]
2、实验结果
[0163]
由图16所示,图16中a为核磁共振1h谱图,b为核磁共振
13
c谱图,c为核磁共振
19
f谱图,所得产物为白色固体,收率87%;
[0164]
产物表征:1h nmr(400mhz,cdcl3)δ8.04
–
7.96(m,2h),7.34
–
7.25(m,2h),6.90(d,j=4.2hz,1h),5.90(d,j=4.2hz,1h),4.56
–
4.44(m,1h),4.26
–
4.15(m,1h),3.62
–
3.46(m,2h),3.30(dd,j=14.2,9.3hz,1h),2.38(s,3h),2.36
–
2.26(m,1h),2.11
–
2.00(m,1h),1.97
–
1.83(m,1h),1.82
–
1.70(m,1h).
13
c nmr(101mhz,cdcl3)δ188.07,165.95(d,j=257.0hz),137.94,135.80(d,j=3.2hz),130.80(d,j=9.6hz),130.36,119.62,116.90(d,j=22.6hz),106.16,61.34,46.05,30.10,27.19,25.89,21.52.
19
f nmr(376mhz,cdcl3)δ-102.78.
[0165]
实施例16:1-(8-((2,3-二氢苯并呋喃-5-基)磺酰基)甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0166][0167]
1、实验方法
[0168]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、2,3-二氢苯并呋喃-5-磺酰氯(91.6mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在10w蓝色led光照射下(距离光源约2cm),于25℃反应24小时。。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=3:1)分离得到产物。
[0169]
2、实验结果
[0170]
由图17所示,图17中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率74%;
[0171]
产物表征:1h nmr(400mhz,cdcl3)δ7.79
–
7.71(m,2h),6.90(t,j=5.9hz,2h),5.90(d,j=3.9hz,1h),4.72(t,j=8.9hz,2h),4.54
–
4.44(m,1h),4.23
–
4.12(m,1h),3.57
–
3.44(m,2h),3.35
–
3.21(m,3h),2.37(s,3h),2.34
–
2.25(m,1h),2.10
–
1.99(m,1h),1.94
–
1.81(m,1h),1.79
–
1.68(m,1h).
13
c nmr(101mhz,cdcl3)δ188.00,164.88,138.44,131.18,130.25,129.66,128.90,125.09,119.66,109.97,106.18,72.52,61.52,46.08,30.26,28.99,27.17,25.85,21.56.
[0172]
实施例17:1-(8-((4-(叔丁基)苯基)磺酰基)甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0173][0174]
1、实验方法
[0175]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、4-(叔丁基)苯磺酰氯(93.2mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在10w蓝色led光照射下(距离光源约2cm),于25℃反应36小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=4:1)分离得到产物。
[0176]
2、实验结果
[0177]
由图18所示,图18中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率80%;
[0178]
产物表征:1h nmr(400mhz,cdcl3)δ7.89(d,j=8.6hz,2h),7.61(d,j=8.6hz,2h),6.89(d,j=4.2hz,1h),5.89(d,j=4.0hz,1h),4.55
–
4.46(m,1h),4.26
–
4.14(m,1h),3.61
–
3.47(m,2h),3.29(dd,j=14.1,9.4hz,1h),2.43
–
2.29(m,4h),2.11
–
2.01(m,1h),1.95
–
1.84(m,1h),1.83
–
1.71(m,1h),1.37(s,9h).
13
c nmr(101mhz,cdcl3)δ188.02,158.00,138.32,136.65,130.28,127.74,126.54,119.63,106.17,61.15,46.09,35.34,31.08,30.12,27.18,25.86,21.56.
[0179]
实施例18:1-(8-((4-甲氧基苯基)磺酰基)甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0180][0181]
1、实验方法
[0182]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、4-甲氧基苯磺酰氯(82.8mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在5w蓝色led光照射下(距离光源约2cm),于25℃反应24小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0183]
2、实验结果
[0184]
由图19所示,图19中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率94%;
[0185]
产物表征:1h nmr(400mhz,cdcl3)δ7.91
–
7.85(m,2h),7.11
–
6.99(m,2h),6.89(d,j=4.2hz,1h),5.89(d,j=4.1hz,1h),4.55
–
4.44(m,1h),4.24
–
4.13(m,1h),3.91(s,3h),3.56
–
3.45(m,2h),3.27(dd,j=14.7,9.8hz,1h),2.38(s,3h),2.35
–
2.25(m,1h),2.11
–
1.98(m,1h),1.94
–
1.83(m,1h),1.79
–
1.66(m,1h).
13
c nmr(101mhz,cdcl3)δ188.01,163.91,138.37,131.15,130.26,130.09,119.67,114.69,106.17,61.45,55.78,46.07,30.24,27.18,25.84,21.55.
[0186]
实施例19:1-(8-((丁基磺酰基)甲基)-5,6,7,8-四氢吲哚嗪-3-基)乙烷-1-酮的制备
[0187][0188]
1、实验方法
[0189]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、丁基磺酰氯(62.8mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在10w蓝色led光照射下(距离光源约2cm),于25℃反应36小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=6:1)分离得到产物。
[0190]
2、实验结果
[0191]
由图20所示,图20中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固
体,收率78%;
[0192]
产物表征:1h nmr(400mhz,cdcl3)δ6.88(d,j=4.2hz,1h),5.99
–
5.95(m,1h),4.50
–
4.40(m,1h),4.21
–
4.10(m,1h),3.64
–
3.54(m,1h),3.32(dd,j=13.9,3.5hz,1h),3.07(dd,j=13.9,9.6hz,1h),3.00
–
2.93(m,2h),2.35
–
2.25(m,4h),2.05
–
1.96(m,1h),1.91
–
1.66(m,4h),1.48
–
1.38(m,2h),0.91(t,j=7.4hz,3h).
13
c nmr(101mhz,cdcl3)δ188.11,138.19,130.41,119.68,106.24,57.23,54.38,46.12,29.32,27.22,26.04,24.03,21.78,21.50,13.61.
[0193]
实施例20:1-(4-((3-乙酰基-5,6,7,8-四氢吲哚嗪-8-基)甲基)磺酰基)苯基)乙烷-1-酮的制备
[0194][0195]
1、实验方法
[0196]
在氩气保护下,依次将1-(戊-4-烯-1-基)-1h-吡咯-2-基)乙烷-1-酮(35.4mg,0.2mmol)、4-乙酰苯磺酰氯(87.6mg,0.4mmol)、磷酸氢二钠(56.8mg,0.4mmol)和无水乙腈(2ml)加入干燥的schlenk管(10ml)中,反应管在10w蓝色led光照射下(距离光源约2cm),于25℃反应12小时。反应结束后,减压除去溶剂,硅胶柱层析(200~300目,石油醚:乙酸乙酯=5:1)分离得到产物。
[0197]
2、实验结果
[0198]
由图21所示,图21中a为核磁共振1h谱图,b为核磁共振
13
c谱图,所得产物为白色固体,收率75%;
[0199]
产物表征:1h nmr(400mhz,cdcl3)δ8.16(d,j=8.5hz,2h),8.07(d,j=8.5hz,2h),6.89(d,j=4.2hz,1h),5.89(d,j=4.1hz,1h),4.54
–
4.44(m,1h),4.25
–
4.13(m,1h),3.61
–
3.49(m,2h),3.33(dd,j=14.1,9.3hz,1h),2.69(s,3h),2.37(s,3h),2.35
–
2.26(m,1h),2.10
–
2.00(m,1h),1.95
–
1.83(m,1h),1.80
–
1.70(m,1h).
13
c nmr(101mhz,cdcl3)δ196.66,188.09,143.36,141.02,137.74,130.37,129.27,128.32,119.63,106.19,60.99,46.03,30.02,27.20,27.02,25.89,21.52.
[0200]
最后用说明的是:以上所述仅为本发明的优选实验而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行同等替换。凡在本发明的精神和原则之内,所作的任何修改、同等替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1