一种调节猪未成熟睾丸支持细胞乳酸分泌水平的方法及应用
1.本发明属于细胞基因工程领域,具体涉及一种调节猪未成熟睾丸支持细胞乳酸分泌水平的方法及应用。
背景技术:
2.间质细胞和支持细胞是动物睾丸中影响精子发生的两类最重要的体细胞。没有支持细胞,雄性生殖细胞在体内无法存活和成熟。支持细胞产生的乳酸既可以为精子发生提供必须的能量底物,也可以作为一种旁分泌因子调节生精细胞的功能。还有研究表明,睾丸内输入乳酸能提高成年隐睾精子的生产。因此,调节猪未成熟睾丸支持细胞系中乳酸分泌水平对研究哺乳动物精子发生具有重大意义。
3.hsp90aa1是hsp90s家族成员之一,是atp依赖的分子伴侣,利用其atp酶活性来驱动辅蛋白的构象变化,促进目的蛋白的折叠、稳定和激活,影响多种细胞功能。但由于其在结构和功能上固有的复杂性,想要全面了解这一分子伴侣蛋白,仍需面临挑战。
4.有研究发现在性成熟猪睾丸中,精原细胞,精母细胞、圆形精子和长形精子细胞表达hsp90,但尚未有文献报道hsp90aa1在调节猪未成熟睾丸支持细胞乳酸分泌水平上的应用。
5.为了改变hsp90aa1在猪睾丸支持细胞中的表达水平,本发明采用在猪睾丸支持细胞中转染hsp90aa1过表达和hsp90特异抑制剂17-aag处理来提高或降低hsp90aa1的表达水平,然后运用酶联免疫反应方法检测改变hsp90aa1表达对猪未成熟睾丸支持细胞乳酸生成水平的调节。
技术实现要素:
6.本发明的目的在于:(1)提供通过过表达hsp90aa1提高猪未成熟睾丸支持细胞乳酸分泌的应用;(2)提供通过17-aag处理降低猪未成熟睾丸支持细胞hsp90aa1表达从而降低乳酸分泌的应用。
7.为了实现以上目的,本发明通过如下技术方案进行实现:
8.培养猪未成熟睾丸支持细胞系。
9.本发明首先提供一种提高猪未成熟睾丸支持细胞系中乳酸分泌水平的重组质粒,通过在pbi-cmv3质粒中插入hsp90aa1基因,一代测序获得的猪hsp90aa1全长cds序列(2202bp)如seq id no.1所示。
10.具体重组质粒的制备方法如下:
11.构建猪hsp90aa1的过表达载体pbi-hsp90aa1.猪未成熟睾丸支持细胞hsp90aa1基因的分子克隆和测序,参考ncbi中nm_213973.2(https://www.ncbi.nlm.nih.gov/nuccore/nm_213973.2)设计引物,以猪未成熟睾丸支持细胞中获得的总rna进行rt-pcr扩增获得hsp90aa1的全长编码序列,克隆进入t载体进行测序。把hsp90aa1全长编码序列通过mlui和noti内切酶插入pbi-cmv3空载体(clontech)的多克隆位点构成pbi-hsp90aa1过表
达载体。构建的pbi-hsp90aa1过表达载体通过mlui和noti酶切,琼脂糖胶鉴定构建载体的大小,如图1所示,即可得到重组质粒。
12.扩增hsp90aa1 cds的上游引物序列:5
′‑
gagaacgcgtatgcccgaggaa-3
′
13.扩增hsp90aa1 cds的下游引物序列:5
′‑
gagagcggccgcctaatcgacttc-3
′
。
14.具体转染过表达hsp90aa1质粒的方法如下:
15.用hd(promega)试剂转染过表达载体进入猪未成熟睾丸支持细胞,对照组为空载体pbi-cmv3,实验组pbi-hsp90aa1。当细胞密度达到80%左右时转染。
16.本发明还提供一种有效检测猪未成熟睾丸支持细胞系中乳酸分泌水平的方法,hsp90aa1作为检测猪未成熟睾丸支持细胞系中乳酸分泌水平的标记基因,即检测猪未成熟睾丸支持细胞系中hsp90aa1基因的表达水平。具体的,标记基因的应用通过用rt-qpcr检测转染猪未成熟睾丸支持细胞的hsp90aa1 mrna、western blot检测转染猪未成熟睾丸支持细胞的蛋白水平、细胞免疫荧光检测转染猪未成熟睾丸支持细胞的蛋白定位,或用elisa检测过表达hsp90aa1后细胞中乳酸脱氢酶活性和乳酸水平。
17.转染24h后收集样品,提取总rna和蛋白,通过rt-qpcr和western blot验证过表达的mrna和蛋白水平,通过免疫荧光检测过表达后蛋白的水平和定位,然后进一步用酶联免疫反应检测过表达hsp90aa1对猪未成熟睾丸支持细胞乳酸水平的改变。
18.用allylamino-17-demethoxygeldanamycin(17-aag;abcam,货号ab141433)处理猪未成熟睾丸支持细胞特异抑制hsp90aa1,对照组为dmso溶剂,实验组为2μm 17-aag。处理36h后收集样品,提取总蛋白,通过western blot验证hsp90aa1蛋白水平的降低,然后进一步用酶联免疫反应检测抑制hsp90aa1对猪未成熟睾丸支持细胞乳酸水平的改变。
19.与现有技术相比,本发明的有益效果包括:通过hsp90aa1的表达达到调节猪未成熟睾丸支持细胞内源乳酸的产生和代谢水平,影响细胞的功能,为进一步体外研究细胞内源乳酸产生和代谢对雄性生殖的效应提供了一种有益的方法。
20.本发明方法简单,通过hsp90aa1基因的表达调节猪未成熟睾丸支持细胞中乳酸的分泌水平:过表达猪未成熟睾丸支持细胞的hsp90aa1基因后,猪未成熟睾丸支持细胞中hsp90aa1mrna和蛋白的表达水平显著上升,细胞的乳酸脱氢酶活性显著上升,细胞产生乳酸的水平显著升高。17-aag处理猪未成熟睾丸支持细胞后,猪未成熟睾丸支持细胞中hsp90aa1蛋白的表达水平显著下降,细胞的乳酸脱氢酶活性显著下调,细胞产生乳酸的水平显著降低。
附图说明
21.图1:构建猪hsp90aa1过表达载体,图1a为rt-pcr扩增的猪hsp90aa1全长编码序列的琼脂糖胶电泳图;图1b为pbi-cmv3空的表达载体图谱;图1c为将猪hsp90aa1的全长编码序列克隆到pbi-cmv3表达载体后的pbi-hsp90aa1过表达载体图谱;图1d为酶切后琼脂糖胶电泳鉴定插入序列和空载体的大小;
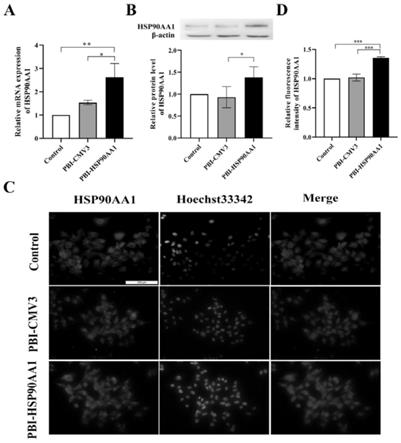
22.图2:hsp90aa1过表达效果检测,图2a为rt-qpcr检测转染pbi-hsp90aa1 24h后hsp90aa1的mrna水平,图2b为western blot检测转染pbi-hsp90aa1 24h后hsp90aa1的蛋白表达;图2c为细胞免疫荧光检测转染pbi-hsp90aa1 24h后hsp90aa1蛋白的荧光强度和定位;图2d为定量分析转染pbi-hsp90aa1 24h后hsp90aa1蛋白的细胞免疫荧光强度:
control,没转染组;pbi-cmv3,转染空载体组;pbi-hsp90aa1,转染hsp90aa1过表达载体组;*,p《0.05;**,p《0.01;***,p《0.001(放大倍数:标尺100μm);
23.图3:酶联反应检测过表达hsp90aa1调节乳酸水平和乳酸脱氢酶活性,图3a为过表达hsp90aa1显著升高猪未成熟睾丸支持细胞乳酸生成的水平;图3b为过表达hsp90aa1显著提高乳酸脱氢酶的活性;*,p《0.05;
24.图4:17-aag处理猪未成熟睾丸支持细胞,图4a为2μm 17-aag处理猪未成熟睾丸支持细胞36h的明场照片(放大倍数:标尺500μm);图4b为2μm 17-aag处理猪未成熟睾丸支持细胞36h显著降低hsp90aa1的蛋白水平;*,p《0.05;
25.图5:酶联反应检测17-aag抑制hsp90aa1调节乳酸水平和乳酸脱氢酶活性,图5a为2μm 17-aag处理猪未成熟睾丸支持细胞36h抑制hsp90aa1蛋白水平后显著降低细胞乳酸生成的水平;图5b为2μm 17-aag处理猪未成熟睾丸支持细胞36h抑制hsp90aa1蛋白水平后显著降低乳酸脱氢酶的活性;**,p《0.01。
具体实施方式
26.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
27.实施例1:hsp90aa1过表达载体的构建及转染
28.参照genbank上公布的hsp90aa1序列,设计并合成1对引物,扩增hsp90aa1全长,上游引物5
′‑
gagaacgcgtatgcccgaggaa-3
′
,下游引物5
′‑
gagagcggccgcctaatcgacttc-3
′
。以睾丸支持细胞cdna为模板,用2
×
pcr solution premix primehs酶扩增hsp90aa1基因片段,预计扩增的片段大小为2202bp。pcr反应条件:98℃变性10s,60℃退火15s,72℃延伸2min,30个循环。1.0%琼脂糖凝胶电泳观察结果,根据片段大小判断是否准确。切胶回收目的片段,测浓度,双酶切,16℃过夜连接t载体并转化感受态大肠杆菌,挑取阳性克隆进行菌落pcr鉴定,阳性重组子扩大培养,提取质粒测序比对。测序正确的质粒与空载体质粒pbi-cmv3都进行双酶切,跑胶,目的片段切胶回收,浓度测定,16℃过夜连接,将连接产物进行转化后阳性克隆筛选,扩大培养,提取质粒并双酶切验证目的基因的插入。当猪未成熟睾丸支持细胞密度达到80%左右时开始转染,注意整个转染过程中都不加双抗。采用hd试剂转染质粒,具体反应体系为pbi-cmv3/pbi-hsp90aa1质粒2μg,hd 7.5μl,无血清培养基100μl。细胞转染24h后收样备用。
29.如图1所示,构建过表达载体成功,测序结果与数据库中猪hsp90aa1的cds序列一致。
30.实施例2:rt-pcr、western和细胞免疫荧光检测过表达效果
31.rt-qpcr:将没转染的对照组,转染空载体组和转染hsp90aa1过表达载体组细胞收集,trizol提取总rna,abi反转录试剂盒反转录,罗氏faststart universal stbr green master(rox)试剂盒准备qpcr,pcr反应条件如下:50℃ 2min,95℃ 10min,95℃ 15s,60℃ 60s,40个循环,上游引物:5
’‑
atcgcccagttgatgtcgtt-3’,下游引物:5
’‑
gtgagggtccggtcttgct-3’。以β-actin为内参基因,利用2-δδct的方法对表达量进行计算,用spss软件统计分析。
32.western:将没转染的对照组,转染空载体组和转染hsp90aa1过表达载体组细胞收集,ripa(含pmsf,1:100)裂解液裂解,离心取上清获得细胞全蛋白,bca法测定浓度。电泳条件5%浓缩胶80v,40分钟;12%分离胶120v,100分钟。转膜条件200ma,70分钟。hsp90aa1和β-actin一抗稀释比例1:1000,二抗稀释比例1:10000。image j分析灰度值。
33.细胞免疫荧光:将没转染的对照组,转染空载体组和转染hsp90aa1过表达载体组细胞4%pfa室温下固定40min,1%triton透膜液中打孔过夜,1%bsa室温封闭1h,1%bsa稀释的兔抗hsp90aa1多克隆抗体(1:50)4℃孵育过夜,清洗液(含有0.01%tritonx-100,0.1%tween-20的pbs)中洗3次,1%bsa按照1:150的比例稀释二抗(goat anti-rabbit igg(h&l))室温处理1h(避光),hoechst33342染核,防荧光淬灭剂封片,倒置荧光显微镜下观察拍照,莱卡激光共聚焦显微镜下扫图,数据分析。
34.如图2所示,与没转染的对照组和转染空载体组相比,实验组转染hsp90aa1过表达载体的细胞的mrna和蛋白水平显著升高(*,p《0.05;**,p《0.01;***,p《0.001),说明构建的过表达载体能够显著提高猪未成熟睾丸支持细胞种hsp90aa1的表达。
35.实施例3:过表达hsp90aa1可显著提高猪未成熟睾丸支持细胞乳酸脱氢酶的活性和乳酸的产生
36.乳酸测定:由乳酸检测试剂盒检测。首先,取20μl空载体组和过表达组细胞上清液加入5ml ep管中,向ep管中分别加入1ml工作液(由酶贮备液和酶稀释液按1:100配置)、200μl显色剂,混匀后置于37℃水浴中反应10min后,每管加入2ml终止液),将反应后的样品加入至酶标板中,200μl/孔,每组3个重复。在酶联免疫检测仪od530nm条件进行吸光度检测。保持所有实验条件一致,进行三次重复实验。根据标准品计算出对照组和过表达组细胞分泌乳酸的水平。
37.乳酸脱氢酶活性测定:由乳酸脱氢酶检测试剂盒检测。取20μl空载体组和过表达组细胞上清液,加入25μl基质缓冲液,5μl辅酶i,混匀后置于金属浴(37℃)中反应15min,加入25μl 2,4-二硝基苯肼,继续置于金属浴(37℃)中反应15min后加入250μl 0.4mol/l naoh溶液,在酶联免疫检测仪od450nm处测量吸光度值。保持所有实验条件一致,进行三次重复实验。根据标准品计算出对照组和过表达组乳酸脱氢酶活性。
38.如图3所示:与空载体组相比,转染hsp90aa1过表达载体的实验组乳酸水平和乳酸脱氢酶活性均明显上升(*,p《0.05),说明升高hsp90aa1表达后能够显著促进猪未成熟睾丸支持细胞分泌乳酸。
39.实施例4:17-aag处理猪未成熟睾丸支持细胞
40.细胞置于37℃ 5%的co2细胞培养箱中培养至密度达30%后,17-aag处理组加入2μm的17-aag,dmso组加入与17-aag等体积的dmso,培养箱培养36h收集细胞,参照上文描述的western blot步骤检测hsp90aa1蛋白水平。
41.如图4所示,实验组2μm 17-aag处理36h的猪未成熟睾丸支持细胞的hsp90aa1的蛋白水平明显比对照组dmso少(*,p《0.05),说明2μm 17-aag处理36h能明显抑制hsp90aa1的蛋白表达。
42.实施例5:17-aag抑制hsp90aa1的表达可显著降低猪未成熟睾丸细胞乳酸的分泌
43.取2μm 17-aag处理组和dmso对照组的猪未成熟睾丸支持细胞培养液上清,参照上文的实验步骤检测乳酸水平和乳酸脱氢酶的活性。
44.如图5所示,实验组2μm 17-aag的乳酸水平和乳酸脱氢酶的活性均明显比对照组dmso组低(**,p《0.01),说明17-aag抑制hsp90aa1的表达能下调猪未成熟睾丸支持细胞的乳酸生成。
45.以上所述本发明的具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所做出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1