一种携带TMTP1和HSV-TK的溶瘤腺病毒重组体、其构建方法及应用
一种携带tmtp1和hsv-tk的溶瘤腺病毒重组体、其构建方法及应用
技术领域
1.本发明涉及一种携带tmtp1和hsv-tk的溶瘤腺病毒重组体、其构建方法及应用,属于医学基因工程技术领域。
背景技术:
2.基因治疗(gene therapy)是指将外源基因导入靶细胞,以纠正或补偿因基因缺陷或基因表达异常引起的疾病。作为基因治疗载体,溶瘤病毒治疗恶性肿瘤的发展前景良好。在众多溶瘤病毒疗法的载体中,重组腺病毒载体是应用最为广泛的,其临床可行性和安全性已获公认。腺病毒基因治疗载体具有以下生物学优势和临床应用优势:(1)感染谱广,对多种组织源性的细胞,无论是处于分裂期还是静止期的细胞,均能有效攻击,抗癌谱广;(2)腺病毒进入细胞后,不整合到宿主染色体,无突变和致癌的危险性,临床应用安全,使用后仅产生类似感冒样症状,无造血功能和免疫功能抑制;(3)临床应用方便,有腔隙(如腹腔、胸腔和颅腔)给药、局部或瘤体内直接注射(一点或多点)以及介入治疗等途径;(4)腺病毒在体内持续表达仅两到三周,尤其适合肿瘤治疗;(5)经静脉或局部应用仅产生轻微的炎症反应,副作用轻微;(6)临床级数量的腺病毒易于生产和纯化。基于以上的优势,越来越多的腺病毒载体被构建产生,并显示出良好的临床应用前景。
3.虽然腺病毒相较于其它各种基因治疗载体表现出明显的优势,国内外现有的腺病毒治疗载体也逐步取得了一些突破性的进展,但仍然有一些不可规避的缺点限制其广泛应用,具体如下:(1)肝脏趋向性。腺病毒进入生物体后,无论是静脉系统性注射,或是瘤内注射,胸腔、腹腔等局部注射,生物体内凝血因子十(fx)会迅速识别腺病毒衣壳蛋白hexon,与其结合,并将腺病毒带至肝脏,凝血因子的另一侧则与肝细胞表面的硫酸类肝素蛋白多糖(heparan sulfate proteoglycans,简称hspgs)结合,即凝血因子在腺病毒与肝细胞间形成桥梁,被肝脏捕获的腺病毒则逐渐被kupffer细胞或者肝脏中的巨噬细胞吞噬。而未被清除的腺病毒在肝脏中大量复制,导致肝脏急性损伤,表现为转氨酶迅速升高。(2)腺病毒感染肿瘤细胞,依赖于肿瘤细胞表面柯萨奇腺病毒受体(car)。而在大多数肿瘤细胞中,受体处于低表达状态,不利于腺病毒进入肿瘤细胞内发挥杀伤作用。
4.综上,目前肿瘤治疗技术和实践中均存在各种弊端,因此,有必要提供一种新的靶向与强效杀伤兼具的治疗应用途径,以解决现有技术的不足。
技术实现要素:
5.本发明的目的之一,是提供一种携带tmtp1和hsv-tk的溶瘤腺病毒重组体。
6.本发明解决上述问题的技术方案如下:一种携带tmtp1和hsv-tk的溶瘤腺病毒重组体,该携带tmtp1和hsv-tk的溶瘤腺病毒重组体为ad5/δe1a/tmtp1δadp/hsv-tk,其核苷酸序列如seq id no.23所示,是在人类5型腺病毒基因的e1a保守序列2区缺失第920nt-946nt区域如seq id no.1所示的27个碱基,再在hexon高变区5的第19641nt-19655nt区域
插入如seq id no.15所示的编码肿瘤靶向肽tmtp1的基因序列,同时缺失e3区位于adp基因第29477nt-29714nt区域,构成缺失区,再在所述缺失区插入如seq id no.22所示的编码hsv-tk基因的全长编码序列并引入cla1酶切位点。
7.本技术的发明人,为了获得上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体,进行了如下工作:
8.人类5型腺病毒,英文名称为human adenovirus type 5,简称ad5。
9.在人类5型腺病毒基因的e1a保守序列2区(cr2)缺失第920nt-946nt如seq id no.1所示的27个碱基,在灭活e1a蛋白的rb结合特性的同时,达到尽可能保留e1a转录激活特性的效果。
10.肿瘤靶向肽tmtp1具有靶向高转移潜能肿瘤细胞、早期识别肿瘤亚临床微小转移灶、可选择性被肿瘤细胞内吞并和具备较强的肿瘤细胞毒效应等明显优势。本发明通过在人类5型腺病毒中插入如seq id no.15所示的编码肿瘤靶向肽tmtp1的基因序列,从而显著提高了携带tmtp1和hsv-tk的溶瘤腺病毒重组体的靶向性。
11.hsv-tk基因,单纯疱疹病毒胸苷激酶基因是常用的“自杀”基因,其编码的胸苷激酶可将对细胞无毒或毒性较低的药物前体转化为强细胞毒性物质,以达到杀死肿瘤细胞的目的。本发明通过在人类5型腺病毒(ad5)插入如seq id no.22所示的编码hsv-tk基因的全长编码序列,使hsv-tk基因在肿瘤中特异性表达,促进肿瘤细胞凋亡,从而显著提高了携带tmtp1和hsv-tk的溶瘤腺病毒重组体促凋亡作用和溶瘤病毒溶解细胞的杀伤效应。
12.进一步的,本发明实施例的编码肿瘤靶向肽tmtp1的基因序列插入于人类5型腺病毒基因的hexon高变区2、5和7区域,通过体外实验筛选出能够在肿瘤细胞中高拷贝数复制的最佳腺病毒插入区为高变区5。在hexon高变区5插入编码肿瘤靶向肽tmtp1基因序列,从而破坏hexon蛋白的正常表达,抑制fx与hexon的结合而阻止腺病毒被肝脏吞噬。插入肿瘤靶向肽tmtp1能降低腺病毒对肿瘤细胞表面柯萨奇腺病毒受体(car)的依赖性,增加腺病毒对肿瘤细胞的亲和性;破坏hexon高变区完整性,减少腺病毒在肝脏中聚集,降低腺病毒对肝脏损害。
13.综上,如图1所示,本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体能特异性识别肿瘤及其转移灶,具有更高的肿瘤靶向复制能力,其可发挥hsv-tk基因的促凋亡作用和溶瘤病毒溶解细胞的双重杀伤效应,经体内外实验证实其对顺铂耐药的细胞系有强效杀伤效应,兼具理想的靶向作用和强效杀伤作用。
14.本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的有益效果是:
15.1、本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体具有肿瘤选择性复制及治疗基因表达的强选择性;
16.2、肿瘤细胞内子代溶瘤腺病毒产量高,细胞裂解后在肿瘤局部可产生高浓度的病毒治疗圈,加之与治疗靶点的优势联合,可形成强效的旁观者效应;
17.3、肿瘤细胞内溶瘤腺病毒高效、大量扩增,同时转录出大量治疗靶基因,让肿瘤细胞成为治疗蛋白合成的“加工厂”;
18.4、本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的免疫调节蛋白功能完整,一定程度上避免了机体对重组腺病毒的清除;
19.5、本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的抗癌谱广。肿瘤动物模型
的体内模型研究证实,通过肿瘤局部注射或者腹腔注射的用药途径,本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体对受试的所有肿瘤模型均具有显著的治疗作用,可有效抑制肿瘤转移,且对治疗动物无明显的治疗相关毒性。
20.本发明的目的之二,是提供上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体的构建方法。
21.本发明解决上述问题的技术方案如下:上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体的构建方法,包括如下步骤:
22.步骤1:人类5型腺病毒基因的定向缺失
23.利用基因合成和同源重组的方式定向缺失人类5型腺病毒基因的e1a保守序列2区第920nt-946nt如seq id no.1所示的27个碱基,获得定向缺失后的人类5型腺病毒基因ad5/δe1a;
24.步骤2:制备ad5/δe1a/tmtp1
25.在步骤1获得的定向缺失后的人类5型腺病毒基因的hexon高变区5的第19641nt-19655nt区域,插入如seq id no.15所示的编码肿瘤靶向肽tmtp1的基因序列,获得ad5/δe1a/tmtp1;
26.步骤3:制备携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δe1a/tmtp1δadp/hsv-tk
27.在步骤2获得的ad5/δe1a/tmtp1的e3区位于adp基因第29477nt-29714nt区域,构成缺失区,再在所述缺失区插入如seq id no.22所示的编码hsv-tk基因的全长编码序列并引入cla1酶切位点,即获得如seq id no.23所示的携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δe1a/tmtp1δadp/hsv-tk。
28.本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的构建方法的有益效果是:
29.1、本发明构建的携带tmtp1和hsv-tk的溶瘤腺病毒重组体中插入有编码肿瘤靶向肽tmtp1的基因序列和编码hsv-tk基因的全长编码序列,具有肿瘤特异性复制、高度肿瘤及其转移瘤靶向性、特异性大量表达外源性治疗基因、强大的肿瘤特异性旁观者效应等优势,并具备高度的治疗指数,可以解决目前肿瘤治疗技术和实践中关键的不足之处,为肿瘤治疗提供了理想的靶向与强效杀伤兼具的治疗应用途径。
30.2、本发明的构建方法简单,操作容易,成本低廉,应用前景广泛。
31.本发明的目的之三,是提供上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体的应用。
32.本发明解决上述问题的技术方案如下:上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体在制备治疗肿瘤的药物中的应用。
33.本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的应用的有益效果:
34.上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体可以用于制备治疗肿瘤的药物,既开拓了新的治疗肿瘤的药物,又开拓了携带tmtp1和hsv-tk的溶瘤腺病毒重组体的用途,具有积极的药学价值和广泛的社会意义。
35.本发明的目的之四,是提供上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体的另一个应用。
36.本发明解决上述问题的技术方案如下:上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体在制备基因治疗载体中的应用。
37.本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的应用的有益效果:
38.上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体可以用于制备基因治疗载体,既开拓了新的基因治疗载体,又开拓了携带tmtp1和hsv-tk的溶瘤腺病毒重组体的用途,具有积极的药学价值和广泛的社会意义。
39.本发明的目的之五,是提供上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体的另一个应用。
40.本发明解决上述问题的技术方案如下:上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体在制备改善备抗肿瘤化疗药物耐药性的药物中的应用。
41.本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的应用的有益效果:
42.上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体可以用于制备改善备抗肿瘤化疗药物耐药性的药物,既开拓了新的改善备抗肿瘤化疗药物耐药性的药物,又开拓了携带tmtp1和hsv-tk的溶瘤腺病毒重组体的用途,具有积极的药学价值和广泛的社会意义。
43.本发明的目的之六,是提供上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体的另一个应用。
44.本发明解决上述问题的技术方案如下:上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体在制备抗肿瘤化疗药物增敏剂中的应用。
45.本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体的应用的有益效果:
46.上述携带tmtp1和hsv-tk的溶瘤腺病毒重组体可以用于制备抗肿瘤化疗药物增敏剂,既开拓了新的抗肿瘤化疗药物增敏剂,又开拓了携带tmtp1和hsv-tk的溶瘤腺病毒重组体的用途,具有积极的药学价值和广泛的社会意义。
附图说明
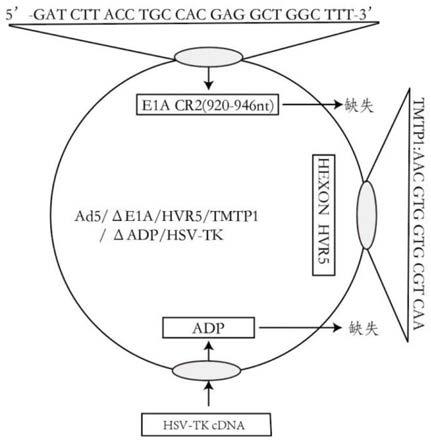
47.图1为本发明实施例的携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δe1a/hvr5/tmtp1δadp/hsv-tk的结构示意图。
48.图2为本发明实施例5中hexon高变区插入区不同的腺病毒在肿瘤细胞中复制柱状图。
49.图3为实施例6中ad5/δe1a/hvr5/tmtp1δadp/hsv-tk在不同细胞中复制柱状图。
50.图4为实施例6中不同处理组中小鼠肿瘤生长曲线图。
51.图5为实施例6中不同处理组小鼠各组织中腺病毒的含量。
52.图6为本发明实施例7中腹腔原位转移瘤模型的实验动物的谷丙转氨酶(alt)实验结果。
53.图7为本发明实施例7中腹腔原位转移瘤模型的实验动物的谷草转氨酶(ast)实验结果。
54.图8为本发明实施例7中腹腔原位转移瘤模型的实验动物的尿素氮(bun)实验结果。
55.图9为本发明实施例7中腹腔原位转移瘤模型的实验动物的肌酐(creatinine)实验结果。
fastpfu fly dna polymerase,1μl;5
×
transstart fastpfu fly buffer,10μl;10μm上游引物,1μl;10μm下游引物,1μl;2.5mm dntps,4μl;无核酸酶水,补足体系至50μl;模板,10-30ng;共计50μl。pcr扩增反应的程序为95℃,2min;95℃,20s,-5℃,20s,72℃,3min,35个循环;72℃,5min;4℃,保存。
67.在t4连接酶(购自赛默飞世尔科技公司,货号为el0011)的作用下,将e1a序列连接至peasy-blunt-zero平端连接质粒(购自北京全式金生物技术有限公司,货号为cb501)中,获得穿梭质粒blunt-zero-e1a/δe1a。
68.以穿梭质粒blunt-zero-e1a/δe1a为模板,采用上述peasy-blunt-zero平端连接质粒试剂盒中自带的引物进行pcr扩增反应,获得缺失27bp的e1a穿梭片段,纯化后以备同源重组。pcr反应体系及扩增反应程序同上。
69.步骤1.2:构建骨架质粒pad-easy-1
70.pad-easy-1载体(购自安捷伦科技有限公司,目录号为240005),用限制性内切酶pme1切断后,苯酚氯仿抽提dna酶切产物,以其作为第一次同源重组的骨架片段,测出穿梭片段及骨架片段的dna浓度。
71.步骤1.3:制备大肠杆菌bj5183电转感受态
72.取出于-80℃保存的大肠杆菌bj5183(购自北京科瑞思搏生物科技有限公司,目录号为st10779),融化后,挑取1ml菌液加入到1000ml链霉素浓度为30μg/ml的lb培养基中。以250rpm/min的速度37℃摇菌7h-8h后,每10min观察一次,液体稍变浑浊即可。将菌液分装入预冷的离心管中,4℃,3000rpm/min离心10min,弃上清。适量预冷无菌双蒸水洗菌渣,两次。适量预冷无菌10%甘油洗菌渣,两次。弃上清,获得大肠杆菌bj5183电转感受态,分装于1.5ml离心管中,-80℃保存。
73.步骤1.4:同源重组构建pad5-e1a/δe1a腺病毒包装质粒
74.采用genepulser xcelltm电转仪(购自bio-rad公司),将步骤1.1获得的e1a穿梭片段以及步骤1.2获得的骨架片段,电转入步骤1.3获得的大肠杆菌bj5183电转感受态中,电转条件为2.5kv、25μf。采用卡那霉素抗性筛选阳性菌。挑选菌板中较小的菌斑,lb培养基中培养后,质粒小量提取,使用上游引物:5
′‑
ttaattaacatcatcaataatataccttatt-3
′
(seq id no.8)和下游引物:5
′‑
gatccacataatctaacacaaactc-3
′
(seq id no.9)进行pcr扩增反应,pcr扩增反应的体系及反应程序同步骤1.1,测序鉴定e1a区域是否缺失920bp-946bp区域。将提取的质粒转入高拷贝菌dh10b(购自赛默飞世尔科技公司,货号为18290015)中,获得pad5-e1a/δe1a腺病毒包装质粒,简写为pad5/δe1a。
75.实施例2:构建pad5/δe1a/hexon(hvr/tmtp1)质粒载体
76.步骤2.1:构建穿梭载体peasy-blunt-zero-hexon(hvr/tmtp1)
77.pbhge3购于microbix biosystem inc.(toronato,ontario,canada,目录号:pd-01-12),该质粒包含除ad5包装信号(194-358nt)外的全部基因组序列。pbhge3从microbix biosystem inc.获取时,总量为10μg,先电转入感受态细菌,挑取阳性克隆,提取质粒,得到的质粒用cscl2-eb超速离心法纯化。同源重组法获取δ920-946ad5重组腺病毒构建体,方法如下:
78.在15cm培养皿中种入7.5
×
105293细胞,培养液为10%fbs dmem,到第二天,细胞应为1-1.5
×
106,大约70%的细胞融合;转染前3-4h,换成新鲜培养液。配制共转染dna-磷
酸钙溶液:将1600μl灭菌的2
×
hbs(280mm nacl,43mm hepes,10mm kcl,10mm na2hpo4·
7h2o,2%dextrose,ph值7.05-7.15);pbhge3和δ920-946pxc1各42μg;加灭菌的双蒸水至2840μl混匀,缓慢加入50μl 2.5m的cacl2,颠倒混匀,在室温下让dna/cacl2沉淀45-60min,形成微混浊的沉淀。加500μl上述混合液至含5ml 60mm培养皿的293细胞中,在37℃、5%co2中孵育4-6h,吸去上述液体,用pbs洗一次。用含15%的甘油/dmem处理1-2min以促进转染效率,用pbs洗一次,换为完全培养液。制备1.8%低溶点琼脂糖,高压灭菌,分装成5ml,用前在沸水中融化,保温在45℃,用时加入等量4%fbs dmem,即刻铺入培养皿中。吸去培养液,加入5ml上述液体。每4-5d,加入3ml上述液体。14-21d,噬斑出现,选定6-12个噬斑。将噬斑转移到含无血清dmem培养基,1.5ml的ep管中,在37℃孵育24h。在24孔板培养皿中种入1
×
105293细胞,培养液为10%fbs dmem,到第二天,细胞应为2
×
105,大约70%的细胞融合,吸去液体,从上述孵育液取100μl(大约为103病毒)加入,轻轻晃动液体3次,在37℃、5%co2中孵育90min。加入完全培养基至1ml,将细胞放置于37℃,5%co2中孵育5-10d,直至完全的cpe出现,所谓cpe,即细胞毒效应,细胞表现为变圆、漂浮、细胞以核仁为主。假如10d后,完全的cpe未出现,则提示病毒的效价太低,需进行第二轮的扩增。将培养板进行三轮的冻/解冻的循环,释放出病毒,将裂解液收集于15ml试管,最大速度离心10min,收集上清液,冻于-80℃,该液体称为第二代病毒,大约为5
×
107/ml病毒。对以上病毒进行再次扩增,在75cm2培养皿中种入5
×
106293细胞,培养液为10ml 10%fbs dmem,到第二天,细胞应为1
×
107,大约70%细胞融合;转染前3-4h,换成新鲜培养液;取1ml第二代病毒储存液加入完全培养基至1ml,用于转染;该moi约为5;除去75cm2培养皿的液体,加入以上液体,轻轻摇动三次;在37℃、5%co2中孵育90min;加入9ml 2%fbs dmem,在37℃、5%co2中孵育4-7d,用于提取病毒dna用于阳性病毒的筛选。因为293细胞基因组包含完整的e1a基因,提取阳性病毒dna时容易污染293细胞dna,造成鉴定失败,为此将δ920-946ad5在肿瘤细胞hela中再扩增一次,用于鉴定,步骤如下:在6孔板培养皿中种入1
×
105hela细胞,培养液为10%fbs dmem,到第二天,细胞应为2
×
105,大约70%的细胞融合,吸去液体,从上述滤过液取100μl(大约为103病毒)加入,轻轻晃动液体3次,在37℃、5%co2中孵育90min。加入完全培养基至1ml,将细胞放置于37℃、5%co2中孵育5-10d,直至完全的cpe出现,将细胞刮下,收集于1.5ml ep管,离心弃上清,加入300μl pbs溶液,进行三轮的冻/解冻的循环,释放出病毒,将裂解液最大速度离心10min,收集上清液,冻于-80℃,用qiagen公司试剂盒mini dna isolation kit,参照试剂盒说明提取dna。以病毒dna为模板,进行pcr反应,上游引物:5
′‑
cgggatccgggcccccatttcc-3
′
(seq id no 10),下游引物:5
′‑
tgctctagacacaggtgatgtcg-3
′
(seq id no 11),反应体系总体积为100μl包括:含mgcl2的10
×
pcr缓冲液,10μl;2mm dntp,10μl;10μm上游引物,1μl;10μm下游引物,1μl;病毒dna,10ng;pfu高保真taq酶,2.5u;加水至100μl。反应条件为:95℃,30s;95℃,45s;60℃,1min;72℃,2min;共28循环;72℃延伸10min。pcr产物为1400bp,常规电泳分离纯化后,检测浓度用于dna测序,测序引物:5
′‑
agccggagcagagagccttg-3
′
(seq id no12),挑出测序正确克隆,即为δ920-946ad5。以腺病毒δ920-946ad5为模板,采用primer5.0软件设计引物,使用上游引物:5
′‑
ccagagtaggtgtaataagg-3
′
(seq id no.13)和下游引物:5
′‑
tagaaagtcaagtggaaatg-3
′
(seq id no.14),将腺病毒的18380bp-20388bp(即hexon区域),采用pcr扩增反应,获得hexon片段,并将该片段平端连接入peasy-blunt-zero载体(购自北京全式金生物技术有限
公司,目录号为cb501)中,获得peasy-blunt-zero-hexon质粒。
79.采用primer5.0软件设计引物,使用双重pcr扩增反应,将如seq id no.15所示的编码肿瘤靶向肽tmtp1的基因序列分别插入hexon高变区2、5和7区域中,获得peasy-hexon(hvr/tmtp1)pcr扩增产物,然后利用hexon区域的特异性酶切位点draⅲ和saci,分别双酶切上述pcr产物peasy-hexon(hvr/tmtp1)和peasy-blunt-zero-hexon质粒,切胶回收酶切产物后,用t4连接酶连接上述产物,将连接物转化入dh10b感受态后,筛选阳性菌斑,分别获得peasy-blunt-zero-hexon(hvr2/tmtp1)穿梭质粒、peasy-blunt-zero-hexon(hvr5/tmtp1)穿梭质粒和peasy-blunt-zero-hexon(hvr7/tmtp1)穿梭质粒。
80.步骤2.2:将步骤1.4中构建的骨架质粒pad5-e1a/δe1a大量提取(omega,货号d6692-01),利用特异性酶切位点asisi,酶切后,苯酚氯仿抽提,获得线性骨架质粒。
81.步骤2.3:采用步骤2.1获得的peasy-hexon(hvr/tmtp1)pcr产物作为同源重组片段,与步骤2.2获得的线性骨架质粒同时电转入步骤1.3获得的大肠杆菌bj5183电转感受态中,电转条件为2.5kv、25μf。采用卡那霉素抗性筛选阳性菌,pcr扩增反应,鉴定获得pad5-e1a/δe1a-hexon(hvr2/tmtp1)质粒、pad5-e1a/δe1a-hexon(hvr5/tmtp1)质粒和pad5-e1a/δe1a-hexon(hvr7/tmtp1)质粒。
82.实施例3:构建ad5/δe1a/tmtp1/hsv-tk腺病毒载体
83.步骤3.1构建腺病毒e3区穿梭载体
84.以腺病毒δ920-946ad5为模板(上文所述,包含腺病毒e3区完整序列),进行pcr反应,上游引物:5
′‑
tgtcaccactaactgctttactcg-3
′
(seq id no 16),下游引物:5
′‑
gctgccctgcgtctttcta-3
′
(seq id no 17),获得26342-31140片段(即e3区完整片段),将其连接到peasy-blunt-zero载体中,获得peasy-blunt-zero-e3质粒。
85.步骤3.2:质粒pcdna3.1-e3/δadp为骨架质粒,其内插入完整腺病毒e3区但缺失29477bp-29714bp(腺病毒两个ecori酶切位点之间的片段,即adp区)片段,且两端有ecori酶切位点的片段。其构建方法如下:
86.采用3次pcr法缺失ad5 e3区29477-29714nt。片段1的获取:引物1:5
′‑
atacgcgcccaccgaaac-3
′
(seq id no 18),相当于27306nt-27323nt;引物2:5
′‑
aatctatggatatcgatagggtgggtcgctgtagtt-3
′
(seq id no 19),相当于29477-29495nt,下划线部分为与引物3互补部分,atcgat为cla i酶切位点;以ad5 dna为模板,进行pcr反应,反应体系总体积为100μl包括:含mgcl2的10
×
pcr缓冲液,10μl;2mm dntp,10μl;10μm引物1,1μl;10μm引物2,1μl;ad5 dna 200ng/μl,1μl;pfu高保真taq酶,2.5u;加水至100μl。反应条件为:94℃,30s;94℃,30s;46℃,1min;72℃,1min;共30循环;72℃延伸10min。pcr产物为2207bp(片段1),常规电泳分离纯化后,检测浓度用于后继pcr反应。
87.片段2的获取:引物3:5
′‑
cgacccaccctatcgatatccatagattggacggactg-3
′
(seq id no 20),相当于29714nt-29734n,下划线部分为与引物2互补部分,atcgat为cla i酶切位点;引物4:5
′‑
atgtctttgaggcttggagg-3
′
(seq id no 21),相当于30137nt-30118nt;pcr反应条件同上,产物为422bp(片段2),常规电泳分离纯化后,检测浓度用于后继pcr反应。
88.片段3的获取:将片段1与片段2等量混合,作为模板行pcr反应,上游引物为引物1,下游引物为引物4,反应条件同上,产物约为2612bp(片段3),用qiaquick 8pcr产物纯化试剂盒(qiagen,german,cat:28142)纯化后,用ecori酶切过夜,酶切产物在1%琼脂糖凝胶电
泳分离后回收,酶切片段用于后继连接反应。将pcdna3.1(invitrogen,u.s.a.,cat:v79020)用ecori酶切过夜,酶切产物在1%琼脂糖凝胶电泳分离后回收酶切片段,去磷酸化后用于后继连接反应。将pcr反应产物片段3与酶切、去磷酸化后pcdna3.1连接,取1.5μl转入100μldh5α感受态细菌,挑取阳性克隆,质粒小提,dna测序鉴定筛选得到缺失29477nt-29714nt的pcdna3.1质粒突变体-pcdna3.1-e3/δadp。
89.将如seq id no.22所示的编码hsv-tk基因的全长编码序列引入cla1酶切位点。clai酶切连接入pcdna3.1-e3/δadp质粒中。
90.步骤3.3:将步骤3.2构建的质粒通过ecori酶切,连接入步骤3.1构建的peasy-blunt-zero-e3质粒中,采用上述peasy-blunt-zero-e3质粒试剂盒中自带的引物进行pcr扩增反应,获得e3/hsv-tk片段。
91.步骤3.4:spei酶切步骤2.3构建的pad5-e1a/δe1a-hexon(hvr2/tmtp1)质粒、pad5-e1a/δe1a-hexon(hvr5/tmtp1)质粒和pad5-e1a/δe1a-hexon(hvr7/tmtp1)质粒,苯酚氯仿抽提,回收线性骨架质粒。
92.将线性骨架质粒和步骤3.3获得的e3/hsv-tk片段,电转入步骤1.3获得的大肠杆菌bj5183电转感受肽中,电转条件为2.5kv、25μf,同源重组,分别获得pad5/δ27/hvr2-tmtp1/δadp/hsv-tk质粒、pad5/δ27/hvr5-tmtp1/δadp/hsv-tk质粒和pad5/δ27/hvr7-tmtp1/δadp/hsv-tk质粒。
93.实施例4:携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δ27/tmtp1/δadp/hsv-tk的获得、扩增和纯化
94.步骤4.1:携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δ27/tmtp1/δadp/hsv-tk的获得
95.步骤4.1.1:将步骤3.4获得的pad5/δ27/hvr2-tmtp1/δadp/hsv-tk质粒、pad5/δ27/hvr5-tmtp1/δadp/hsv-tk质粒和pad5/δ27/hvr7-tmtp1/δadp/hsv-tk质粒分别大量提取,使用paci酶切质粒,苯酚氯仿抽提,回收酶切产物。
96.步骤4.1.2:利用lipo3000脂质体(购自赛默飞世尔科技公司,货号为l3000001)转染方法,将步骤4.1.1回收的产物转入到融合度为30%的293细胞24孔板中。每隔2天加入新鲜的dmem培养基,待293细胞的融合度达到100%以上,收集细胞,并反复冻融使病毒裂解释放到dmem培养基中,离心收集上清病毒液。
97.步骤4.1.3:采用含有腺病毒的dmem培养基,再次转染293细胞,重复大约2周,直至293细胞出现cpe效应,收集细胞并反复冻融裂解,获得上清病毒液。
98.步骤4.1.4:鉴定步骤4.1.3获得的三种ad5/δ27/tmtp1/δadp/hsv-tk,分别用相应引物pcr后测序e1a、hexon和e3/adp区。
99.步骤4.2:携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δ27/tmtp1/δadp/hsv-tk的扩增、纯化和滴度测定
100.步骤4.2.1:扩增步骤4.1.4测序正确的携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δ27/tmtp1/δadp/hsv-tk,检测腺病毒种子的滴度(moi),根据moi值确定感染293细胞的病毒量,在48h-72h内出现cpe效应时收集细胞。如此反复扩增直至病毒量达到实验需求(109pfu/ml-10
11
pfu/ml)。
101.步骤4.2.2:采用传统cscl梯度离心法纯化腺病毒,病毒透析液透析获得纯化后的
腺病毒。使用紫外吸收法检测病毒颗粒数,使用adeno-xtm快速滴度试剂盒(clonetech,货号632250)检测moi。
102.实施例5:携带tmtp1和hsv-tk的溶瘤腺病毒重组体最佳插入区域筛选
103.本实施例的目的在于确定插入hexon高变区2、5、7三种不同区域的携带tmtp1和hsv-tk的溶瘤腺病毒重组体对肿瘤细胞感染效率,以挑选出对肿瘤细胞感染效应最好的靶向肽插入区域。
104.在6孔培养板中种入约2
×
105个skov3肿瘤细胞,培养液为10%fbs dmem培养基,到第二天大约70%细胞融合,吸取液体,加入2ml新鲜的10%fbs dmem培养基,将moi=1对应的溶瘤腺病毒数量用培养基稀释至100μl后加入培养孔中,轻轻晃动液体三次,在37℃、5%co2的培养箱中孵育12h、24h和36h后,收细胞渣,提取dna,用实时定量pcr鉴定不同处理组腺病毒dna的相对拷贝数。结果如图2显示,携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δe1a/hvr5/tmtp1δadp/hsv-tk在肿瘤细胞中复制最为活跃,其核苷酸序列如seq id no.23所示。通过体外实验,筛选出能够在肿瘤细胞中高拷贝数复制的最佳腺病毒插入区——高变区5,即hvr5为最终区域。
105.实施例6:溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk治疗效应的鉴定
106.步骤6.1:携带tmtp1和hsv-tk的溶瘤腺病毒重组体体外肿瘤细胞杀伤效应的鉴定
107.本实验的目的在于鉴定ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk新型溶瘤腺病毒对一系列肿瘤及正常细胞的杀伤效应,实验将以wt-ad5为阳性对照,以复制缺陷型病毒ad5cmv-gfp为阴性对照。选用细胞系为人肺癌细胞系a549,人高转移性前列腺癌细胞系pc3m-1e8、人成骨细胞瘤细胞系u-2os、人结肠癌细胞系hct-8、人乳腺癌细胞系mcf-7、人卵巢癌细胞系skov-3、人肝癌细胞系hepg2、人食管癌细胞系eca-109、人胃癌细胞系mkn-45、人脑胶质瘤细胞系shg-44、人头颈部鳞状细胞癌细胞系agzy-973、人胰腺癌细胞系bxpc-3、人子宫内膜癌细胞系hec-1-a、人直肠癌细胞系colo320和人鼻咽癌细胞系cne-2。选用的细胞系具有不同的p53,rb基因表型;具有不同组织源性,因此实验结果可代表不同类型的肿瘤。选用的正常细胞为原代的血管内皮细胞、原代的肺小气管上皮细胞、前列腺上皮细胞、骨髓单个核细胞,选用原则为:静脉用药后将接触大量腺病毒的正常组织细胞。
108.在24孔板培养皿中种入1
×
105肿瘤或正常上皮细胞,培养液为10%fbs dmem或ripm1640,到第二天大约70%的细胞融合,吸去液体,加入达到70%所需的moi稀释至100μl加入,轻轻晃动液体三次,在37℃、5%co2的培养箱中孵育90min,加入含10%fbs dmem或ripm1640培养基至2ml同时加入更昔洛韦(gcv),将细胞放置37℃、5%co2的培养箱中孵育3天,流式细胞仪检测细胞的凋亡率。具体实验结果见表1。
109.表1
[0110][0111][0112]
实验结果表明,阳性对照wt-ad5无选择性地裂解肿瘤和正常细胞;复制缺陷型腺病毒ad5cmv-gfp对细胞的杀伤效应非常弱,溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk选择性地杀伤肿瘤细胞,其效应显著强于wt-ad5对细胞的杀伤效应,同时该重组腺病毒构建体对正常对照细胞系无明显影响。结果充分表明溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk选择性高效杀灭肿瘤细胞。
[0113]
步骤6.2:溶瘤腺病毒的肿瘤细胞内复制效率的鉴定
[0114]
为进一步进行定量检测ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk新型溶瘤腺病毒构建体在肿瘤细胞中复制效率,进行了以下实验:
[0115]
在24孔板培养皿中各种入1
×
105两株肿瘤细胞skov3和c13k或正常细胞huvec和lo2,培养液为10%fbs dmem或ripm1640,到第二天,大约70%的细胞融合,吸去液体,加入ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk 10moi稀释至100μl加入,轻轻轻晃动液体三次,在37℃、5%co2的培养箱中孵育90min。加入含2%fbs dmem培养基至1ml,将细胞放置于37℃、5%co2的培养中孵育1、2、3天。
[0116]
加入300μl pbs溶液,进行三轮的冻/解冻的循环,释放出病毒,将裂解液最大速度离心10min,收集上清液,冻于-80℃,用tcid
50
在293细胞中检测腺病毒的滴度。
[0117]
结果如图3所示,ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk在肿瘤细胞中复制后其效价强于起始的4-5倍,而在正常细胞中感染效价无明显变化,结果充分表明该溶瘤腺病毒具有在肿瘤细胞内具有高效的特异性复制的特性。
[0118]
步骤6.3:溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk体内抗肿瘤效应的鉴定
[0119]
肿瘤细胞动物模型:选择4~6周龄的balb/c裸鼠,取对数生长期的胃癌细胞系mkn-45细胞,调整细胞密度1
×
106/100μl,每只裸鼠右侧背部皮下接种200μl,待肿瘤平均直径达到0.4-0.6cm时,按肿瘤大小随机分为4组,即介质对照组、wt-ad5组、ad5cmv-gfp组和ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk组,每组5只裸鼠,分别瘤内注射pbs、wt-ad5、ad5cmv-gfp和ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk,每只2
×
108pfu/(只
·
次),每天一次,连续5天。第2~18天腹腔注射gcv 125mg
·
kg-1
·d–1。每周观察并测量肿瘤体积2次,直至实验终点(50天或肿瘤体积大于2cm3)。
[0120]
实验结果如图4所示,在实验终点时,wt-ad5组平均肿瘤抑制率为26%
±
6%;ad5cmv-gfp组肿瘤抑制率为-7%
±
4%;ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk组三只裸鼠肿瘤完全消退,平均肿瘤抑制率为91%
±
8%,结果充分表明新型溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk具有确定的体内抗肿瘤效应。
[0121]
步骤6.4:携带tmtp1和hsv-tk的溶瘤腺病毒重组体特异性靶向肿瘤细胞的体内鉴定
[0122]
具体实验方法为:
[0123]
4-6周大小balb/c nu裸鼠,腹腔种植2
×
106skov3卵巢癌细胞,4周后,将裸鼠分为两组(n=4),分别腹腔注射1
×
108pfu新型溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk及其对照病毒ad5/δe1a。48h后,取出每只小鼠的肝脏、脾脏、肾脏、及肿瘤组织,提取各个组织dna,检测400ng组织dna中,腺病毒的dna含量,结果如图5所示:对照病毒ad5/δe1a在肝脏,肺,脾脏中均有聚集,在肿瘤组织中分布较少,ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk主要分布在肿瘤组织中,肝脏摄取显著减少;在肿瘤组织中的含量是对照病毒ad5/δe1a的近100倍。
[0124]
实施例7:溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk对肝肾毒性的鉴定
[0125]
具体实验方法为:4-6周大小balb/c nu裸鼠,腹腔种植2
×
106skov3卵巢癌细胞,4周后,将裸鼠分为三组(n=4),三组分别为:a-空白组,b-单注射ad5/δe1a,c-单注射ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk,其中b组、c组分别连续腹腔内注射1
×
108pfu对照病毒ad5/δe1a及其对应新型溶瘤腺病毒ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk。48小时后,眼眶取血,测量各组中实验小鼠的肝肾功能,包括:谷丙转氨酶(alt)、谷草转氨酶(ast)、肌酐(creatinine)、尿素氮(bun),结果如图6-图9所示,对照组与实验组中,肾功能无明显损伤,但是注射对照病毒ad5/δe1a的小鼠,谷丙转氨酶(alt)、谷草转氨酶(ast)明显升高,而注射ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk的小鼠,肝功能正常。
[0126]
以上结果表明,携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δe1a/hvr5/tmtp1/δadp/hsv-tk克服了肝嗜性,显著的增强了对肿瘤的靶向性,且对肝脏及肾脏毒性小,具有较高的安全性。
[0127]
因此,本发明的携带tmtp1和hsv-tk的溶瘤腺病毒重组体ad5/δe1a/hvr5/tmtp1/
δadp/hsv-tk,可以用于制备治疗肿瘤的药物,既开拓了新的治疗肿瘤的药物,又开拓了携带tmtp1和hsv-tk的溶瘤腺病毒重组体的用途,具有积极的药学价值和广泛的社会意义。
[0128]
本发明虽然以较佳实施例公开如上,但并不是用来限定权利要求,任何本领域技术人员在不脱离本发明构思的前提下,都可以做出若干可能的变动和修改,因此本发明的保护范围应当以本发明权利要求所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1