λ-卡拉胶酶OUC-G150-L7及其应用
λ-卡拉胶酶ouc-g150-l7及其应用
技术领域
1.本发明涉及λ-卡拉胶酶ouc-g150-l7的重组表达、制备及其应用,属于功能酶技术领域。
背景技术:
2.卡拉胶(carrageenan)是自红藻中提取的一种酸性多糖,具有重复的α-1,4-d-半乳吡喃糖和β-1,3-d-半乳吡喃糖(或3,6-内醚-d-半乳吡喃糖)二糖单元骨架结构。卡拉胶寡糖是卡拉胶的降解产物,根据硫酸盐的结合形式不同,卡拉胶寡糖可分为十种不同的理想化重复双糖,它们是α-、β-、λ-、δ-、κ-、μ-、θ-、δ-、i-,
ⅴ‑
卡拉胶寡糖,它们的区别主要在于它们的硫酸化程度和是否存在3,6-脱水半乳糖残基。
3.λ-卡拉胶寡糖具备抗凝、抗血栓、抗炎、抗病毒、抗肿瘤等多种功效。近年来经研究证实,λ-卡拉胶寡糖在生物体抗氧化、自由基的清除方面也发挥着重要的作用。因此如何高效制备λ-卡拉胶寡糖日益成为人们研究的热点问题。
4.制备λ-卡拉胶寡糖的方法包括物理法、化学法和酶解法,其中,物理法主要是指超声、微波等物理学手段降解λ-卡拉胶的方法;化学法主要包括酸水解和氧化法降解;目前最为常见的降解方法是酸水解与酶水解,酶解法相比于酸解法具有反应温和、产物单一、易于分离等优点,但λ-卡拉胶酶在文献中记载的并不多,目前仅有两种。因此,发掘新的λ-卡拉胶酶并构建下新的工程菌具有重大的意义。
技术实现要素:
5.针对上述现有技术,本发明提供了一种可以降解卡拉胶产生λ-卡拉胶寡糖的新型降解酶——λ-卡拉胶酶ouc-g150-l7,弥补了现有酶基因库的不足。
6.本发明是通过以下技术方案实现的:
7.λ-卡拉胶酶ouc-g150-l7,其氨基酸序列如下所示,如seq id no.1所示。
8.λ-卡拉胶酶ouc-g150-l7的氨基酸序列(seq id no.1):
9.mkikltflsfllfgitivgtinsyangtppskgifsietgytitkvrtaldkkksfvvassyegtllgisyegkil wknalsgfmnqdiwcqditgdgkdeilaansdgtlyclnadgkliwqfkkddtpmyavcvvkkdkvpyvvcggfdksiyy lnadgkevkqlksksysieknsgklegkipennthtpnfirsipqadgsevlailgtnnhmsssgtiylfkpledqpfrk dkvtvprsmgdfkvmdlnedgenevflgnsvhtsdtgygiyypktgntkvvkikskdldtgylivqgekigagknsqllv lmgdrillvnpnldmkkaetlvskhafndvwkdpstgkiilasdqsggscihiidteeanwkkeyininppgkiqsilkn tevivesikkfkplawerkplpvyfmsenfktplaisvsdnikknfsspvflnskhmtqvqspeswnrdamtnekyrnkr drrkkynlsqqevldilgkeyinspglatwgghgndpyfyslqtteklidiaagkktvliypeledhtddfqfvlndlin plakysqgkntnlflrtknifwlgsiykpewknfmsgeyadvfvpsmeettdkimelslsgrlgiwtsgatnswgsravr dntsfdrqrqvsyqtipnhylrmlvyhisygatyldnfpidqdymsvlwdliakgalyvpkseeilsfspvhlamtepne nfiqeggnnkyttffdkkyedenpavfsrmtgcwpgaqvtpwdfsryaagvtdrrlnflapykngmvlivppqkgalakt deprgkltdhlhpfyknnikey
itdgkdyisadgkekypannyykgiekdinesakllpitvsgevawvvaqtapthlrltiidsgyinpaerlanisfngvkpvkitdvltgekwdakntasvkidvplgsfrfidvelekaf。
10.一种编码上述λ-卡拉胶酶ouc-g150-l7的基因,其核苷酸序列如下所示,如seqidno.2所示。
11.编码λ-卡拉胶酶ouc-g150-l7的基因的核苷酸序列(seqidno.2):
[0012]5’‑
atgaaaatcaaacttacttttttatcatttctcctttttggaatcacgattgttggtactattaattcttacgcaaatggaactccaccgtccaaaggaatttttagtatcgaaacaggatacacaatcaccaaagtgcgtacagcattggataagaaaaaatcttttgtagtagcaagtagctatgaaggaacgcttttaggaatttcctatgaaggtaaaattctttggaaaaatgccttatcgggttttatgaatcaggacatctggtgtcaggacattactggcgatggaaaagacgaaattctagccgccaattcggatggaacactatattgcttaaatgctgacggaaaattgatatggcaattcaagaaagacgatactcctatgtatgccgtttgtgtagtcaaaaaagacaaagttccgtatgtagtttgtggtggttttgacaaaagtatttactacctcaatgctgatggaaaagaagtaaaacaactgaaatcaaaatcgtattcgatagagaaaaactcagggaaactagaaggcaaaattccagaaaacaatacacataccccaaattttattcgttctattccgcaagcggatgggagtgaagtcttagcaattttaggaaccaacaatcacatgagttcttctggtacgatctatttattcaaaccattggaagaccagccttttcgcaaggataaagtaacggttccaagatcgatgggagattttaaagtaatggatctaaacgaagatggcgaaaacgaagtttttttagggaattctgttcatacaagtgatacgggttacgggatttactaccccaaaacaggaaatactaaagtggttaagattaaatcaaaagacctagataccggctatttaattgttcaaggagagaaaataggtgctggtaagaatagtcaattgttggttttaatgggagatcgcatcttgttagtaaacccaaatttggatatgaaaaaagcagagaccttggtgtccaaacatgcttttaatgatgtatggaaagatccttctacaggcaaaattattttggcaagcgatcaaagtggtgggagttgcattcatatcatcgataccgaagaggctaattggaaaaaagaatacatcaatatcaaccctccggggaaaatacaatcaattctaaaaaacaccgaagttattgtagaaagcatcaagaagttcaaacctttggcttgggagcgaaaacctttgccggtttatttcatgtctgagaatttcaaaacacctttggcaatttcagtttcagataatatcaaaaagaattttagtagtcctgtttttctaaatagcaaacacatgacgcaagtgcaatctcccgagagctggaacagagatgcaatgaccaacgaaaaataccgcaacaaacgtgatagaagaaaaaaatacaatttaagtcaacaggaagtacttgatattttgggtaaggagtacataaacagtcctggtttagcgacttggggtggtcatggaaatgatccttatttctacagtttacaaaccaccgaaaaattaattgatattgcagcaggaaaaaaaacagtattgatttatcctgaattggaagatcatacagatgattttcaatttgtattgaatgacttaattaatcctttagcgaaatattcgcaaggaaaaaataccaatttgtttttacgaaccaaaaatattttttggctaggttctatttacaaacccgaatggaaaaatttcatgtcgggagaatatgctgatgtttttgtaccctcaatggaagaaaccaccgataaaatcatggaattaagtctttcgggtcgtttaggaatttggacgagtggcgctacaaacagttggggatcacgtgctgtgagagacaacactagttttgaccgccaacgtcaggtgtcgtatcaaaccattccaaaccattatttgcgcatgttggtgtatcatatttcgtatggagctacttatttagataattttcctattgaccaagattatatgagtgtactttgggatttgattgccaaaggagctttgtatgtgcctaaaagcgaagagattttaagtttttcgccagtacatttggctatgacagaaccaaatgagaattttattcaagagggtggaaataacaaatacaccacattcttcgataaaaaatatgaagacgagaatccagcagttttcagcagaatgacaggttgctggccaggagctcaggtgacaccttgggatttttcaagatatgcggctggagtaaccgatcgccgtttgaatttcttagcgccctataaaaacggaatggtattaattgtgcctccgcaaaaaggagctttggctaaaacggatgaacctagaggaaaacttaccgatcatttgcatcctttctataaaaacaatatcaaagaatacatcacagatggtaaagattatatttcagctgatggaaaagaaaaatatccagctaataactattacaaaggaattgaaaaagacatcaat
gaaagtgc aaaattattgcctatcacggtttcaggagaagtggcttgggtagttgcacaaacagctccaacacatttacgcctaacca tcatcgatagtggatacattaaccctgcagaacgcctagcaaatattagtttcaatggcgtaaaacctgtaaaaatcaca gatgttttgactggtgaaaagtgggatgctaaaaacacagcttcggtaaaaattgatgtgcccttaggttctttccgttt tattgatgtggaattagagaaagctttt-3’。
[0013]
所述λ-卡拉胶酶ouc-g150-l7在降解卡拉胶/制备λ-卡拉胶寡糖中的应用。
[0014]
一种降解卡拉胶/制备λ-卡拉胶寡糖的方法:采用上述λ-卡拉胶酶ouc-g150-l7降解卡拉胶,得到λ-卡拉胶寡糖产物,产物中包含二糖、四糖、六糖,主产物为四糖和六糖。
[0015]
进一步地,所述降解的条件为:λ-卡拉胶溶液的浓度为2%~3%(质量体积比,单位 mg/ml),加酶量为0.20~0.25u,温度45~55℃,ph值7.0~7.5,时间4~6小时。优选的,降解条件为:λ-卡拉胶溶液的浓度为3%,加酶量为0.2122u,温度45℃,ph值7.0,时间 4小时。
[0016]
所述编码λ-卡拉胶酶ouc-g150-l7的基因,在制备降解卡拉胶/制备λ-卡拉胶寡糖的酶制剂中的应用。
[0017]
一种酶制剂,包括上述λ-卡拉胶酶ouc-g150-l7。
[0018]
所述酶制剂在降解卡拉胶/制备λ-卡拉胶寡糖中的应用。
[0019]
一种重组表达载体,其携带有编码λ-卡拉胶酶ouc-g150-l7的基因。
[0020]
一种重组工程菌,其基因组中插入有编码λ-卡拉胶酶ouc-g150-l7的基因,能表达λ
‑ꢀ
卡拉胶酶ouc-g150-l7。
[0021]
所述重组工程菌在制备λ-卡拉胶酶ouc-g150-l7中的应用。
[0022]
本发明的λ-卡拉胶酶ouc-g150-l7,在45℃和ph=7条件下,比酶活可达6.57u/mg。可作用低粘度的λ-卡拉胶底物,终产物λ-卡拉胶寡糖聚合度为2~6。本发明构建了含λ-卡拉胶酶基因的重组载体,实现了在大肠杆菌中的异源表达,同时为该酶的工业化生产和应用提供了良好的基础。表达的λ-卡拉胶酶反应条件温和,对λ-卡拉胶有较好的降解效果,降解λ-卡拉胶生成二糖、四糖等,可在制备抗菌剂,抗病毒剂,免疫调节剂,抗氧化剂等中应用。
[0023]
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
附图说明
[0024]
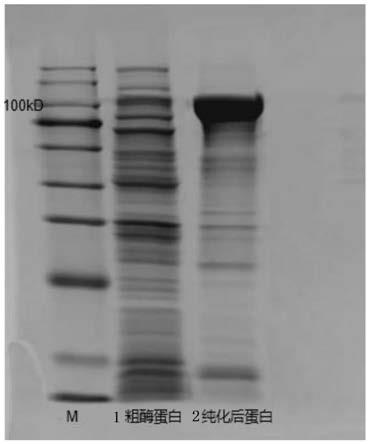
图1:本发明的λ-卡拉胶酶纯化后的纯酶sds-page电泳图,其中,m为标准蛋白marker; 1为粗酶蛋白;2为纯化浓缩后的λ-卡拉胶酶蛋白。
[0025]
图2:温度变化对相对酶活的影响示意图;图3:ph变化对相对酶活的影响示意图。
[0026]
图4:本发明的λ-卡拉胶酶酶解产物的液相图。
[0027]
图5:本发明的λ-卡拉胶酶酶解产物——二糖的质谱图。
[0028]
图6:本发明的λ-卡拉胶酶酶解产物——四糖的质谱图。
[0029]
图7:本发明的λ-卡拉胶酶酶解产物——六糖的质谱图。
具体实施方式
[0030]
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实
施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
[0031]
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
[0032]
实施例1λ-卡拉胶酶酶基因ouc-g150-l7的克隆
[0033]
本发明的发明人注意到中国海洋大学海洋食品酶学与生化工程实验室自测序菌株居海藻黄杆菌flavobacterium algicola(保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.1.12076,保藏日期为1/10/2012)对κ-卡拉胶酶具有较好的活性,所以猜测是否可能对λ-卡拉胶具有活性,故对该菌株进行全基因组测序,并挖掘到了gh150λ
ꢀ‑
卡拉胶酶家族相似度约40%的基因,发明人从海藻黄杆菌flavobacterium algicola中pcr 扩增出该基因(所用引物的序列如seq id no.3、4所示)(该基因也可以人工合成),并以 pet28a作为基因载体在大肠杆菌中进行了表达。本发明的λ-卡拉胶酶基因包含有2820个碱基序列,如seq id no.2所示,编码940个氨基酸,如seq id no.1所示。根据进化树比对,发现该λ-卡拉胶酶属于多糖水解酶第150家族(gh150)。
[0034]
以合成的片段为模板,在λ-卡拉胶酶基因的上、下游设计用于无缝连接的引物,进行 pcr扩增ouc-gh150-l7基因片段。
[0035]
引物的序列如下所示:
[0036]
上游引物:5
’‑
gatccgaattcgagctcaatggaactccaccgtc-3’,如seq id no.3所示;
[0037]
下游引物:5
’‑
gtggtggtggtggtgctcgagaaaagctttctctaattc-3’,如seq id no.4所示。
[0038]
pcr反应体系为:2
×
pcr buffer 25μl,dntp 10μl,引物各1.5μl,模板1μl,kodfx酶1μl,无菌水10μl,总体系50ul。
[0039]
pcr的反应条件为:94℃预变性5min,95℃变性20s,60℃退火30s,72℃延伸60s,反应30个循环,72℃后延伸10min。
[0040]
琼脂糖凝胶电泳后回收2.745kb的pcr产物片段。
[0041]
实施例2含λ-卡拉胶酶基因的表达载体构建
[0042]
基因片段与pet-28a克隆载体采用无缝克隆技术进行连接,将连接产物转入e.coli dh5α感受态细胞,涂布于lb培养基固体平板(含有50μg/m l卡那霉素)上,37℃温箱中培养 16小时后,挑取单克隆至含有50μg/m l卡那霉素lb液体培养基中,在转速为220rpm的 37℃摇床培养过夜。将单克隆进行阳性验证后测序,并命名为pet28a-ouc-gh150-l7。质粒保存在-20℃备用。
[0043]
实施例3含λ-卡拉胶酶基因的重组质粒及工程菌的构建
[0044]
将实施例2中抽提的质粒转化至宿主e.coli bl21感受态细胞中,构建好的工程菌在硫酸卡那霉素抗性平板上长出,得到重组表达菌株。
[0045]
实施例4利用大肠杆菌工程菌制备重组λ-卡拉胶酶
[0046]
大肠杆菌重组菌株经在5ml lb液体培养基(含有50μg/m l卡那霉素)中活化后,按 1%的接种量接入含有硫酸卡那霉(50μg/m l)的lb培养基,37℃,200rpm培养6h,菌液 od(600)值为0.6时,加入1
‰
iptg(100mm/l),20℃低温诱导20h,表达λ-卡拉胶酶。
[0047]
发酵结束后,8000g离心10分钟收集菌体后,细胞重悬于50mm的ph=8.0的tirs-hcl 缓冲液中,然后于冰水浴中超声破碎30min(200w,3s开,3s关),然后8000g再次离心15min,收集上清液,即为粗酶液。基于his标签融合的蛋白,粗酶液使用ni-nta柱进行亲和层析纯化,使用低浓度的10mm咪唑溶液(500mm nacl,50mm tris-hcl)平衡柱子,然后用20mm 咪唑溶液(500mm nacl,50mm tris-hcl)洗脱结合力弱的杂蛋白,100mm咪唑溶液洗脱目的蛋白,收集此部分的缓冲液洗脱成分,得到纯化的重组壳聚糖酶的溶液。经sds-page检测蛋白纯度和分子量(图1),结果显示重组蛋白经亲和柱纯化可得电泳纯蛋白,分子量大小约为108kda。
[0048]
实施例5重组λ-卡拉胶酶比酶活测定
[0049]
λ-卡拉胶酶ouc-gh150-l7活性的标准测定方法为:200微升的反应体系中,包含50μl 酶液、150μl ph 7的tris-hcl溶解的3%的λ-卡拉胶,在45℃下反应4h,反应样与300μl 的dns试剂混合,并在沸水浴中煮沸5min进行显色,在od540下检测其吸光度。酶活力定义为在标准条件下每min产生1μm还原糖所需要的酶量。经测定,纯化后的λ-卡拉胶酶活力可达6.57u/mg。
[0050]
实施例6测定λ-卡拉胶酶的最适反应条件
[0051]
将实施例4中得到的纯化λ-卡拉胶酶在不同温度和ph下反应,测定温度和ph对酶活力的影响。选取30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃的温度,按照实施例5λ-卡拉胶酶比酶活测定方法反应4h测定最适温度。在50℃下,选用ph为4.0~9.0的缓冲液作为酶反应的不同测定ph缓冲液,根据λ-卡拉胶酶的酶活力,确定λ-卡拉胶酶的最适ph。以最高酶活力为100%,计算在不同条件下的相对酶活力,结果如图2,图3所示,重组壳聚糖酶的最适反应温度为45℃,最适ph为7,磷酸盐缓冲液可能对酶蛋白活性有不良影响。
[0052]
实施例7测定重组λ-卡拉胶酶的降解产物
[0053]
将实施例4中纯化所得λ-卡拉胶酶ouc-gh150-l7与3%的λ-卡拉胶在45℃下反应过夜,然后通过高效液相色谱检测产物。如图4所示,结果表明产物中明显含有二糖、四糖与六糖。
[0054]
实施例8定义重组λ-卡拉胶酶产物聚合度组成
[0055]
将实施例4中纯化所得λ-卡拉胶酶ouc-gh150-l7与3%的λ-卡拉胶在45℃下反应至完全转化,然后通过esi-ms检测产物。如图5所示,结果表明产物中含有的λ-卡拉胶寡糖有二糖、四糖、六糖。
[0056]
实施例9利用重组λ-卡拉胶酶制备酶制剂
[0057]
利用实施例4制备的重组λ-卡拉胶酶制备酶制剂:将发酵破碎后的溶液纯化后,用缓冲液置换咪唑,冻干后保存酶粉。
[0058]
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1