一种手性α-氨基膦酸的衍生物及其制备方法
本发明属于有机合成,具体地,本发明涉及一种手性α-氨基膦酸的衍生物及其制备方法。
背景技术:
1、α-氨基膦酸及其衍生物是一类具有重要生物活性的天然α-氨基酸类似物,其不仅具有抗病毒、抗菌、抗真菌和抗癌等生物活性,还能抑制各种蛋白水解酶的活性,例如hiv蛋白酶、高血压蛋白原酶和ptpases等。因此,在新药开发、农药化工中起到日益重要的作用,并成为多年来有机磷化学发展的重要领域。α-氨基膦酸及其衍生物的绝对构型与其生物活性有着密切相关性。例如:(s,r)构型的阿拉法林(alafosfalin)具有明显优于其他三个异构体的革兰氏阳性菌和阴性菌抑制率(yager,k.m.;taylor,c.m.;smith,ⅲ,a.b.j.am.chem.soc.1994,116,9377–9378.)。因此,开发具有底物广谱性的不对称策略制备手性α-氨基膦酸衍生物具有重要意义。有机小分子催化具有催化剂合成容易、反应条件比较温和、环境友好、生物毒性小、底物兼容性和适应性强等特点,已经成为简单方便获得手性分子的高效方法之一,并且已经在工业生产中得到广泛应用。
2、目前合成手性α-氨基膦酸及其衍生物的主要策略是通过连接亚胺和膦酸酯构筑碳-磷键的pudovik反应或者kabachnik–fields反应获得。近二十年来,不对称有机小分子催化被成功应用于这一碳-磷键构筑的策略,实现手性α-氨基膦酸衍生物的合成。例如氢键催化合成(joly,g.d.;jacobsen,e.n.j.am.chem.soc.2004,126,4102–4103.),双功能催化合成(nakamura,s.;nakashima,h.;yamamura,a.;shibata,n.;toru,t.adv.synth.catal.2008,350,1209),酸催化合成;(cheng,x.;goddard,r.;buth,g.;list,b.angew.chem.int.ed.2008,47,5079–5081.)以及手性碱催化合成(fu,x.;loh,w-t.;zhang,y.;chen,t.;ma,m.;liu,h.;wang,j.;tan,c.-h.angew.chem.int.ed.2009,121,7523–7526.)等方法。亚胺的异构化反应制备功能性手性胺是一种具有良好应用潜力的替代方案。其中,有报道尝试使用金鸡纳碱衍生物催化的亚胺异构化来制备手性α-氨基膦酸衍生物(kowalczyl,d.;albrecht,chem.commun.,2015,51,3981–3984.)。但是,上述基于有机催化的策略通常催化效率低,催化剂用量高达5-20摩尔%,大大降低了其工业应用潜力。
3、鉴于α-氨基膦酸及其衍生物具有重要的应用价值和高效绿色的不对称合成方法的缺乏,本领域亟待开发一种高效率,高选择性,适合放大的α-氨基膦酸及其衍生物制备方法。
技术实现思路
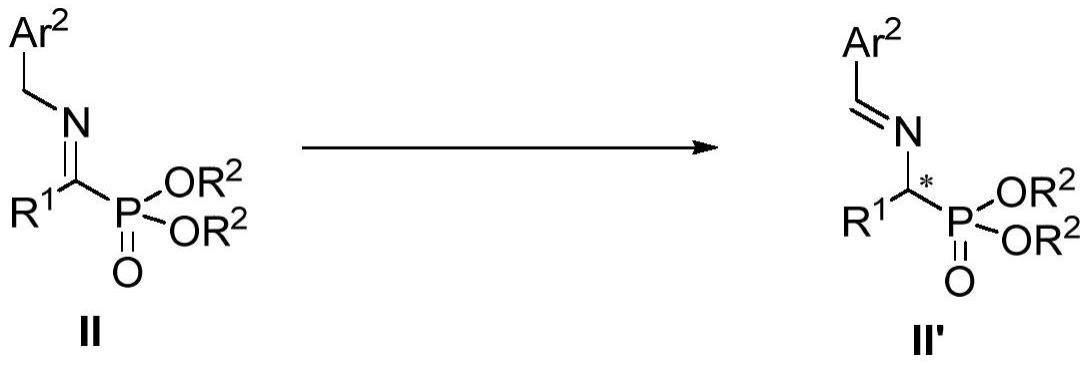
1、本发明提供了一种手性α-氨基膦酸的衍生物及其制备方法。具体地,本发明通过α-羰基膦酸酯和苄胺为原料缩合得到的亚胺中间体,在金鸡纳碱骨架的甜菜碱(betaine)催化剂作用下,发生高对映选择性的亚胺异构化反应,从而实现“一锅法”高效合成此类手性α-氨基膦酸衍生物。
2、本发明的第一方面,提供了一种催化合成手性α-氨基膦酸衍生物的方法,所述的α-氨基膦酸衍生物具有如下式所示的结构:
3、
4、所述的方法包括步骤:
5、
6、(a)在金鸡纳碱衍生物催化剂和无机碱存在下,用亚胺中间体ii进行对映选择性异构化反应,制备得到具有光学活性的α-氨基膦酸前体ii':和
7、用所述的α所氨基膦酸前体ii'进行水解,得到手性α-氨基膦酸;
8、其中,*表示r构型或s构型;
9、r1选自取代或未取代的c1-c16烷基;
10、r2选自取代或未取代的c1-c16烷基;
11、ar2为取代或未取代的c6-c10芳基,或5-12元杂芳基;其中,所述的5-12元杂芳基上任选地具有1-2个稠合的饱和5-7元环;
12、所述的金鸡纳碱衍生物催化剂选自下组:
13、
14、其中,pyr为ar选自下组:取代或未取代的c6-c10芳基,或5-12元杂芳基;
15、所述的取代指基团上的一个或多个氢原子被选自下组的取代基取代:卤素、c1-c4烷基、c2-c4烯基、c2-c4炔基、c2-c4酯基、硝基、3-8元环烷基、4-8元杂环基、或未取代或被选自下组的一个或多个取代基取代的c6-c10芳基或5-12元杂芳基:卤素、c1-c4烷氧基、c1-c4烷硫基、叔丁基二甲基硅基(tbs)、叔丁基二甲基硅氧(tbso)、三异丙基硅基(tips)。
16、在另一优选例中,所述的金鸡纳碱衍生物催化剂的用量为0.0001-0.5mol%,较佳地为0.01-0.05mol%(以式ii化合物的用量为基础计)。
17、在另一优选例中,所述的无机碱选自下组:磷酸钾、碳酸钾、氢氧化钾、氢氧化锂、一水合氢氧化锂、碳酸氢钾、碳酸铯、磷酸氢钾、碳酸钠。
18、在另一优选例中,所述的无机碱的用量为10-40mol%,较佳地为15-30mol%(以式ii化合物的用量为基础计)。
19、在另一优选例中,所述的步骤中,反应在选自下组的溶剂中进行:甲苯、氯仿、乙醚,或其组合。
20、在另一优选例中,所述的步骤中,反应在-40℃至40℃下进行,较佳地在-30℃至30℃下进行。
21、在另一优选例中,所述的α-氨基膦酸前体ii'具有选自下组的结构:
22、
23、在另一优选例中,ar2为对硝基苯基。
24、在另一优选例中,所述的α-氨基膦酸前体ii'具有选自下组的结构:
25、
26、在另一优选例中,所述的金鸡纳碱衍生物催化剂选自下组:
27、
28、其中,pyr为ar为
29、ar1选自下组:苯基、萘基、4-甲氧基苯基、3,5-二甲氧基苯基、3,4,5-三甲氧基苯基;r选自下组:叔丁基(tbu)、叔丁基二甲基硅基(tbs)、三异丙基硅基(tips)。
30、在另一优选例中,所述的金鸡纳碱衍生物催化剂选自下组:
31、
32、其中,pyr为ar选自下组:
33、
34、在另一优选例中,所述的催化剂为q-4。
35、在另一优选例中,所述的亚胺中间体ii是通过以下方法制备的:
36、
37、(a)用α-羰基膦酸酯i与苄胺进行反应,缩合得到亚胺中间体ii。
38、在另一优选例中,所述的反应在氯仿中进行。
39、在另一优选例中,所述的方法还包括步骤:
40、
41、(b)在酸存在下,对α-氨基膦酸前体ii'进行水解,然后与氨水中和得到式iii化合物:其中,式ii'和式iii的手性中心构型一致。
42、在另一优选例中,所述的酸为盐酸。
43、在另一优选例中,所述的反应在四氢呋喃中进行。
44、在另一优选例中,所述的方法还包括步骤:
45、
46、(c)在酸存在下,用式iii化合物进行水解反应,得到式iv化合物。
47、在另一优选例中,所述的酸为盐酸。
48、在另一优选例中,所述的方法还包括步骤:对产物进行重结晶,得到纯化后的产物iv。
49、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺