一种MPL三乙胺盐、其制备工艺及应用的制作方法
本发明属于医药,具体的,涉及一种mpl三乙胺盐、其制备工艺及应用。
背景技术:
1、mpl(单磷酰酯a,monophosphoryl lipid a,也简称mpla)是来自于革兰氏阴性细菌细胞壁中的内毒素(lps)的最内层脂质体(lipid a)部分。脂肪链结构和磷酸化程度均会影响其活性和内毒素的作用,来自于salmonella minnesota的lipid a分别在1位和4位含有一个磷酸基团,会过度激活先天性免疫应答,从而导致败血性休克等临床症状,副反应强烈。文献报道去掉1位磷酸基团后,其毒性降低且保留了免疫活性,称之为单磷酰酯a(mpl)。
2、作为已上市的新一代疫苗佐剂,mpl临床用途广泛,常见的佐剂系统有:as01(包含qs21与mpl(脂质体佐剂)、as02(含有角鲨烯和α-生育酚的水包油乳液中加入mpl和qs21)、as04(mpl吸附在氢氧化铝)、as15(mpla,qs21,cpg,脂质体)等,而佐剂系统不同的配伍(formulation)会影响到佐剂的免疫应答效果和副作用。已上市的含佐剂的疫苗产品:
3、fendrix tm:由gsk在2004年研制的乙肝疫苗,该疫苗由乙肝病毒(hbv)表面抗原(hbsag)和as04佐剂系统组成。
4、cervarix tm与gardasil tm:前者是由gsk在2009年研制的宫颈癌二价疫苗,由hpv l1表位的病毒样颗粒(vlp)与as04系统组成;后者由默克研发,也含有as04佐剂。
5、shingrix tm:由gsk研制的带状疱疹疫苗,使用as01佐剂系统。
6、由于佐剂系统不同的配伍(formulation)会影响到佐剂的免疫应答效果和副作用,所以mpl需要经过不同类型的制剂工艺后,形成佐剂制剂才能进行使用,因此对于该产品的溶解性质有较高的要求。
7、目前mpl来源主要依靠生物发酵提取,包含四个或五个不同链长的长链酰基结构同系物的复杂混合物。缺点是制备纯化难度大,残留的蛋白及糖异质带来的纯度问题,并且成本较高。例如,一类称为sj-19a的lipid a是从革兰氏阴性细菌液化曲霉中酸性水解而来的,但在酸水解步骤中,可能发生化学降解,不稳定的磷酸键断开从而导致mpl的异质性。
8、合成制备的mpl结构明确,没有糖异质带来的纯度问题,更适于工业化生产,但是其水溶解度差,应用于制剂受限。现有报道的mpl,base(非盐型)和铵盐形式溶解度都比较差,用于液体制剂受限;在水中为混悬液,无法进行过滤除菌。
9、针对现有技术中的上述技术问题,提出本发明。
技术实现思路
1、本发明首先涉及一种mpl三乙胺盐(mpl-tea)的制备方法,所述方法包括如下步骤:
2、(1)mpl粗品溶于氯仿后去除溶剂;
3、(2)加入tea水溶液,常温下超声使mpl均匀混悬在溶液中;
4、(3)将上述溶液转移至纯水中,超声分散均匀;
5、(4)向上述体系中加入tea水溶液,超声,冻干即得。
6、具体的,所述的方法的步骤为:
7、(1)mpl粗品与氯仿(10%,wt)中完全溶解,0.45μm微孔滤膜过滤后去除溶剂,使其均匀分布在圆底烧瓶底部;优选的,去除溶剂使用减压旋蒸法;
8、(2)加入1.0%tea水溶液,常温下超声使mpl均匀混悬在溶液中,优选的,所述的tea水溶液的加入量为mpl粗品的10倍(质量比);
9、(3)将上述溶液转移至纯水中,超声分散均匀;优选的,纯水的加入量为mpl粗品的40倍(质量比);
10、(4)向上述体系中加入0.2%tea水溶液,超声溶解完全即得;优选的,0.2%tea水溶液的加入量为mpl粗品的50倍(质量比)。
11、本发明还包括将所述mpl三乙胺盐制备成纳米溶液的步骤,具体的步骤为:
12、(5)将步骤(4)反应溶液通过高压均质机均质后用0.45μm水相微孔滤膜过滤;
13、本发明还包括将所述mpl三乙胺盐纳米溶液进一步冻干的步骤,具体的步骤为:
14、(6)转移至冻干机,按照冻干曲线进行冻干,所述冻干步骤为:
15、预冻:-30.0℃,180min;
16、一次干燥:
17、第一阶段:-15.0℃,降温30min,持续480min;
18、第二阶段:-5.0℃,升温30min,持续240min;
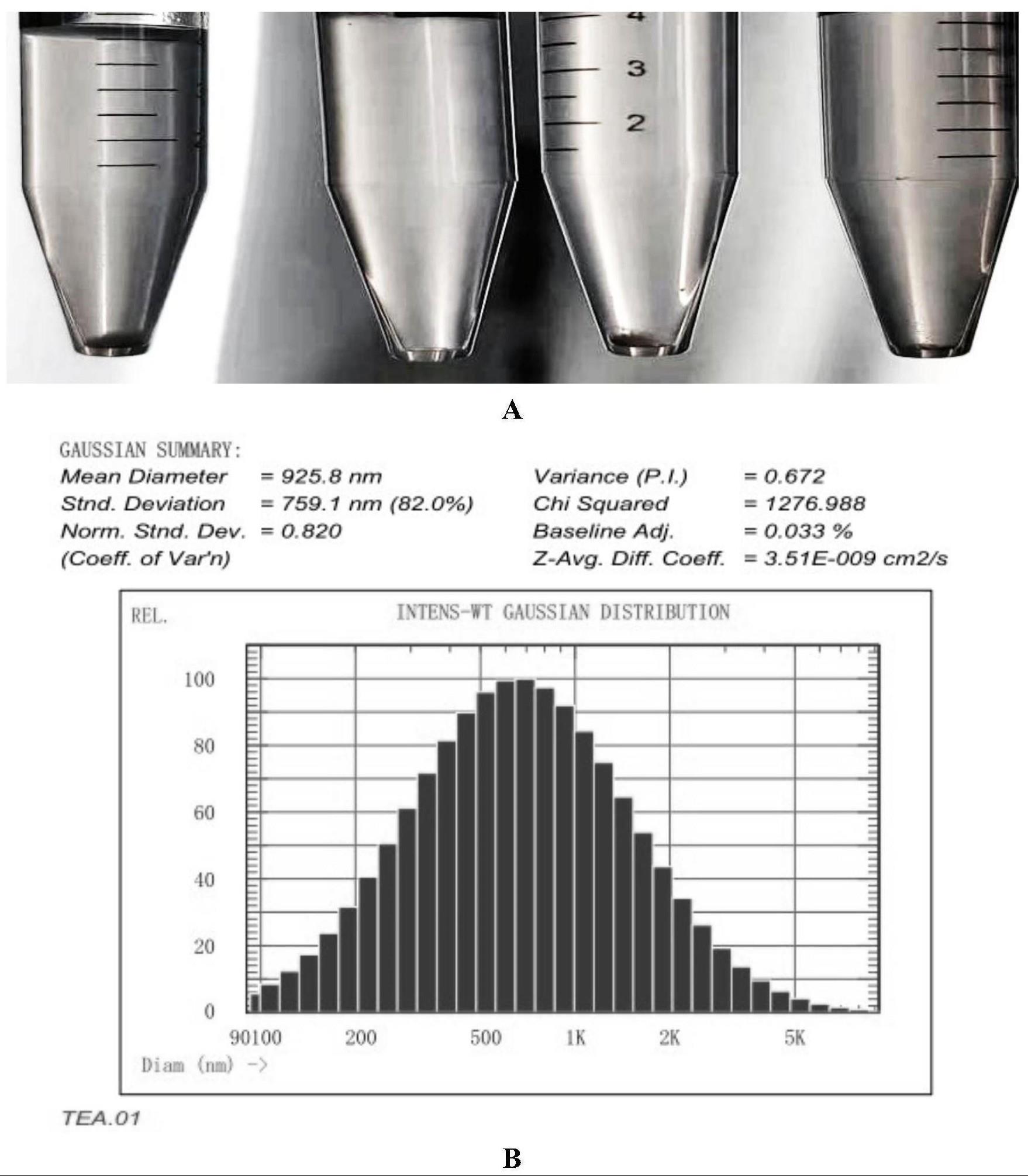
19、第三阶段:0℃,升温15min,持续240min;
20、解析干燥:20.0℃,升温15min,持续480min;
21、冻干结束后,冲氮并密封,保存于2-8℃。
22、最优选的,所述的方法包括如下步骤:
23、取1g mpl粗品10ml氯仿完全溶解,0.45μm微孔滤膜过滤,加入5ml的甲醇旋转蒸发去除溶剂,使其均匀分布在圆底烧瓶底部。
24、向烧瓶中加入1.0%tea水溶液10ml,25-30℃超声0.5h,使mpl均匀混悬在溶液中。
25、将上述溶液转移至含有40ml纯水的容器中,超声分散均匀10min。
26、将上述体系中加入50ml 0.2%tea水溶液,超声10min。
27、最终得液体100ml,其中mpl 10mg/ml,tea浓度为0.2%。
28、上述溶液通过高压均质机均质两次,d50粒度<100nm,溶液0.45μm水相微孔滤膜过滤,转移至冻干机,按照冻干曲线进行冻干。冻干结束后,向冻干机冲氮,密封瓶塞,取出瓶子,保存于2-8℃。
29、本发明还涉及所述方法制备得到的mpl三乙胺盐。
30、所述的mpl三乙胺盐在水溶液中的溶解度为8mg/ml;
31、所述的mpl三乙胺盐溶解在纯水中制备得到的水溶液的平均粒径分布数据为:平均粒径约900~950nm。
32、所述的10mgmpl三乙胺盐通过1mldmso增溶后,溶于10ml去离子水制备得到的水溶液的平均粒径分布数据为:平均粒径约110~130nm。
33、本发明还涉及所述的制备mpl三乙胺盐的方法或mpl三乙胺盐在制备疫苗佐剂中的应用。
34、所述的疫苗优选为:乙肝疫苗、带状疱疹疫苗、宫颈癌疫苗。
35、所述的疫苗佐剂优选为脂质体或胶束佐剂,更优选的,所述的佐剂是:as01、as02、as04、as15。
36、所述的mpl粗品的化学合成工艺可参见cn202010305764、cn202010306822、cn202010305752、cn202010306826、cn202010305744、cn202010305754。
37、本发明的有益效果是:
38、(1)克服现有mpl在水和常规有机溶剂中溶解性差的问题。通过盐型筛选,发现三乙胺盐具备较好的溶解性,并且稳定性较好,经过高压均质后能够形成纳米溶液,所得的冻干粉具有良好的溶解性,适于疫苗佐剂的制剂处方。
39、(2)本发明操作步骤简单,成盐完全,通过dsc表征含三乙胺5.12%,气相检测三乙胺含量4.7%,理论含三乙胺5.48%;按照冻干参数工艺冻干,粒径减小溶解度明显提高。
40、(3)相比与mpl base,三乙胺盐冻干粉直接复溶在水中即可以形成纳米颗粒,通过少量有机溶剂增溶可以分散成粒径约为125nm的稳定纳米溶液,适用于制备纳米制剂。
- 还没有人留言评论。精彩留言会获得点赞!