一种肉豆蔻酰五肽-4的合成方法与流程
一种肉豆蔻酰五肽
‑
4的合成方法
技术领域
1.本发明属于生物化学材料合成领域,具体涉及一种肉豆蔻酰五肽
‑
4的合成方法。
背景技术:
2.肉豆蔻酰五肽
‑
4(myristoyl pentapeptide
‑
4),又称肉豆蔻酰五肽
‑
17,是一种能够明显促进睫毛生长的美容肽,它能直接激活角质蛋白基因的表达,进而使睫毛生长,变得浓密。
3.目前,多肽的化学合成主要分为液相合成和固相合成两种方法,多肽固相合成法因具有操作简便,副产物少,易于纯化等优点,自创立以来被广泛应用到多肽的合成研究中。多肽固相合成c端向n端延伸的原理为:将目标肽链的首个氨基酸的羧基和固相载体以共价键结合,然后下一个氨基保护氨基酸在化学试剂下于之发生缩合反应,反复重复如此反应,直到目标肽链连接完成为止。最后将该肽链切割下来,纯化得到所需多肽。固相多肽合成中一般要先将氨基酸的α
‑
氨基和侧链活性基团保护。boc(叔丁氧羰)和fmoc(9
‑
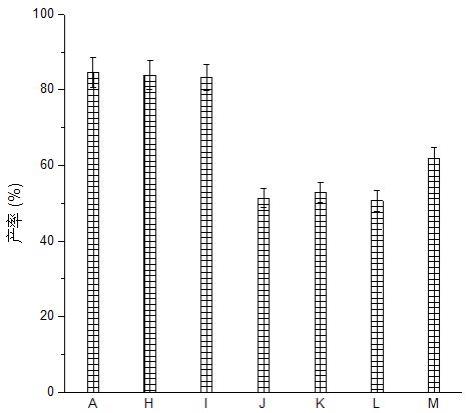
芴亚甲氧羰)两种基团被广泛使用来保护α
‑
氨基。fmoc保护与boc保护相比,fmoc在酸性条件下比较稳定,反应条件温和,副产物少,切割条件温和,合成效率高。
4.现有技术如授权公告号为cn 103897053 b的中国发明专利,公开了一种化学修饰的胸腺肽α1及其合成方法,其具有以下结构:a
‑
ser
‑
asp
‑
alaala
‑
val
‑
asp
‑
thr
‑
ser
‑
ser
‑
glu
‑
iie
‑
thr
‑
thrlys
‑
asp
‑
leu
‑
lys
‑
glu
‑
lys
‑
lys
‑
glu
‑
val
‑
valglu
‑
glu
‑
ala
‑
glu
‑
asn
‑
oh或ac
‑
ser
‑
asp
‑
alaala
‑
val
‑
asp
‑
thr
‑
ser
‑
ser
‑
glu
‑
iie
‑
thr
‑
thrlys(a)
‑
asp
‑
leu
‑
lys
‑
glu
‑
lys
‑
lys
‑
glu
‑
valval
‑
glu
‑
glu
‑
ala
‑
glu
‑
asn
‑
oh,所述a为与人血清白蛋白亲和性结合的脂肪酸,或与人血清白游离巯基偶联的马来酰亚胺衍生物。本发明的化学修饰的胸腺肽α1修饰位点精确,化学结构明确,合成方法工艺简练,经化学修饰的胸腺肽α1在静脉注射后立即特异性地与人体自身的血清白蛋白结合,将以人体自身的血清白蛋白作为缓释载体,从而大大延长其半衰期,显著增加有效药物浓度的持续时间,生物利用度高。
技术实现要素:
5.本发明的目的在于提供一种肉豆蔻酰五肽
‑
4的合成方法,该方法能够促进树脂的溶胀,提高首个氨基酸的连接率,提高fmoc基团的脱除率,降低生产成本,提高产品的产率。
6.本发明为实现上述目的所采取的技术方案为:提供一种肉豆蔻酰五肽
‑
4的制备方法,该肉豆蔻酰五肽
‑
4的结构为myristoyl
‑
lys
‑
leu
‑
ala
‑
lys
‑
lys
‑
nh2,其制备方法包括以下步骤:s1、将rink amide am树脂溶于有机溶剂二甲基甲酰胺和蓖麻油酸中浸泡10
‑
25min后,抽滤,得到活化的树脂;上述有机溶剂包括二甲基甲酰胺和蓖麻油酸;上述rink amide am树脂与有机溶剂的质量体积比为1g:5
‑
9ml;s2、向活化的树脂中加入脱保护剂进行脱保护基反应(即脱除fmoc
‑
保护基),反应结束后,抽滤、洗涤树脂,得到脱保护的树脂;将fmoc
‑
lys(boc)
‑
oh,缩合剂,消旋试剂混合,
加入二甲基甲酰胺完全溶解,再加入活化剂,20
‑
28℃下,避光静置活化4
‑
8min,得到活化的氨基酸溶液;将活化的氨基酸溶液加入脱保护的树脂中,用n2吹动搅拌,20
‑
28℃下反应2
‑
4h后,抽滤、洗涤,得到fmoc
‑
lys(boc)
‑
树脂;s3、按照上述步骤s2的方法对fmoc
‑
lys(boc)
‑
树脂进行脱保护、洗涤后,连接fmoc
‑
lys(boc)
‑
oh,之后用同样的方法依次连接fmoc
‑
ala
‑
oh﹑fmoc
‑
leu
‑
oh,fmoc
‑
lys(boc)
‑
oh,得到fmoc
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂;s4、按照上述步骤s2的方法对fmoc
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
rink amide am树脂进行脱保护、洗涤后,加入肉豆蔻酰氯、活化剂、二氯甲烷,20
‑
28℃下搅拌反应15
‑
40min后,抽滤、洗涤、干燥,得到myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂;s5、切割myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂,得到肉豆蔻酰五肽
‑
4产品。进一步地,上述二甲基甲酰胺和蓖麻油酸的体积比为8
‑
10:1
‑
2。二甲基甲酰胺和蓖麻油酸按照体积比8
‑
10:1
‑
2的比例对树脂进行活化,能够促进树脂的溶胀,有利于待反应的基团进出树脂的空隙,提高树脂与第一个保护氨基酸的连接效率,进而能够提高肉豆蔻酰五肽
‑
4的产率。
7.在某些实施方案中,上述fmoc
‑
lys(boc)
‑
oh、fmoc
‑
lys(boc)
‑
oh、fmoc
‑
ala
‑
oh﹑fmoc
‑
leu
‑
oh、fmoc
‑
lys(boc)
‑
oh与树脂的摩尔比均为2
‑
5:1。在本发明中提及的fmoc
‑
lys(boc)
‑
oh、fmoc
‑
lys(boc)
‑
oh、fmoc
‑
ala
‑
oh﹑fmoc
‑
leu
‑
oh、fmoc
‑
lys(boc)
‑
oh、肉豆蔻酰氯、活化剂与树脂的摩尔比,指的是fmoc
‑
lys(boc)
‑
oh、fmoc
‑
lys(boc)
‑
oh、fmoc
‑
ala
‑
oh﹑fmoc
‑
leu
‑
oh、fmoc
‑
lys(boc)
‑
oh、肉豆蔻酰氯、活化剂与制备肉豆蔻酰五肽
‑
4时所使用的rink amide am树脂的总取代度的比值。
8.在某些实施方案中,上述洗涤树脂的具体步骤包含:取反应溶剂已经被抽干的树脂,依次用二氯甲烷、甲醇、二甲基甲酰胺分别洗涤2
‑
4次,每次不少于5min。
9.在某些实施方案中,上述s2脱保护的具体步骤包含:向活化的树脂中加入14
‑
16v/v%哌啶的二甲基甲酰胺溶液,20
‑
28℃下n2吹动搅拌反应8
‑
12min。优选地,上述二甲基甲酰胺溶液中还含有乙酰丙酮。进一步地,上述二甲基甲酰胺溶液中哌啶与乙酰丙酮的体积比为13
‑
15:2
‑
3。含有一定比例的哌啶与乙酰丙酮的脱保护剂,在较短的时间和较少的脱保护剂下能够促进fmoc基团的脱除,有利于树脂上氨基酸的氨基的暴露,与羧基反应形成肽键,提高偶联氨基酸的产率,从而提高肉豆蔻酰五肽
‑
4的产率。
10.在某些实施方案中,上述活化剂为diea(二异丙基乙胺)、缩合剂为hatu(2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯)、hbtu(o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸酯)和tbtu(o
‑
苯并三氮唑
‑
n,n,n',n'
‑
四甲基脲四氟硼酸酯)其中任何一种、消旋试剂为hobt(1
‑
羟基苯并三唑)或hoat(1
‑
羟基
‑7‑
偶氮苯并三氮唑)。
11.优选地,上述活化剂为diea、缩合剂为hbtu、消旋试剂为hobt。进一步地,上述fmoc
‑
lys(boc)
‑
oh、diea、hbtu、hobt的摩尔比为1:1
‑
3:1
‑
2:1
‑
2。
12.在某些实施方案中,上述树脂、肉豆蔻酰氯、活化剂的摩尔比为1:1.5
‑
3:2
‑
4。
13.在某些实施方案中,上述切割myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂所使用的切割液为高酸tfa(三乙氟酸)
‑
h2o溶液。进一步地,上述高酸tfa
‑
h2o溶液包括95v/v% tfa和5v/v% h2o。
14.在某些实施方案中,在上述切割myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂后还进行纯化。
15.在某些实施方案中,上述s5的具体步骤包含:向myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂中加入切割液,放入冰水浴中搅拌反应2
‑
4h,过滤,滤液在35
‑
38℃下浓缩至体积不再减少,加入无水乙醚沉淀多肽,3
‑
5℃静置30
‑
60min,4000r/min离心2
‑
4min,弃去上清,得到沉淀,沉淀用纯水溶解后,冷冻干燥,采用反向高效液相色谱法进行纯化,得到肉豆蔻酰五肽
‑
4纯品。进一步地,上述无水乙醚与滤液的体积比为25
‑
45:1。
16.本发明还提供一种肉豆蔻酰五肽
‑
4的制备方法在制备一种促进睫毛生长的产品中的用途。
17.本发明由于使用体积比为8
‑
10:1
‑
2的二甲基甲酰胺和蓖麻油酸对树脂进行活化,因而具有如下有益效果:能够促进树脂的溶胀,有利于待反应的基团进出树脂的空隙,提高树脂与第一个保护氨基酸的连接效率,进而能够提高肉豆蔻酰五肽
‑
4的产率。
18.本发明由于使用含有体积比为13
‑
15:2
‑
3的哌啶与乙酰丙酮的脱保护剂,在较短的时间和较少的脱保护剂下能够促进fmoc基团的脱除,有利于树脂上氨基酸的氨基的暴露,与羧基反应形成肽键,提高氨基酸偶联率,从而提高肉豆蔻酰五肽
‑
4的产率。
19.因而,本发明是一种操作简单,成本较低,产率和纯度较高的肉豆蔻酰五肽
‑
4的合成方法。
附图说明
20.图1为本发明实施例1中多肽产品的rp
‑
hplc谱图;图2为本发明实施例1中多肽纯品的质谱图;图3为本发明试验例1中树脂膨胀度的测定结果;图4为本发明试验例1中实施例1
‑
7中树脂和首个氨基酸连接率的测定结果;图5为本发明试验例1中fmoc基团的脱除率的测定结果;图6为本发明试验例1中实施例1、8
‑
13中树脂和首个氨基酸连接率的测定结果;图7为本发明试验例1中实施例1
‑
7肉豆蔻五肽
‑
4的产率的测定结果;图8为本发明试验例1中实施例1、8
‑
13肉豆蔻五肽
‑
4的产率的测定结果。
21.附图标记说明:a为实施例1,b为实施例2,c为实施例3,d为实施例4,e为实施例5,f为实施例6,g为实施例7,h为实施例8,i为实施例9,j为实施例10,k为实施例11,l为实施例12,m为实施例13,a为795.63,b为796.64,c为797.63,d为798.64。
具体实施方式
22.以下结合实施例对本发明作进一步详细描述:实施例1:1.一种肉豆蔻酰五肽
‑
4,结构为myristoyl
‑
lys
‑
leu
‑
ala
‑
lys
‑
lys
‑
nh2,分子式为c
41
h
81
n9o6,其制备方法包括以下步骤:脱保护剂:含有15v/v%哌啶和2.5v/v%乙酰丙酮的二甲基甲酰胺溶液;切割液:95v/v% tfa和5v/v% h2o;1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200
目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入13ml二甲基甲酰胺和2ml蓖麻油酸浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;1.2向活化的树脂中加入10ml脱保护剂,25℃下,n2吹动搅拌反应10min,抽滤去除溶液,依次用二氯甲烷、甲醇、二甲基甲酰胺各20ml洗涤树脂3次,每次5min,得到脱保护的树脂;1.3将5mmol fmoc
‑
lys(boc)
‑
oh,6mmol hbtu,6mmol hobt混合,加入25ml二甲基甲酰胺完全溶解,再加入10mmol diea,25℃下,避光静置活化5min,得到活化的氨基酸溶液;将活化的氨基酸溶液加入脱保护的树脂中,用n2吹动搅拌,25℃下反应3h后,抽滤去除溶液,依次用二氯甲烷、甲醇、二甲基甲酰胺各20ml洗涤树脂3次,每次5min,得到fmoc
‑
lys(boc)
‑
树脂;1.4向fmoc
‑
lys(boc)
‑
树脂中加入10ml脱保护剂,25℃下,n2吹动搅拌反应10min,抽滤去除溶液,依次用二氯甲烷、甲醇、二甲基甲酰胺各20ml洗涤树脂3次,每次5min,得到脱保护的lys(boc)
‑
树脂;1.5将5mmol fmoc
‑
lys(boc)
‑
oh,6mmol hbtu,6mmol hobt混合,加入25ml二甲基甲酰胺完全溶解,再加入10mmol diea,25℃下,避光静置活化5min,得到活化的氨基酸溶液;将活化的氨基酸溶液加入脱保护的lys(boc)
‑
树脂中,用n2吹动搅拌,25℃下反应3h后,抽滤去除溶液,依次用二氯甲烷、甲醇、二甲基甲酰胺各20ml洗涤树脂3次,每次5min,得到fmoc
‑
lys(boc)
‑ꢀ
lys(boc)
‑
树脂;1.6 按照1.4和1.5的步骤依次连接fmoc
‑
ala
‑
oh﹑fmoc
‑
leu
‑
oh,fmoc
‑
lys(boc)
‑
oh,得到fmoc
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂;1.7向fmoc
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂中加入10ml脱保护剂,25℃下,n2吹动搅拌反应10min,抽滤去除溶液,依次用二氯甲烷、甲醇、二甲基甲酰胺各20ml洗涤树脂3次,每次5min,得到脱保护的lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂;1.8向lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂中加入2.5mmol肉豆蔻酰氯、3mmol diea、30ml二氯甲烷,25℃下,n2吹动搅拌反应20min后,抽滤去除溶液,依次用二氯甲烷、甲醇、二甲基甲酰胺各40ml洗涤树脂3次,每次5min,用n2吹干,得到myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂;1.9向myristoyl
‑
lys(boc)
‑
leu
‑
ala
‑
lys(boc)
‑
lys(boc)
‑
树脂中加入切割液,放入冰水浴中搅拌反应3h,使用砂芯漏斗过滤除去树脂,将滤液在38℃下浓缩至体积不再减少,加入35倍滤液体积的无水乙醚沉淀多肽,4℃静置40min,4000r/min离心3min,弃去上清,得到沉淀,沉淀用纯水溶解后,冷冻干燥,得到多肽产品。利用反向高效液相色谱(rp
‑
hplc)检测合成的多肽产品,分析多肽的纯度,并利用质谱检测多肽粗品的分子量,确定合成的多肽是否为肉豆蔻酰五肽
‑
4。rp
‑
hplc检测的方法:取多肽样品置于15ml离心管中,加入流动相a相,置于超声震荡机中震荡使多肽样品溶解,制成10mg/ml的待检测粗多肽溶液,检测用c18分析柱,柱温为35℃,进行rp
‑
hplc分析,其中流动相:a相:水,0.1%tfa;b相:乙腈,0.1%tfa,洗脱梯度:b相的溶度从5%到95%,洗脱速度为1ml/min,洗脱时间为35min,检测波长为215nm。收集目标峰的多肽溶液,经浓缩、冻干,得到多肽的纯品。多肽产品的rp
‑
hplc谱图见图1。由图1可以看出多肽产品的主要峰很高,保留时间在18.087min,用峰面积归一法来计算多肽产品的纯度,纯度为98.7%。用thermo scientific lcq fleet离子肼对
多肽的纯品进行质谱鉴定,分析计算质谱结果,确定目的产物所在峰。质谱条件如下:离子源:esi;鞘气流速:20psi;辅气流速:8psi;扫气流速:5psi;喷雾电压:4.5kv;毛细管温度:275℃;毛细管电压:35v;套管透镜电压:110v。多肽纯品的质谱图见图2。由图2可以看出,多肽的纯品的相对分子量为795.63,与肉豆蔻酰五肽
‑
4理论相对分子量796.14基本一致,证实多肽纯品为肉豆蔻酰五肽
‑
4。
23.实施例2:1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入12.5ml二甲基甲酰胺和2.5ml蓖麻油酸浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;其余部分和实施例1完全一致。
24.实施例3:1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入13.5ml二甲基甲酰胺和1.5ml蓖麻油酸浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;其余部分和实施例1完全一致。
25.实施例4:1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入11ml二甲基甲酰胺和4ml蓖麻油酸浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;其余部分和实施例1完全一致。
26.实施例5:1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入14ml二甲基甲酰胺和1ml蓖麻油酸浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;其余部分和实施例1完全一致。
27.实施例6:1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入13ml二甲基甲酰胺浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;其余部分和实施例1完全一致。
28.实施例7:1.1称取2g rink amide am树脂(交联1m/m%二乙烯基苯,取代度为0.5mmol/g,200目,购自上海阿拉丁生化科技股份有限公司),放入多肽合成管中,加入15ml二氯甲烷浸泡15min后,将多肽合成管连在真空泵上抽干溶液,得到活化的树脂;其余部分和实施例1完全一致。
29.实施例8:脱保护剂:含有15v/v%哌啶和2v/v%乙酰丙酮的二甲基甲酰胺溶液;其余部分和实施例1完全一致。
30.实施例9:
脱保护剂:含有15v/v%哌啶和3v/v%乙酰丙酮的二甲基甲酰胺溶液;其余部分和实施例1完全一致。
31.实施例10:脱保护剂:含有15v/v%哌啶和1.5v/v%乙酰丙酮的二甲基甲酰胺溶液;其余部分和实施例1完全一致。
32.实施例11:脱保护剂:含有15v/v%哌啶和4v/v%乙酰丙酮的二甲基甲酰胺溶液;其余部分和实施例1完全一致。
33.实施例12:脱保护剂:含有15v/v%哌啶的二甲基甲酰胺溶液;其余部分和实施例1完全一致。
34.实施例13:脱保护剂:含有20v/v%哌啶的二甲基甲酰胺溶液;脱保护时间为20min。其余部分和实施例1完全一致。
35.试验例1:1.1树脂的活化情况的测试:分别称量上述实施例1.1中树脂浸泡后抽去的溶液的体积,计算树脂吸收的溶液,以树脂吸收的溶液/树脂(ml/g)表示树脂的膨胀情况。树脂膨胀度的测定结果见图3。
36.1.2 fmoc吸光法标准曲线的建立;首先制作fmoc浓度的标准曲线:称取fmoc
‑
gly
‑
oh 59.3mg,溶于20v/v%哌啶的dmf溶液,混匀振荡40min,过滤,合并滤液定容于10ml容量瓶内,fmoc保护基的浓度为20mmol/l。取此溶液稀释成0.1mmol/l、0.2mmol/l、0.3mmol/l、0.4mmol/l、0.5mmol/l、0.6mmol/l、0.7mmol/l、0.8mmol/l、0.9mmol/l标准液,使用紫外分光光度计于290nm处测定标准液吸光度并根据数据绘制标准曲线。根据数值得到回归方程。以吸光度为y轴,浓度为x轴,建立的fmoc标准曲线方程为y=6.58x+0.23,r2=0.996。
37.1.3 fmoc基团脱除率的测定:fmoc基团量的测定:首先准确称量0.0005g实施例1中的活化的树脂,加入20v/v%哌啶的二甲基甲酰胺溶液8ml反应40min,然后甲醇反复洗涤,收集所有滤液,滤液体积为v1。将滤液290nm下的吸光度代入上述fmoc的标准曲线方程,得到fmoc基团的浓度n1。
38.fmoc基团量(mmol/g)=n1×
v1/0.0005;分别称取上述实施例1.2步骤前活化树脂的质量,记为m,分别取树脂脱保护后抽滤得到的溶液,滤液体积为v2,将滤液290nm下的吸光度代入上述fmoc的标准曲线方程,得到脱除的fmoc基团的浓度n2。
39.脱除的fmoc基团量=(n2×
v2)/mfmoc的脱除率=(脱除的fmoc基团量/ fmoc基团量)
×
100%。fmoc基团的脱除率的测定结果见图5。
40.1.4树脂和首个氨基酸连接率的测定:首先准确称量一定量(0.0050g)上述实施例中的fmoc
‑
lys(boc)
‑
rink amide am树脂样品,加入20v/v%哌啶的二甲基甲酰胺溶液8ml反应40min,然后甲醇反复洗涤,收集所有滤液,定容至10ml,290nm下测紫外吸收值。根据下式计算树脂的实际担载量、理论担载
量、连接率。
41.1)树脂的实际担载量(mmol/g)=(w2‑
w)/[(mw
a
‑
mw
b
)
×
w2]其中,w2为fmoc氨基酸
‑
树脂重量,g;w为树脂的重量,g;mw
a
为fmoc氨基酸的分子量;mw
b
为h2o的分子量;2)树脂的理论担载量(mmol/g)=m
×
w/[w+m
×
w
×
(mw
a
‑
mw
b
)/1000]其中,m为树脂的取代度,mmol/g;w为树脂的重量,g;mw
a
为fmoc氨基酸的分子量;mw
b
为h2o的分子量;3)连接率=(树脂的实际担载量/树脂的理论担载量)
×
100%。实施例1
‑
7中树脂和首个氨基酸连接率的测定结果见图4。实施例1、8
‑
13中树脂和首个氨基酸连接率的测定结果见图6。
[0042]
1.5肉豆蔻五肽
‑
4的产率的测定:分别采用rp
‑
hplc法对上述实施例得到的产品进行纯化,收集目标峰的多肽溶液,经浓缩、冻干,得到多肽的纯品,称重,为肉豆蔻五肽
‑
4的实际产量。根据上述树脂的取代度计算理论产量,肉豆蔻五肽
‑
4的实际产量与理论产量的比值即为肉豆蔻五肽
‑
4的产率。实施例1
‑
7肉豆蔻五肽
‑
4的产率的测定结果见图7。实施例1、8
‑
13肉豆蔻五肽
‑
4的产率的测定结果见图8。
[0043]
由图3、图4、图7可以看出,实施例1、实施例2、实施例3的树脂的膨胀度、树脂和首个氨基酸连接率、肉豆蔻五肽
‑
4的产率均明显大于实施例4、实施例5、实施例6、实施例7,这说明:二甲基甲酰胺和蓖麻油酸按照体积比8
‑
10:1
‑
2的比例对树脂进行活化,能够促进树脂的溶胀,有利于待反应的基团进出树脂的空隙,提高树脂与第一个保护氨基酸的连接效率,进而能够提高肉豆蔻酰五肽
‑
4的产率。
[0044]
由图5、图6、图8可以看出,实施例8、实施例9的fmoc基团的脱除率明显大于实施例10、实施例11、实施例12、实施例13,实施例1、实施例8、实施例9的树脂和首个氨基酸连接率、肉豆蔻五肽
‑
4的产率均明显大于实施例10、实施例11、实施例12、实施例13,这说明:含有体积比为13
‑
15:2
‑
3的哌啶与乙酰丙酮的脱保护剂,在较短的时间和较少的脱保护剂下能够促进fmoc基团的脱除,有利于树脂上氨基酸的氨基的暴露,与羧基反应形成肽键,提高氨基酸偶联率,从而提高肉豆蔻酰五肽
‑
4的产率。
[0045]
上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。
[0046]
以上实施方式仅用于说明本发明,而并非对本发明的限制,本领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此,所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1