一种水稻新生多肽结合复合体α亚基NACA基因在植物抗渗透胁迫中的应用
一种水稻新生多肽结合复合体
α
亚基naca基因在植物抗渗透胁迫中的应用
技术领域
1.本发明涉及基因功能技术领域,尤其涉及一种水稻新生多肽结合复合体α亚基naca基因在植物抗渗透胁迫中的应用。
背景技术:
2.植物对胁迫环境的抵抗力称为抗逆性,在细胞和个体水平上,对环境胁迫的抵抗主要表现为避逆性、御逆性和耐逆性3种形式。植物回应威胁环境是一个动态的过程。根据胁迫因子作用的时间强度以及植物体相应的状态,可划分为预警阶段、抗性阶段和耗尽阶段。其中,耗尽阶段超过了植物的耐性极限,必然导致植物体发生不可逆的损伤和死亡,而预警和抗性阶段是研究植物体如何感知胁迫,进行自我修复与调节的重要生理生态过程。具体表现为:物质分解与合成代谢的调整、细胞结构与功能的维持、以及感觉受到威胁和信息传递及保护物质的合成和积累等,植物体内这些应对胁迫损害的抗逆调节过程协调配合,从而在最大程度上实现了植物生命功能的维持和对胁迫环境的适应。植物响应非生物胁迫是动态的、复杂的,既是可逆过程又是不可逆的。同时,植物对胁迫的应答依赖于组织或器官胁迫的感应。例如,根部胁迫的转录反应存在组织特异性或细胞特异性,且有很大的不同,这取决于所涉及的胁迫。
3.湖南省为水稻种植的大省,水稻栽培面积以及产量都名列前茅。在进行水稻种植的过程中,会有多种不利的因素存在。正因为这些因素的存在,从而会对水稻的品质和产量都造成巨大的损失。很多胁迫如干旱、高盐、极端温度等都能够影响植物体在生长过程中其内部蛋白质参与活动的系列过程,会对植物的正常生长发育带来消极影响。
4.新生多肽结合复合体(nascentpolypeptide-associated complex,nac)是由α和β两个亚基组成的异源二聚体,能够保护新生多肽,并引导新生多肽正确定位。研究表明,2个亚基均存在的nac结构域,一般位于亚基的n端,而naca的c端存在的uba结构域,但其中某些物种的β-nac含有入核信号(huh su,kim kj,paek kh.capsicum annuum basic transcription factor 3(cabtf3)regulates transcription of pathogenesis related genes during hypersensitive response upon tobacco mosaic virus infection[j].biochem biophys res commun,2012,417:910-917.)。nac的两个亚基在细胞内有着各自不同的作用,β亚基与caspase-3相互作用,可能参与调控细胞凋亡(kogan gl,gvozdev va.multifunctional nascent polypeptideassociated complex(nac).mol biol 2014;48:189-96.),而nac的α亚基主要是在转录调控中起作用。
[0005]
从简单的古细菌到复杂的动物植物都存在naca蛋白,它们可能起源于同一个基因,但是在进化过程中由于基因复制产生了2个或者更多个不同的基因。在古细菌的基因序列中,发现只有1个基因与naca的同源性很高,没有β-nac同源基因。在酵母中,nac拥有3个同源蛋白,包括1个naca和2个β-nac。在人类细胞中,naca有naca和sknac,β-nac的有btf3b和btf3a。在拟南芥中,naca同源性较高的蛋白共有5个,β-nac同源性较高的蛋白有1个。
naca可以独立行使转录调控、内质网胁迫、细胞凋亡等功能。naca作为新生多肽出核糖体的通道组分,负调控了其向er上的转移(hotokezaka y,katayama i,van leyen k,et al.gsk-3β-dependent downregulation ofγ-taxilin andαnac merge to regulate er stress responses.cell death and disease,2015,6(4):e1719.)。naca可以结合到新生多肽链上,调节信号识别颗粒的作用,影响新生多肽转移到er腔内。临床研究表明,naca蛋白在恶性胶质瘤、乳腺癌细胞、单核细胞白血病等癌细胞中丰度增加(kroes ra,jastrowa,mclone mg,et al.the identifification of novel therapeutic targets for the treatment of malignant brain tumors.cancer lett 2000;156:191
–
198;murphy jp,pinto dm.temporal proteomic analysis of igf-1r signalling in mcf-7breast adenocarcinoma cells.proteomics,2010,10:1847
–
1860.)。naca的降解激活了er胁迫,开启了缺氧细胞的凋亡(hotokezakay,van leyen k,lo eh,et al.αnac depletion as an initiator of er stress-induced apoptosis in hypoxia.cell death&differentiation,2009,16(11):1505-1514.)。同时,naca是转录共激活子,可以结合到下游基因启动子元件(5-c/gc/gac/gac/gannn g-3)上,也可以和转录抑制因子互作,进而辅助其他转录因子而调控下游基因表达。在成骨细胞中,naca作为转录辅助因子与转录因子cjun,进而加强下游靶基因的表达,如lrp6和bglap2。naca和cjun结合到lrp6和osteocalcin基因的启动子上,加强jund对lrp6的转录水平(pellicelli m,hariri h,miller j.a,and st-arnaud r,lrp6 is a target of the pth-activatedαnac transcriptional coregulator.biochim.biophys.acta gene regul mech,2018,1861(2):61-71)。pka可以将naca磷酸化,使其在细胞核中定位,进一步富集在靶基因启动子区,调控靶基因的表达,最终影响骨质(pellicelli m,miller ja,arabiana,et al.the pth-gs-protein kinase a cascade controls nac localization to regulate bone mass.molecular and cellular biology,2014,34(9):1622-1633.)。naca可以和pp1a全酶复合体多个亚基互作,从而去磷酸化,影响其在细胞核中的定位及和btf3的互作,因此naca的磷酸化状态影响ap-1途径相关基因的表达及成骨的分化和基质的矿质化(addison wn,pellicelli m,st-arnaud,ren
é
.dephosphorylation of the transcriptional cofactor naca by the pp1a phosphatase enhances cjun transcriptional activity and osteoblast differentiation.journal ofbiological chemistry,2019.)。在成肌细胞和成骨细胞中,naca也可以通过和共抑制子hdac1和hdac3互作,抑制下游基因的转录,但过表达naca的缺少n-端的肽段则没有抑制作用(jafarov t,alexander jwm,ren
é
st-arnaud.αnac interacts with histone deacetylase corepressors to control myogenin and osteocalcin gene expression.biochimica et biophysicaacta,2012,1819(11-12).)。在斑马鱼中,naca的缺失可以阻碍了造血干细胞的维持、延伸和分化,影响造血功能(murayama e,sarris m,redd m,et al.naca deficiency reveals the crucial role ofsomite-derived stromal cells in haematopoietic niche formation.nature communications,2015,6:8375.)。研究表明,水稻nac的β亚基调控了水稻的生长发育和抗逆性,但关于α亚基(naca)对植物的研究鲜有报道。
技术实现要素:
[0006]
为克服现有技术中存在的上述缺陷,本发明提供了一种水稻新生多肽结合复合体α亚基naca基因在植物抗渗透胁迫中的应用。
[0007]
为了实现上述发明目的,本发明提供以下技术方案:
[0008]
本发明提供了一种水稻新生多肽结合复合体α亚基naca基因在植物抗渗透胁迫中的应用。
[0009]
优选的,所述naca基因的核苷酸序列如seq id no.1所示。
[0010]
优选的,所述植物包括拟南芥和水稻。
[0011]
优选的,所述应用包括以下步骤:
[0012]
(1)将所述naca基因重组于初始载体pcambia1305获得重组过表达载体;
[0013]
(2)将所述重组过表达载体转到农杆菌中获得携带有所述naca基因的重组农杆菌;
[0014]
(3)用所述携带有所述naca基因的重组农杆菌侵染植株或愈伤组织。
[0015]
优选的,步骤(1)中所述naca基因重组于初始载体pcambia1305的xbai和hindiii酶切位点之间。
[0016]
优选的,所述渗透胁迫包括干旱处理,甘露醇诱导,茉莉酸诱导,水杨酸诱导,低温处理,脱落酸诱导或高盐处理。
[0017]
本发明还提供了一种水稻新生多肽结合复合体α亚基naca基因在植物抗逆育种中的应用,所述植物包括拟南芥和水稻。
[0018]
与现有技术相比,本发明的有益效果如下:
[0019]
本发明研究了naca基因的表达、定位,并将naca基因构建到载体pcambia1305中,将载体转入农杆菌,利用农杆菌介导的遗传转化方法转入预先培养的愈伤组织中,待愈伤长成植株后对其进行分析。所得结果为:在甘露醇(mannitol)、脱落酸(aba)、茉莉酸(ja)、高盐(nacl)、水杨酸(sa)胁迫下,naca基因呈下调表达,而低温胁迫的表达水平趋于平稳。通过亚细胞定位可知naca蛋白定位于细胞核和细胞质中;在拟南芥的遗传转化中,检测出18株已经成功导入目的基因的拟南芥幼苗;在水稻的遗传转化中,通过测序发现,获得8株转基因水稻且表达量较野生型有明显提高,说明本发明的过表达有效果;过表达naca2的拟南芥和水稻的抗旱性明显增强。本发明为深入分析naca基因的生物学功能奠定了基础,也为拟南芥和水稻抗逆育种提供了参考和可利用的资源。
附图说明
[0020]
图1为水稻naca基因的生物信息学分析(注:a:naca基因的基因结构;b:naca蛋白保守基序分析;c:水稻naca蛋白保守结构域分析,上面框内为nac结构域,下面框内为uba结构域;d:不同植物及酵母中naca氨基酸序列进化分析,酿酒酵母(saccharomyces cerevisiae,sc)、脐形紫菜(porphyra umbilicalis,pu);布朗葡萄藻(botryococcus braunii,bb)、角齿藓(ceratodon purpureus,cp)、伞地钱(marchantia polymorpha,mp)、江南卷柏(selaginella moellendorffii,sm)、大豆(glycine max,gm)、拟南芥(arabidopsis thaliana,at)、水稻(oryza sativa,os);高粱(sorghum bicolor,sb));
[0021]
图2为naca基因在水稻不同组织中的表达模式分析(注:右侧颜色标尺代表基因表
达量的高低,颜色从下到上表示表达量从低到高,主要组织为20天的叶片、抽穗后的花、抽穗前的花、愈伤、雌蕊、授粉后25天a的胚、授粉后5天的种子、授粉后10天的种子、圆锥花序、授粉后25天的胚乳、幼苗、花丝和茎);
[0022]
图3为naca基因在非生物胁迫下的表达模式图(注:图a-f分别为在100μmol/l茉莉酸、100μmol/l水杨酸、4℃、100μmol/l脱落酸、250mmol/l氯化钠、300mmol/l甘露醇处理后的naca的表达模式);
[0023]
图4为naca2基因生物信息学分析图(注:a为nac蛋白结构域;b为naca2蛋白的亚细胞定位);
[0024]
图5为naca2基因的亚细胞定位的载体图;
[0025]
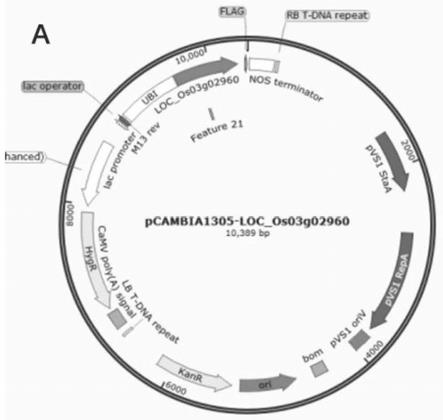
图6为naca2转基因载体pcambi1305图谱;
[0026]
图7为naca2转基因拟南芥在渗透胁迫下的表型(a为qpcr鉴定转基因拟南芥中naca2的转录水平;b为naca2转基因拟南芥干旱处理23天和复水5小时的表型;c为naca2转基因拟南芥复水后地上部分重量统计;d为naca2转基因拟南芥失水速率;e为naca2转基因拟南芥对甘露醇的响应;f为甘露醇处理后主根长度的统计);
[0027]
图8为水稻愈伤组织遗传转化流程图(注:a为日本晴种子进行诱导培养;b为愈伤组织与农杆菌eha105共培养;c为利用抗生素对愈伤组织进行筛选;d为抗性愈伤分化出绿芽;e为再生苗的生根培养);
[0028]
图9为水稻的抗旱性鉴定(注:a为干旱处理后的表型图;b为转基因水稻表达量的鉴定;c为转基因水稻干旱后成活率统计)。
具体实施方式
[0029]
本发明提供了一种水稻新生多肽结合复合体α亚基naca基因在植物抗渗透胁迫中的应用。
[0030]
在本发明中,所述naca基因的核苷酸序列优选如seq id no.1所示。
[0031]
在本发明中,所述植物优选包括拟南芥和水稻。
[0032]
在本发明中,所述应用优选包括以下步骤:
[0033]
(1)将所述naca基因重组于初始载体pcambia1305获得重组过表达载体;
[0034]
(2)将所述重组过表达载体转到农杆菌中获得携带有所述naca基因的重组农杆菌;
[0035]
(3)用所述携带有所述naca基因的重组农杆菌侵染植株或愈伤组织。
[0036]
在本发明中,所述应用的具体步骤优选为通过xbai和hindiii酶切含有naca基因的peasy-blunt克隆载体和pcambia1305,回收载体片段与目的片段,在22℃的温度下,利用t4 dna连接酶连接过夜,转化大肠杆菌xl1-blue,提取并鉴定重组质粒,再将酶切鉴定正确的载体转入农杆菌菌株eha105,通过农杆菌介导的水稻花序抽真空遗传转化方法转化植株或愈伤组织。
[0037]
在本发明中,步骤(1)中所述naca基因优选重组于初始载体pcambia1305的xbai和hindiii酶切位点之间。
[0038]
在本发明中,所述渗透胁迫优选包括干旱处理,甘露醇诱导,茉莉酸诱导,水杨酸诱导,低温处理,脱落酸诱导或高盐处理,所述干旱处理为幼苗生长至一定时期停止浇水,
所述甘露醇诱导中甘露醇的浓度为300mmol/l,所述茉莉酸诱导中茉莉酸的浓度为100μmol/l,所述水杨酸诱导中水杨酸的浓度为100μmol/l,所述低温处理为4℃处理,所述脱落酸诱导中脱落酸的浓度为100μmol/l,所述高盐处理为用250mmol/l氯化钠处理。
[0039]
本发明还提供了一种水稻新生多肽结合复合体α亚基naca基因在植物抗逆育种中的应用,所述植物包括拟南芥和水稻。
[0040]
下面结合实验例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0041]
以下实验例中的水稻品种为日本晴,拟南芥品种为哥伦比亚(col-0)。
[0042]
实验例1
[0043]
水稻naca家族基因的鉴定与生物信息分析:
[0044]
利用拟南芥naca蛋白序列做诱饵,对phytozome中的水稻蛋白组数据库进行比对分析,获取基因号、基因组序列、转录产物序列、氨基酸序列。在smart和ncbi网站预测naca蛋白结构域,进一步确定氨基酸序列中是否包含nac和uba结构域。利用expasy在线预测naca蛋白的等电点、分子量和不稳定系数。利用gsds(gene structure display serve)在线工具分析水稻naca家族基因外显子-内含子结构。通过meme软件分析氨基酸序列中的保守基序,最短基序为5,最长的基序为50,共显示10个保守基序。利用clustalw软件对水稻naca氨基酸序列进行比对分析,利用genedoc对比对结果进行编辑。从phytozome及ncbi数据库中获取脐形紫菜(porphyra umbilicalis)、大豆(glycine max)、拟南芥(arabidopsis thaliana)、水稻(oryza sativa)、高粱(sorghum bicolor)、布朗葡萄藻(botryococcus braunii)、角齿藓(ceratodonpurpureus)、伞地钱(marchantia polymorpha)、江南卷柏(selaginella moellendorffii)及酿酒酵母等多物种naca同源性较高的物种的氨基酸序列,比对结果使用mega6.0软件采用邻接法(bootstrap=1000)构建系统进化树,分析不同物种naca的进化关系。利用msu-rgap(http://rice.uga.edu/index.shtml)数据库获取nacas基因在不同组织中的表达数据,利用并利用hemi1.0绘制表达量热图。
[0045]
水稻中naca基因家族成员较少,共有5个,将其命名为naca1~naca5。其中,naca1具有两个转录本。naca基因和蛋白的理化性质分析结果如表1所示。由表1可知,naca基因长度在578~258bp之间,编码的蛋白分子量范围为12943.14~57239.89da,编码的氨基酸长度为122~516aa。蛋白质的等电点值都介于4~9之间,naca5的等电点差异与其他蛋白较大,为8.63,而naca1~4的等电点均在4.5左右。蛋白均具有较高的不稳定系数,为48.73~71.82,其中naca4为71.82,说明naca蛋白均为不稳定蛋白,容易被降解。
[0046]
表1水稻naca基因家族成员的理化性质
[0047][0048]
对水稻naca基因进行生物信息学分析,结果如图1所示。由图1可知,naca1和naca3亲缘关系最近,naca2与naca4和naca5有较近的进化关系(图1中的a和d)。亲缘关系较近的蛋白也含有相似保守基序,基序分布也相似。naca1和naca3含有motif1、2、3、7,但不含有motif4。naca1、naca4和naca5中都含有motif1、motif4、motif7和motif10(图1中的b)。蛋白序列比对结果表明,nacas中含有三个保守的区域,即位于n端的富含天冬氨酸(d)结构域、位于中间的nac结构域及位于c端的uba结构域,其中naca5与naca4序列相似度很高,但缺少部分nac结构域和uba结构域(图1中的c)。进化分析结果表明,nacas与生物的进化相一致,亲缘关系为酵母(sc)》藻类(pu,bb)》苔藓(cp)》蕨类(sm,mp)》种子植物(at、gm、os、zm)。种子植物中的nacas分为两个亚家族,且每个亚家族中单子叶植物与双子叶植物分化明显(图1中的d)。
[0049]
实验例2
[0050]
水稻naca基因的组织表达及诱导表达模式分析:
[0051]
选取饱满无霉的水稻种子,用手工脱去谷壳后,去壳种子用75%酒精消毒10分钟,再用次氯酸钠溶液消毒45min,用无菌水冲洗5次,将其播种到ms培养基上,置于培养箱中(培养条件为温度20℃、12h光照/12h黑暗)培养15d。将水稻幼苗转移至液体ms培养基中继续培养2d,然后用含有100μmol/l茉莉酸、100μmol/l水杨酸、100μmol/l脱落酸、300mmol/l甘露醇、250mmol/l氯化钠的液体ms培养基及4℃处理0h、1h、3h、6h、12h、24h后取样,用试剂盒提取总rna。利用反转录试剂盒合成第一条链cdna,产物保存于-80℃。naca基因特异引物进行qpcr,以actin基因做内参,引物序列如表2引物序列中的seq id no.4~seq id no.15所示。反应体系为10μl,反应参数为94℃预变性1min,95℃变性15s,55℃退火20s,72℃延伸30s,45个循环。每次实验设置3次重复,采用2
‑△△
ct
法分析实验结果。
[0052]
表2引物序列
[0053]
[0054][0055]
组织表达模式分析结果如图2所示。由图2可知,水稻naca1~5基因在很多组织均有表达,表达水平有差异。整体上naca1、naca2、和naca3在水稻各组织中表达普遍处于高水平,naca4与naca5均比较低。除了叶片、花药、种子和胚乳,naca1和naca3基因在其他组织中表达较高,在花序中的表达量最高。naca2基因在水稻叶片、花和茎中有较高的表达量,其中在茎中的表达量最高,但其他组织中表达普遍处于较低水平。naca4和naca5基因在水稻各组织中表达较低,处于低水平表达状态。与其他组织相比,naca4和naca5在茎和幼苗中表达量相对较高。
[0056]
诱导表达模式分析结果如图3所示。由图3可知,5个naca的表达在不同程度上受ja(茉莉酸)、sa(水杨酸)、低温、aba(脱落酸)、高盐、甘露醇的诱导。在ja诱导后,naca1、naca2和naca5的表达量先降低,后期略有升高,而naca3和naca4表达量没有变化(图3中的a)。在sa诱导后,naca2的表达量随着处理时间的延长而降低,naca4表现出降升降的表达趋势,其余3个基因的表达量上调,但趋势不同。随着处理时间的延长,naca1表达量持续上升,naca3先上升再下降,naca5表现最为明显,诱导后表现出持续较高水平的表达(图3中的b)。在低温处理后,naca5的表达量表现出升降升降的表达模式,在处理后1和12小时出现高峰,其他基因没有明显变化(图3中的c)。脱落酸处理后,naca1基因的表达量持续降低,其余4个基因的在后期表达量增加(图3中的d)。nacl和甘露醇处理后,naca基因的表达模式与脱落酸处理类似,都表现出先下降再上升的趋势,但naca5在nacl处理后的表达是升降升(图3中的e和f)。
[0057]
实验例3
[0058]
naca2基因的基因生物信息学分析(其中,naca2基因的核苷酸序列如seq id no.1所示,下同):
[0059]
利用smart和ncbi网站预测nac蛋白结构域,结果如图4中的a所示。由图4中的a可知,nac蛋白结构域位置在92-138aa,scop结构域在46-70aa,uba结构域在184-220aa。
[0060]
利用基因特异引物(seq id no.2和seq id no.3)克隆naca2全长的cds,并利用同
源重组的方法克隆到pbwa(v)hs。利用35s启动子驱动naca2-gfp,表达融合蛋白,以空载体作为对照。将构建好的载体,转化水稻原生质体,利用荧光共聚焦显微镜观察绿色荧光信号。结果如图4中的b所示。由图4中的b可知,gfp荧光信号分布在细胞核和细胞质中,naca2-gfp融合蛋白的绿色荧光信号也分布在细胞质和细胞核中,与对照相似。由此表明,naca2蛋白定位于细胞核和细胞质中。
[0061]
图5为亚细胞定位的载体图:naca2的c端融合gfp,利用35s启动子驱动融合基因表达。原核生物中为卡那霉素抗性,植物中为潮霉素抗性。
[0062]
实验例4
[0063]
研究水稻新生多肽结合复合体α亚基naca2基因在拟南芥抗渗透胁迫中的应用:
[0064]
本实验例所用到的试剂耗材如表3所示。
[0065]
表3试剂耗材
[0066][0067][0068]
本实验例所用到的仪器设备如表4所示。
[0069]
表4仪器设备
[0070][0071]
1.naca2基因过表达载体的创建:
[0072]
(1)根据naca2和pcambi1305载体的序列设计特异性引物(正向引物序列如seq id no.16所示;反向引物序列如seq id no.17所示)。以水稻基因组cdna为模板进行pcr扩增,扩增程序如表5所示。pcr程序运行完之后,产物用琼脂糖凝胶(1%)进行跑胶分离,在紫外灯下进行观察,切取凝胶条带。切胶之后用试剂盒对所需的目的片段进行回收,之后再连接克隆载体peasy-blunt完成测序。
[0073]
表5 pcr扩增程序
[0074][0075][0076]
(2)通过xbai和hindiii酶切含有目的片段的peasy-blunt克隆载体和pcambi1305,电泳检测后切胶回收载体片段和目的片段。
[0077]
(3)在22℃的温度下,利用t4dna连接酶连接过夜,转化大肠杆菌xl1-blue,提取菌落并鉴定重组质粒(如图6所示)。
[0078]
(4)酶切鉴定正确的载体转入农杆菌菌株eha105,农杆菌介导的拟南芥花序抽真空遗传转化方法转化野生型拟南芥,并获得再生苗。
[0079]
2.潮霉素筛选纯合转基因拟南芥:
[0080]
(1)配置培养基:准备干净的试剂瓶,在电子分析天平上准确称取ms盐0.48g,蔗糖3.0g,琼脂粉2.0g放于试剂瓶中,加入蒸馏水。
[0081]
(2)灭菌准备:将配置好的培养基、0.2%琼脂溶液(用于铺种子)、超纯水、培养皿、枪头、ep管放入高压灭菌锅中121℃灭菌15min。灭完菌后将培养基、培养皿、枪头、ep管放入
烘箱中65℃烘2h,保证培养基不冷却凝固。
[0082]
(3)倒平板:将超净工作台提前打开,紫外照射30min,通风15min。在超净工作台下,在培养基中加入1/1000潮霉素,并将培养基趁热倒入培养皿中,每个平板倒40ml。将倒好的培养皿在超净工作台中冷却至凝固。
[0083]
(4)铺种子:取拟南芥wt和准备筛选种子于ep管中。用15%naclo溶液洗涤(反复颠倒振摇10min)。然后在超净工作台内用ddh2o反复洗涤5次,洗净后每个ep管加入适量0.2%琼脂溶液,混匀。将培养皿用记号笔做好标记。用移液枪吸取混匀的种子,拔下枪头并在培养基上铺种,每个部分分别铺20粒种子。铺完种子后将培养皿盖在酒精灯火焰上灭菌后再盖上,并用封口胶封好培养皿。
[0084]
(5)种子培养:将封好的培养皿放置于4℃的低温黑暗环境中。待3天后,将种子转移至培养室中。培养室温度保持在22℃,光照强度为7000lux,光周期16h光照/8h黑暗。
[0085]
(6)培养一周,观察幼苗的大小,大小不一的是杂合植株,大小一致的是纯合植株,并记录纯合植株株系。
[0086]
(7)育苗:将上述纯合植株培养2周后的幼苗转移至无菌的营养土中,用透明塑料袋覆盖一天。24h后揭开塑料袋,温室培养(相对湿度rh=55%,温度保持在22℃,光照强度为7000lux,光周期16h光照/8h黑暗)。
[0087]
3.pcr鉴定:
[0088]
(1)dna提取:取4片叶片于研钵中,加入600μl sds缓冲液研磨后转入1.5ml离心管,于12000r,25℃下离心2min。离心后分层,去沉淀,取上清于新的ep管中,加入1倍体积的异丙醇,此时可见絮状dna。静置30min后倒掉上清,用70%的乙醇洗涤,12000r离心2min后倒掉上清并打开盖晾干乙醇。最后加25μl dd h2o溶解即可。
[0089]
(2)pcr扩增:扩增体系(20μl):2x m5 taq pcr mix(10μl)、正向引物(0.4μl)、反向引物(0.4μl)、dna(2μl)、dd h2o(7.2μl)。扩增程序为:94℃,3min;94℃,30s;58℃,30s;72℃,100s,30个循环;72℃,10min,其中,正向引物序列如seq id no.6所示;反向引物序列如seq id no.7所示。
[0090]
(3)琼脂糖凝胶电泳检测:配置1%琼脂糖凝胶:称取1g琼脂糖溶于100ml 1xtae缓冲液中。将溶液在微波炉中加热至无水纹(加热时轻摇观察),冷却至不烫手。在电泳槽中加入8μl eb溶液,将琼脂糖溶液倒入电泳槽,并且与eb溶液混匀。冷却至凝固。取dna 3μl和3.4μl上样缓冲液混匀并打入凝胶孔中(及5μl dna marker打入凝胶孔中)。通过琼脂糖凝胶电泳进行dna完整性检测。
[0091]
4.实时荧光定量鉴定:
[0092]
获得再生苗后,通过qpcr对过表达的转基因植株进行鉴定,获得高表达转基因拟南芥阳性植株。
[0093]
(1)rna提取:取目的叶片4片于研钵中,加入1ml trizol溶液研磨后转入1.5ml离心管,静置5min后,加入200μl氯仿,旋涡震荡15s,混匀,冰上放置2.5min,12000r离心15min后取上层。上层液加入500μl 100%异丙醇,室温放置10min,12000r离心10min。弃上清,保留沉淀,加入1ml 75%的乙醇,轻轻震荡后7500r离心5min,弃上清后室温干燥8min,最后加入35l rnase-free水。
[0094]
(2)琼脂糖凝胶电泳检测:配置1.2%琼脂糖凝胶,在电泳槽中加入8μl eb溶液,将
琼脂糖溶液倒入电泳槽,并且与eb溶液混匀。冷却至凝固。取rna 3μl和3.4μl上样缓冲液混匀并打入凝胶孔中(及5μl dnamarker打入凝胶孔中)。通过琼脂糖凝胶电泳进行rna完整性检测。
[0095]
(3)rna反转录:反转录体系(50μl):5x reverse transcriptase buffer(10μl)、dntp(5μl)、oligodt(2.5μl)、mmlv(1.25μl)、ddh2o(5μl)、rna(25μl)、rnasin(1.25μl)。先将rna和oligodt混合加入200l ep管中,70℃下加热15分钟后,马上置于冰上5分钟。再加入剩下的组分,轻轻混匀后置于42℃,1小时。结束后放于-20℃冰箱中保存。
[0096]
(4)荧光定量pcr:取cdna(稀释10倍)加入各体系进行荧光定量pcr扩增。扩增体系(10μl)、2xfastsybrmix(5μl)、正向引物(如seq id no.6所示)(0.2μl)、反向引物(如seq id no.7所示)(0.2μl)、cdna(1μl)、ddh2o(3.6μl)。经过实时荧光定量分析基因表达量。
[0097]
5.naca2转基因拟南芥对非生物胁迫的响应:
[0098]
(1)拟南芥种子的灭菌:使用消毒试剂10%naclo处理种子表面15min,使用ddh2o清洗4~8次。
[0099]
(2)种子培养:将无菌的纯合种子和野生型种子分别放置在1/2ms、150mm mannitol+1/2ms培养基中,对培养基进行封口处理后,将其放置于4℃的低温黑暗环境中。待3天后,将种子转移至培养室中。培养室温度保持在22℃,光照强度为7000lux,光周期16h光照/8h黑暗。
[0100]
(3)统计根长:萌发5天后,将幼苗移至1/2ms及含有150mm甘露醇的1/2ms培养基上,竖直培养,5-7天后测量主根长。
[0101]
naca2转基因拟南芥在渗透胁迫下的生长情况如图7所示。由图7可知,在含有甘露醇的培养基上生长一周后,naca2过表达拟南芥的主根明显长于野生型(图7中的e和f)。
[0102]
6.naca2转基因拟南芥的抗旱性鉴定:
[0103]
在土壤中生长两周后(抽薹之前),将植株拔出剪掉地下部分,称量地上部分的生物量。在称量前做好充分的准备工作,先将天平预热30min,并将每张称量纸的净重记录下来。每隔30min称量一次,不称量的时候把苗散开放,以便更好失水减小误差。做复水试验的苗通过干旱处理4周,同一时间放置同一装有水的盆里进行复水,每隔3h及时观察植株的变化。复水24h后将土上部分剪掉称重并记录生物量。并将naca2转基因拟南芥幼苗移栽土壤两周后进行失水鉴定。
[0104]
以上实验结果如图7所示。由图7可知,在野生型的拟南芥中检测不到naca2的表达量,但在两个转基因株系中naca2的表达量很高(图7中的a)。干旱处理结果表明,干旱处理23天后,野生型和转基因株系都出现了明显的萎蔫现象。相对于野生型,转基因株系萎蔫程度较轻,颜色也比较绿。复水处理后,不同株系均开始恢复,叶片开始展开。与野生型相比,两条转基因株系复水速度明显快,复水时间越长差异越明显(图7中的b)。复水后,两条转基因株系地上部分的生物量均比野生型拟南芥大,野生型为1.63g,9号株系为1.97g,而1号株系有2.59g(图7中的c)。失水实验结果表明,naca2转基因拟南芥的失水速率均要比野生型拟南芥慢。失水12h后,9号株系为原始重量的73.78%,而野生型仅有55.57%(图7中的d)。
[0105]
实验例5
[0106]
研究水稻新生多肽结合复合体α亚基naca2基因在水稻抗渗透胁迫中的应用:
[0107]
1.naca2转基因水稻的培养:
[0108]
培养过程如图8所示。
[0109]
培养过程中用到的培养基如表6所示。
[0110]
表6培养基及其组分配方
[0111][0112][0113]
(1)愈伤组织诱导:将预先挑选饱满的、无霉菌的日本晴水稻种子去掉壳,使用75%的乙醇和naclo原液进行消毒灭菌,在震摇机上中速震摇40min,每次操作步骤后都需要用无菌蒸馏水洗涤,以免残留物质影响愈伤组织的萌发。将灭菌后的闽丝苗种子接种至ms诱导培养基中,在恒温培养箱中设置温度为27℃,暗培养10d。
[0114]
(2)农杆菌培养:在lb培养基上(含50mg/l kna和rif)培养具有pcambia1305载体(如图6所示)的农杆菌eha105菌株3d,在28℃的温度下黑暗培养。在50ml离心管内倒入10ml lb液体培养基(含1/1000,50mg/l的kna和rif),并挑取单菌落放入离心管中,28℃摇床上180rpm震荡培养2d。吸取农杆菌于灭过菌的离心管中,3600rpm离心15min,去除上清液,重悬沉淀之后将其转移至aam培养基中,最后在28℃下以180rpm的转速在摇床中震荡培养,直到培养基的颜色变为橙黄色且有絮状沉淀。
[0115]
(3)侵染和共培养:选择在诱导培养基中长势良好的愈伤组织,同时用刀片将愈伤组织的根去掉,用镊子夹取放入aam侵染培养基中,在水平摇床中进行30min慢摇,然后小心把菌液倒掉,将三角瓶内留下的愈伤组织倒在灭过菌的滤纸上,在超净工作台上用中速风吹干愈伤组织表面的水分,并将其接种在共培养基上,27℃暗培养2d。
[0116]
(4)筛选:用1/400的头孢水(50mg/l)洗涤共培养后的愈伤组织5次,然后再进行30
分钟浸泡处理,随后对其使用无菌水进行3次清洗,目的是完全除掉农杆菌;将愈伤组织倒在灭过菌的滤纸上面,使得表面的水分用滤纸吸干,之后接种于筛选培养基上(含1/400,50mg/l头孢+1/1000,50mg/l kna),放入恒温培养箱中培养,设置条件为:27℃,16h光照,8h黑暗交替培养。
[0117]
(5)分化培养:在预分化培养基(含1/400,50mg/l头孢+1/1000,50mg/l kna)里接种共培养基中生长良好的愈伤组织,放入恒温培养箱中培养,其条件设置为:27℃,16h光照,8h黑暗交替培养。一星期后会有绿芽出现;把预分化培养基内长出绿芽的愈伤接种至分化培养基中(含1/400,50mg/l头孢+1/1000,50mg/l kna),置于恒温培养箱中培养,每过21天进行培养基更换。
[0118]
(6)生根培养:当分化苗长高至4~7cm时,接种到1/2ms生根培养基上(含1/400,50mg/l头孢),最后置于恒温培养箱中,设置温度为27℃,16h光照,8h黑暗交替培养。长出不定根后把分化苗转移到室温。
[0119]
(7)移栽:4~5周之后,于生根培养基中加入适量的蒸馏水,然后在室内进行4~5天炼苗处理,再使用自来水洗涤干净附着在幼苗上的培养基,将分化苗移植到装满泥土的烧杯中,分化苗成活后再将其移栽到试验田或花盆中,直到成熟。
[0120]
3.rna提取及反转录cdna:
[0121]
通过试剂盒提取叶片总rna,用dnase i除去基因组dna后,按照takara公司反转录试剂盒说明书反转录成cdna,-80℃冰箱中保存备用。
[0122]
4.实时荧光定量pcr分析转基因水稻中naca2的表达量:
[0123]
实时定量的pcr反应体系(10μl sybr green supermix,1μl cdna模板,0.3μl正向引物,0.3μl反向引物,8.4μl ddh2o,其中正向引物序列如seq id no.6所示;反向引物序列如seq id no.7所示),pcr反应条件为:94℃预变性1min,95℃变性15s,55℃退火20s,72℃延伸30s,后3步45个循环。每次实验设置3次重复,采用2
‑△△
ct
法分析实验结果。
[0124]
5.naca2转基因水稻的抗旱性鉴定:选择饱满,无霉菌的水稻种子,75%酒精消毒1min,无菌水洗2次,次氯酸钠消毒45min,无菌水洗4-5次,无菌滤纸吸干水分,播种到ms培养基中。28℃,光照培养两周后,种植到营养土中(营养土:蛭石=1:1)。20天后,停止浇水直至出现干旱表型,然后复水,统计成活率。实验结果如图9所示。
[0125]
由图9可知,与野生型(ck)相比,8株转基因植株(oe-1~oe-8)中naca的表达水平明显高于对照(图9中的b)。停止浇水20天后,水稻植株出现明显的萎蔫现象,但过表达的水稻(oe-1、oe-3、oe-5)明显优于对照(ck)。复水10天后,多数过表达植株都出现了绿色,多数野生植株不能很好的恢复(图9中的a)。统计结果显示,野生型的存活率仅为10%左右,而过表达株系(oe-1、oe-3、oe-5)则超过70%(图9中的c)。
[0126]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1