生产尿嘧啶糖基化酶的方法及用于该方法的双载体系统与流程
1.本发明的涉及生物技术领域,更具体地,本发明涉及一种生产尿嘧啶糖基化酶的方法及用于该方法的双载体系统。
背景技术:
2.尿嘧啶糖基化酶(udg)是一种特异性降解含尿嘧啶碱基dna的水解酶,主要用于pcr残留污染的控制。依据udg蛋白的热稳定性分为耐热型udg和热敏型udg(不耐热)。耐热型udg由于热稳定好,使用过程中很难彻底被热灭活,因此会影响下游检测技术(如qpcr、多重pcr、体外诊断试剂盒等)的灵敏度。因此,热敏型udg更加适合兼容到qpcr等高灵敏度检测技术中。
3.目前热敏udg主要起源于嗜冷海洋生物,如大西洋鳕鱼和南极细菌,来源于这些海洋生物的udg的耐热性能差,其在表达过程中易形成包涵体而导致溶解度较低,而在纯化过程中易降低活性和丢失活性,最终导致udg的产量较低。因此,udg基因的挖掘、表达载体的构建方式、表达和纯化工艺都是开发该酶的技术难点。
4.因此,本领域亟需一种udg的生产方法,该方法可以显著提高udg的溶解性,增加udg的表达量和产量,同时保证udg的活性、稳定性和纯度。
技术实现要素:
5.如上所述,现有的udg生产方法,由于udg在表达过程中溶解度较低,而在纯化过程中又易活性降低和活性丢失,最终导致udg的产量较低。因此,本领域亟需一种udg的生产方法,该方法可以显著提高了udg的溶解性,从而增加udg的表达量和产量,同时保证udg的活性、稳定性和纯度。
6.有鉴于此,在第一方面,本发明提供了一种生产尿嘧啶糖基化酶(udg)的方法,所述方法包括以下步骤:
7.a)提供一种表达细胞,所述表达细胞包含能够表达所述udg的第一载体和能够表达分子伴侣素系统groel-groes的第二载体,其中,所述udg的氨基酸序列如seq id no:1所示,并且所述groel和groes的氨基酸序列分别如seq id no:2和seq id no:3所示;
8.b)在第一诱导条件下诱导所述表达细胞表达所述分子伴侣素系统groel-groes;
9.c)在第二诱导条件下诱导所述表达细胞同时表达所述分子伴侣素系统groel-groes和所述udg。
10.在第二方面,本发明提供了一种双载体系统,所述双载体系统包含:
11.(1)第一载体,所述第一载体能够表达尿嘧啶糖基化酶(udg),所述udg的氨基酸序列如seq id no:1所示;以及
12.(2)第二载体,所述第二载体能够表达分子伴侣素系统groel-groes,所述groel和groes的氨基酸序列分别如seq id no:2和seq id no:3所示。
13.在第三方面,本发明提供了一种表达细胞,所述表达细胞包含本发明第二方面的
双载体系统。
14.在第四方面,本发明提供了一种试剂盒,所述试剂盒包含:本发明第三方面的表达细胞、以及用于指导如何利用该试剂盒来生产尿嘧啶糖基化酶(udg)的说明书。
15.本发明的有益效果包括以下一个或者多个:
16.1)提供了一种生产尿嘧啶糖基化酶(udg)的方法,该方法可以显著提高udg的溶解性,从而增加udg的表达量和产量;
17.2)提供了一种可用于生产易受温度影响的热敏型udg的方法,通过低温诱导和低温纯化保证了热敏型udg的活性和稳定性;
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的实施方案。
19.图1显示了以嗜冷菌udg与常用的udg为对象构建的进化树。
20.图2显示了在37℃、0.5mm iptg、220rpm的诱导条件下,包含单质粒系统的大肠杆菌中udg(u1-u8)表达的凝胶电泳结果图。诱导前:未加入诱导剂的破碎细胞;全细胞:加入诱导剂后的破碎细胞;上清:全细胞的上清样品;虚线为udg蛋白。
21.图3显示了在不同的温度和诱导剂浓度的诱导条件下,包含单质粒系统的大肠杆菌中udg(u1-u8)表达的凝胶电泳结果图。诱导前:未加入诱导剂的破碎细胞;全细胞:加入诱导剂后的破碎细胞;上清:全细胞的上清样品;虚线为udg蛋白。
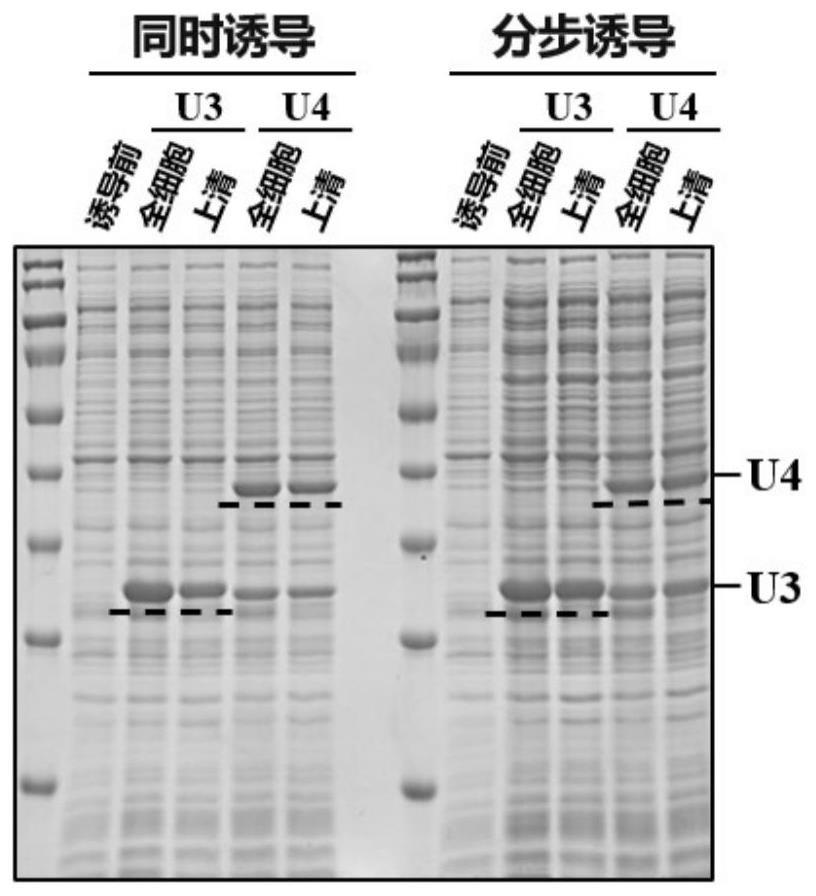
22.图4显示了在相同的诱导条件下,包含双质粒系统的大肠杆菌通过同时诱导和分步诱导表达的udg(u3和u4)的凝胶电泳结果图。
23.图5进一步显示了在相同的诱导条件下,包含单质粒系统或双质粒系统的大肠杆菌通过同时诱导和分步诱导表达的u3的凝胶电泳结果图。
24.图6显示了双质粒系统中通过同时诱导(a)和分步诱导(b)表达的u3在经过亲和层析后的凝胶电泳结果图。
具体实施方式
25.为更好地说明本发明的目的、技术方案和优点,下面将结合本发明的实施方案和附图,对本发明进行清楚、完整的描述。显然,所描述的实施方案仅仅是本发明的一部分实施方案,而不是全部的实施方案。基于本发明中的实施方案,本领域普通技术人员可以获得的所有其他实施方案,都属于本发明保护的范围。
26.如上所述,现有的udg生产方法,由于udg在表达过程中溶解度较低,而在纯化过程中又易活性降低和活性丢失,最终导致udg的产量较低。因此,本发明的目的在于提供一种新的udg的生产方法,该方法能够提高udg的溶解性,从而增加udg的表达量和产量,同时保证udg的活性、稳定性和纯度。
[0027]“分子伴侣(chaperone)”是一类协助细胞内分子组装和协助蛋白质折叠的蛋白质,分子伴侣主要有三大类:伴侣蛋白(chaperonin)、热激蛋白70家族和热激蛋白90家族。
groel及其辅助蛋白groes(groel-groes)是大肠杆菌中的一类典型伴侣蛋白,groel-groes一起在atp作用下形成桶状复合体,为蛋白质折叠提供合适的微环境。本发明人在实验过程中意外发现:groel-groes也能够用于促进udg的折叠。因此,本发明人设想是否能够通过groel-groes来提高udg的溶解性,从而提高udg的产量。
[0028]
发明人经试验发现:如果把表达udg和groel-groes的基因序列构建在同一个载体中并用该载体转化宿主细胞,则无法对由此得到的转化细胞进行分步诱导。如果将表达udg和groel-groes的基因序列分别构建在两个载体中(双载体系统),再用这两个载体转化宿主细胞,由此得到的转化细胞在进行同时诱导时,表达的udg的溶解性并未得到显著提升,但在进行分步诱导时,其中一种udg(即本发明中的u3和u4)的溶解性显著提高,变为完全可溶的状态。由此,本发明人完成了本发明。
[0029]
因此,在第一方面,本发明提供了一种生产尿嘧啶糖基化酶(udg)的方法,所述方法包括以下步骤:
[0030]
a)提供一种表达细胞,所述表达细胞包含能够表达所述udg的第一载体和能够表达分子伴侣素系统groel-groes的第二载体,其中,所述udg的氨基酸序列如seq id no:1所示,并且所述groel和groes的氨基酸序列分别如seq id no:2和seq id no:3所示;
[0031]
b)在第一诱导条件下诱导所述表达细胞表达所述分子伴侣素系统groel-groes;
[0032]
c)在第二诱导条件下诱导所述表达细胞同时表达所述分子伴侣素系统groel-groes和所述udg。
[0033]
步骤a)中述及的表达细胞可以是已形成的表达细胞,也可以是通过分别用能够表达所述udg的第一载体和能够表达分子伴侣素系统groel-groes的第二载体转化同一宿主细胞来获得的。因此,在一些实施方案中,在步骤a)中,所述表达细胞是通过分别用所述第一载体和第二载体转化同一宿主细胞获得的。
[0034]
术语“转化”是指含外源基因的重组载体例如质粒将外源基因直接导入原核细胞如细菌以使之获得新的遗传特性的过程。在一个实施方案中,所述第一载体和所述第二载体是通过不同转化方法来转化所述宿主细胞的。转化常用的方法包括热激法和电击法。因此,在一个优选的实施方案中,所述第一载体是通过热激法来转化所述宿主细胞的,所述第二载体是通过电击法来转化所述宿主细胞的。但应当理解,所述转化方法不限于此,本领域技术人员可以根据载体和宿主细胞的类型选择最适合的转化方法。
[0035]
把一个目的基因通过基因工程手段送到生物细胞(受体细胞),需要运载工具(交通工具)携带外源基因进入受体细胞,这种运载工具就叫做载体(vector)。基因工程上所用的载体是一类能自我复制的dna分子,其中的一段dna被切除而不影响其复制,可用以置换或插入外源(目的)dna而将目的dna带入宿主细胞。
[0036]
在本发明中,所述“载体”是指在基因工程重组dna技术中将外源基因片段转移至宿主细胞的一种能自我复制的dna分子。常用的载体有质粒(plasmid)、噬菌体(phage)、病毒(virus)等。在一些实施方案中,可以使用质粒作为所述第一载体和所述第二载体。在一些实施方案中,可以使用其中插入有udg编码基因从而能够在合适的宿主细胞中表达udg蛋白的质粒,例如pet21a、phue、pet20b、pet-22b、pet-28a或pet-32a质粒(优选为pet21a质粒)作为第一载体。又例如,可以使用其中插入有分子伴侣素系统groel-groes编码基因从而能够在合适的宿主细胞中表达该分子伴侣的pbad33质粒作为第二载体。以上仅为示例,
本领域技术人员能够理解,任何经改造后能够表达分子伴侣素系统groel-groes或udg的载体均可以在本发明中使用。
[0037]
宿主细胞是指在转化和转导(感染)中接受外源基因的细胞。就转化而言,宿主细胞通常为原核细胞,例如细菌细胞,并且大肠杆菌(escherichia coli)是最常用的宿主细胞。在一些实施方案中,所述宿主细胞为原核细胞,例如细菌细胞,如大肠杆菌。
[0038]
如背景技术所述,本文中的“udg”,也即尿嘧啶糖基化酶,是一种特异性降解含尿嘧啶碱基dna水解酶,主要用于pcr残留污染的控制,依据其热稳定性可分为耐热型udg和热敏型udg。在一个优选的实施方案中,本发明人基于生物信息学同源比对和进化树分析,从起源于嗜冷菌的udg分支中挑选出了一种热敏型udg,其氨基酸序列如seq id no:1所示。
[0039]
在步骤b)中,采用第一诱导条件来诱导所述表达细胞表达所述分子伴侣素系统groel-groes,所述第一诱导条件为使用第一诱导剂于16℃至37℃诱导0.5小时至5小时,所述第一诱导剂的浓度为0.001%至1%。本领域的技术人员知悉,在重组表达系统中,诱导剂是由表达载体所决定的。在步骤b)中,首先诱导groel-groes是为了让细胞内本底分子伴侣素含量增加,以保证在随后诱导udg时,udg能够得到更充分的折叠,从而提高udg的溶解性。作为示例,当所述第一载体为表达所述udg的pet21a质粒时,所述第一诱导剂可以为阿拉伯糖。在一些具体实施方案中,所述第一诱导条件为使用0.4%阿拉伯糖于25℃培养3小时。在本发明上下文中,所述第一诱导剂和第二诱导剂的浓度%是指质量百分比浓度,即以溶质的质量占全部溶液的质量的百分比来表示的浓度。
[0040]
在步骤c)中,采用第二诱导条件来诱导所述表达细胞同时表达所述分子伴侣素系统groel-groes和所述udg,所述第二诱导条件为使用所述第二诱导剂和第三诱导剂于16℃至20℃诱导16小时至20小时,其中所述第二诱导剂诱导所述表达细胞表达所述分子伴侣素系统groel-groes,所述第三诱导剂诱导所述表达细胞表达所述udg。第二诱导剂同第一诱导剂一样,都是用于诱导所述分子伴侣素系统groel-groes表达,两者实际上为相同的诱导剂。在步骤c)中,诱导udg时也同时诱导分子伴侣素系统groel-groes的表达,是为了维持细胞内groel-groes的含量,进一步地提高udg的溶解性。类似地,作为示例,所述第二诱导剂可以为阿拉伯糖。所述第二诱导剂的浓度可以为0.001%至1%,例如0.001%、0.05%、0.2%、0.4%、0.6%、0.8%、1.0%;所述第三诱导剂的终浓度可以为0.1mm至1.0mm,例如0.1mm、0.2mm、0.5mm、1.0mm。在一个具体实施方案中,所述第二诱导条件为使用0.4%阿拉伯糖作为第二诱导剂和0.1mm异丙基-β-d-硫代半乳糖苷(iptg)作为第三诱导剂于16℃诱导16小时至20小时。
[0041]
为了获得可实际使用的高纯度的udg,在诱导udg表达后,还需要进一步纯化经表达的所述udg。为此,在一些实施方案中,所述方法还包括步骤d):破碎在步骤c)中得到的表达细胞,并通过亲和层析在4℃至10℃的温度下纯化所述udg。
[0042]
可以使用常规的细胞破碎方法对细胞进行破碎,所述细胞破碎方法包括机械破碎法(如高压匀浆、珠磨、撞击破碎和超声破碎)、化学和生物化学渗透法(如酸碱处理、化学试剂处理、酶溶)、物理渗透法(如渗透压冲击法和冻结-融化法),但不限于此。在本发明的一个实施方案中,所述细胞破碎是通过超声破碎法来进行的。
[0043]
在细胞破碎之后、进行蛋白纯化之前,优选地,可以采用全能核酸酶来处理破碎后的udg表达细胞。采用全能核酸酶进行处理的目的是为了能够有效地控制核酸残留。
[0044]
所述蛋白纯化可以通过亲和层析进行。在一个实施方案中,所述第一载体还表达亲和标签,例如his标签、flag标签、hat标签、hpc标签、mbp标签、nusa标签、ub标签、或gst标签,此时,所述亲和层析可以利用所述亲和标签来进行。在一个具体的实施方案中,所述亲和标签可以是6
×
his标签。如上文所述,有些udg是不耐热的,因此在纯化过程中最好是在低温下进行。因此,在一个实施方案中,整个纯化过程在4℃至10℃的温度下进行,例如在低温层析柜中进行。
[0045]
在第二方面,本发明提供了一种双载体系统,所述双载体系统包含:
[0046]
(1)第一载体,所述第一载体能够表达尿嘧啶糖基化酶(udg),所述udg的氨基酸序列如seq id no:1所示;以及
[0047]
(2)第二载体,所述第二载体能够表达分子伴侣素系统groel-groes,所述groel和groes的氨基酸序列分别如seq id no:2和seq id no:3所示。
[0048]
本发明这一方面的载体具有与本发明第一方面所述的载体相同或相似的性质。例如,在一些实施方案中,可以使用质粒作为第一载体和所述第二载体。例如,可以使用其中插入有udg编码基因从而能够在合适的宿主细胞中表达udg蛋白的pet21a质粒或phue质粒作为第一载体。又例如,可以使用其中插入有分子伴侣素系统groel-groes编码基因从而能够在合适的宿主细胞中表达该分子伴侣素系统的pbad33质粒作为第二载体。以上仅为示例,本领域技术人员能够理解,任何经改造后能够表达分子伴侣素系统groel-groes或udg的载体均可以在本发明中使用。例如,所述载体还可以为pet20b、pet-22b、pet-28a、或pet-32a等质粒。
[0049]
另外,为了可以方便地对采用该双载体系统获得的udg蛋白进行纯化,在一些具体实施方案中,所述第一载体还可以表达亲和标签,例如his标签、flag标签、hat标签、hpc标签、mbp标签、nusa标签、ub标签、或gst标签等。在一个优选实施方案中,所述亲和标签为6
×
his标签。
[0050]
在第三方面,本发明提供了一种表达细胞,所述表达细胞包含本发明第二方面的双载体系统。
[0051]
在本发明中,所述表达细胞可以为原核细胞,例如细菌细胞,如大肠杆菌。但是,本领域技术人员可以理解,任何其他可以用于通过本发明方法来表达udg蛋白的细胞均可以用于本发明中。
[0052]
在第四方面,本发明提供了一种试剂盒,所述试剂盒包含:本发明第三方面的表达细胞、以及用于指导如何利用该试剂盒来生产尿嘧啶糖基化酶(udg)的说明书。
[0053]
综上所述,本发明提供了一种生产尿嘧啶糖基化酶(udg)的方法,该方法可以显著提高了udg的溶解性,从而增加udg的表达量和产量。
[0054]
下面结合实施例对本发明进行更为具体和详细的描述。下述实施例中的试验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规化试剂商店购买所得。应注意,上文的发明内容部分以及下文的详细描述仅为具体阐释本发明之目的,无意于以任何方式对本发明进行限制。
[0055]
实施例
[0056]
1.udg的进化分析和基因设计
[0057]
发明人通过综合分析不同公司udg/ung产品,发现目前的udg主要来自大肠杆菌
(e.coli)和嗜冷菌(psychrophilic bacterium)bmtu3346(南极热敏udg)。目前数据库中没有bmtu3346 udg的序列信息,依据文献提供的蛋白序列(jaeger et al.,2000),在ncbi和uniprot中blast得到了98%同源性的蛋白是微球菌土曲霉(micrococcus terreus)udg,因此该蛋白的信息存在疑问。由于嗜冷菌中的热敏型udg在控制pcr残留污染具有明显优势,因此基于ncbi数据库,搜索嗜冷菌udg,获得了12种可能的热敏型udg。以嗜冷菌udg与常用的udg为对象构建进化树,主要分支有3类,参见图1。分支2包含人类udg(18)和大肠杆菌udg(17)以及前期合成的假交替单胞菌属udg(9),初步推测该分支主要缺陷是高温无法彻底灭活,实际运用容易影响后续扩增产物的产量。分支1基本全是嗜冷菌中udg,而且其中包含了已报道的hj147-udg和hj171-udg,因此该分支成为了开发的重点。利用brenda数据库中udg稳定性数据,最终发明人挑选出了4种热稳定性小于50℃的udg酶,依次为嗜冷菌(psychrobacter sp.)hj147 udg(hj147-udg)、芽孢杆菌(bacillus sp.)hj171 udg(hj171-udg)、光合细菌(photobacterium aplysiae)gmd509udg(pap-udg)和大西洋鳕鱼(gadus morhus)(cod-udg)。
[0058]
2.udg序列分析和质粒的构建
[0059]
由于缺乏热敏udg蛋白的三维结构信息,发明人选用了两种表达载体pet21a和phue进行构建,分别产生羧基端融合6
×
his tag的udg和氨基端融合6
×
his tag+泛素udg蛋白。
[0060]
利用ncbi和uniprot数据库,获得了不同udg蛋白序列。将氨基酸序列导入到protparam(https://web.expasy.org/protparam/)在线工具,获得不同udg蛋白的氨基酸数目、分子量、等电点、消光系数等,参见下表1。
[0061]
表1.udg序列分析
[0062][0063]
此外,发明人选用了pbad33质粒表达groel-groes蛋白。通过对比分析质粒靶蛋白的核酸序列所含的限制性内切酶切割位点与对应表达质粒的多克隆位点,确定用于基因克隆的限制性酶切位点。groel-groes的表达质粒共用一个启动子和终止子,在构建时需要在groel和groes蛋白其中一个蛋白上另外添加核糖体结合位点序列(ribosome bind site,rbs)。最后,将质粒信息和基因信息提交给南京擎科基因合成部,以完成所有udg和pbad33基因表达质粒的构建。
[0064]
3.双质粒表达系统的构建
[0065]
为了在大肠杆菌表达菌株bl21(de3)中构建udg蛋白与分子伴侣素系统groel-groes的双质粒表达系统,需先通过热激法用第一质粒转化大肠杆菌bl21菌株,随后再通过电转法用第二质粒转化其中转化有第一杆菌的该大肠杆菌bl21菌株。
[0066]
3.1热激感受态bl21细胞的制备
[0067]
1.在无抗平板划线来活化保存于-80℃冰箱的原始菌种,将菌株于37℃培养过夜。
[0068]
2.次日挑取单克隆的bl21细胞,接种到含有50ml lb液体培养基的试管中,并以200rpm于37℃培养8-12小时。按照1:50-1:100的稀释比,将细胞转接到1l的lb液体培养基中,并以200rpm于37℃培养,直至od600约为0.3-0.4。
[0069]
3.将菌体在冰上放置15分钟至30分钟,使其冷却,然后以2500rpm于4℃离心15分钟,弃掉上清,并用800ml预先冷却的0.1m cacl2充分重悬菌体,随后将菌体在冰上放置15分钟。
[0070]
4.以2500rpm于4℃离心15分钟,弃掉上清,并用500ml预先冷却的0.1m cacl2充分重悬菌体,随后将菌体在冰上放置15分钟。
[0071]
5.加入40ml已预冷的0.1m cacl2溶液(含15%甘油),缓慢地重悬菌体,将菌体在冰上放置15分钟。随后将菌体以50μl/管至100μl/管分装于1.5ml离心管中,液氮速冻,立即存放在-80℃冰箱或者直接用于后续的转化实验。
[0072]
3.2热激转化
[0073]
1.先将感受态bl21细胞置于冰上融化,随后加入1μl第一质粒即udg-pet21a质粒或10μl连接产物,于冰上孵育30分钟。
[0074]
2.于42℃水浴锅中热激90s,立即放置于冰上2分钟。
[0075]
3.在超净台中,加入800μl无抗的lb培养基,并以200rpm于37℃培养40分钟至60分钟。
[0076]
4.低速离心菌体,然后在超净台中倒掉部分上清液,用剩余上清液重悬菌体。
[0077]
5.吸取菌体,用无菌枪头均匀的涂抹到含有抗性的lb平板上,于37℃恒温箱中过夜培养,由此得到转化有第一质粒的大肠杆菌bl21细胞。
[0078]
3.3电转感受态细胞的制备
[0079]
1.挑取热激转化后的单克隆的bl21细胞,接种到5ml液体培养基中,于37℃、200rpm培养8小时至12小时。
[0080]
2.按照1:50-1:100的稀释比,将细胞转接到5ml lb液体培养基中,并以200rpm于37℃培养,直至od600约为0.3-0.4。
[0081]
3.将试管在冰上放置30分钟,使其冷却。用2ml离心管分装菌液,并于4℃以1500g离心10分钟,收集菌体,每只离心管的菌体积为2ml至4ml。
[0082]
4.在超净台中,缓慢地弃掉上清,用1ml预冷的无菌ddh2o重悬菌体,上下颠倒数次,充分混匀。
[0083]
5.于4℃以1500g离心10分钟,然后在超净台中弃掉上清,并用800μl预冷的无菌ddh2o重悬菌体,上下颠倒数次,充分混匀。
[0084]
6.于4℃以1500g离心10分钟,然后在超净台中弃掉上清,并用1ml预冷的无菌10%甘油重悬菌体,上下颠倒数次,充分混匀。
[0085]
7.于4℃以1500g离心10分钟,然后在超净台中弃掉上清,并用800μl预冷的无菌10%甘油重悬菌体,上下颠倒数次,充分混匀。
[0086]
8.于4℃以1500g离心10分钟,然后在超净台中弃掉上清,并加入100μl预冷的无菌10%甘油重悬菌体,液氮速冻,存放在-80℃冰箱或者直接用于后续的转化实验。
[0087]
3.4电转感受态细胞的电击转化
[0088]
1.从-80℃冰箱中取出bl21电转感受态细胞,加入1μl-2μl的第二质粒即groel-groes-pbad33质粒,冰上放置30分钟。
[0089]
2.将感受态细胞和质粒的混合物转移到预冷的0.2cm的电转杯,在冰上孵育5分钟。
[0090]
3.随后使用bio-rad micropulser
tm
电转仪,选择程序ec2(2.5kv,脉冲1)以进行电击转化。
[0091]
4.在超净台中,将电转后的菌液转移到1ml离心管中,并快速加入800μl无抗lb液体培养基。
[0092]
5.以200rpm于37℃震荡培养1小时。
[0093]
6.取100μl至200μl菌液涂布于含抗生素的lb平板,并于37℃恒温箱中过夜培养。
[0094]
对于多质粒表达系统,抗生素的抗性可以随质粒数目的增加而相对应地增加。
[0095]
4.udg的诱导表达和检测
[0096]
4.1单质粒系统中对蛋白的诱导表达和检测
[0097]
1.在超净工作台中,将从-80℃冰箱中取出的udg表达菌株划线至含有相应抗生素抗性的lb固体培养基上,于37℃过夜培养。
[0098]
2.挑取单菌落接种到5ml已加入抗生素的lb液体培养基中,并于37℃以200rpm振荡培养8小时至10小时。
[0099]
3.按照1:50至1:100的稀释比稀释菌液,将稀释后的菌液转移到8只含有5ml lb液体培养基的试管中,并以200rpm于37℃培养,直至od
600
约为0.6至0.8。
[0100]
4.将8只试管分为2组,从每只试管取出1ml菌液,每组选择1ml菌液存放4℃冰箱。
[0101]
5.将诱导剂设置为不同浓度的梯度(以iptg为例,终浓度为0.1mm、0.2mm、0.5mm、1.0mm),每组4只试管,分别对应加入不同浓度的诱导剂。
[0102]
6.第一组放置在37℃以200rpm诱导培养4小时;第二组放置在16℃以200rpm诱导培养16小时至20小时。
[0103]
7.诱导结束后,从每只试管取出1ml菌液,以13000rpm离心10分钟,收集菌体。
[0104]
8.将诱导前的2份样品加入150μl的超声缓冲液(50mm tris-hcl ph 7.5,25mm nacl),并将诱导后的8份样品加入400μl的相同缓冲液中。
[0105]
9.利用批量超声仪biosafer 2100f进行小量超声,小量超声程序为:30%强度,持续超声10分钟。
[0106]
10.从每份样品中取出40μl菌液。
[0107]
11.于4℃以13000rpm对诱导后的超声样品离心10分钟。
[0108]
12.从每份样品中取出40μl上清液。
[0109]
13.最后利用sds-page检测udg,比较诱导前和诱导后的全细胞和上清中udg蛋白的表达情况,以确认各蛋白最合适的诱导条件。
[0110]
4.2双质粒系统中对蛋白的诱导表达和检测
[0111]
a.分步诱导
[0112]
1.从-80℃冰箱中取出已成功转入两种质粒的bl21菌株,在lb平板(氨苄青霉素(amp)、氯霉素(chl))上划线,于37℃恒温箱中过夜培养。
[0113]
2.挑取单菌落接种到5ml已加抗生素的lb液体培养基中,于37℃以200rpm振荡培养8小时至10小时。
[0114]
3.按照1:50至1:100的稀释比对菌液进行稀释,并将稀释后的菌液转接到多只5ml已加抗生素的lb液体培养基中,并以200rpm于37℃培养,直至od
600
约为0.2至0.4。
[0115]
4.取出1ml菌液作为阴性对照(诱导前),然后加入0.4%阿拉伯糖,并于25℃诱导3小时。
[0116]
5.然后于4℃以1500g离心15分钟,收集菌体。
[0117]
6.在超净台中弃掉上清,加入4ml新鲜lb培养基(抗性为amp、chl),随后再加入0.4%阿拉伯糖和不同浓度梯度的iptg(0.1mm、0.2mm、0.5mm、1mm),并于16℃诱导16小时至20小时。
[0118]
7.诱导结束后,从每只试管取出1ml菌液,以13000rpm离心10分钟,收集菌体。
[0119]
8.按照重组蛋白小量表达过程超声和取样,获得样品。最后利用sds-page检测udg,比较诱导前和诱导后的全细胞和上清中udg的量,以确认udg的溶解性。
[0120]
b.同时诱导
[0121]
1.从-80℃冰箱中取出已成功转入两种质粒的bl21菌株,在lb平板(amp、chl)划线,于37℃恒温箱中过夜培养。
[0122]
2.挑取单菌落接种到5ml已加抗生素的lb液体培养基中,37℃以200rpm振荡培养8小时至10小时。
[0123]
3.按照1:50至1:100的稀释比对菌液进行稀释,并将稀释后的菌液转接到多只5ml已加抗生素的lb液体培养基中,并以200rpm于37℃培养,直至od
600
约为0.6至0.8。
[0124]
4.取出1ml菌液作为阴性对照(诱导前),然后加入0.4%阿拉伯糖和不同浓度梯度的iptg(0.1mm、0.2mm、0.5mm、1mm),并于16℃诱导16小时至20小时。
[0125]
7.诱导结束后,从每只试管取出1ml菌液,以13000rpm离心10分钟,收集菌体。
[0126]
8.按照重组蛋白小量表达过程超声和取样,获得样品。最后利用sds-page检测udg,比较诱导前和诱导后的全细胞和上清中udg的量,以确认udg的溶解性。
[0127]
5.udg的纯化
[0128]
为了获得高纯度的udg,还可以通过亲和层析进一步纯化经表达的上述udg。另外,因为该udg为热敏型udg,为了保持其活性,整个纯化过程需要在4℃至10℃下进行。
[0129]
5.1纯化前处理——细胞破碎
[0130]
1.用50ml离心管分装诱导后的菌体,每管菌体体积为0.5l至1l。
[0131]
2.利用裂解缓冲液(含终浓度为2%的全能核酸酶)重悬菌体,每升菌体加入40ml的该裂解缓冲液。
[0132]
3.利用超声仪进行大量超声,大量超声程序为:强度为30%,超声时间为4秒,停留时间为10秒,总超声时间为20分钟。
[0133]
4.利用台式离心机5810r(eppendorf)于4℃以10000rpm离心40分钟。
[0134]
5.转移上清液到预冷的烧杯中,用0.2μm滤膜过滤样品,得到上清液。
[0135]
5.2亲和层析
[0136]
1.将亲和层析柱连接到hplc系统英赛斯autopure100上,并根据层析柱填料的类型和使用说明书设置限压(histrap hp 5ml:0.3mpa;hiscap 6ff 5ml:0.3mpa)和流速。
[0137]
2.使用3-5倍柱体积的ddh2o冲洗层析柱。
[0138]
3.使用5-10倍柱体积的洗涤缓冲液平衡层析柱,平衡好以后unique cdsystem软件显示的蛋白紫外吸收峰uv
280
位于基线。
[0139]
4.使用a泵直接上样,直至所有样品全部进入层析柱。
[0140]
5.利用unique cdsystem软件设置洗脱程序。所述程序的第一部分是使用10-15倍柱体积(50ml至75ml)洗涤缓冲液充分洗涤,直至uv
280
重回基线,该过程可以去除非特异性结合或者结合能力较弱的杂蛋白。第二部分是线性梯度洗脱程序(洗脱缓冲液:0%至100%,洗涤缓冲液:100%至0%),初次实验线性梯度洗脱体积为20倍柱体积,该过程能够洗脱所有的udg并且能高效地分离与ni
2+
亲和力不同的蛋白质。
[0141]
6.分析和记录蛋白uv
280
吸收峰的位置,对应地从收集器中取出样品。
[0142]
7.利用sds-page检测,确定udg的位置和纯度。
[0143]
8.收集和合并udg,使用透析洗脱液-i于4℃至10℃过夜透析。
[0144]
9.依次使用50ml 0.5m咪唑和50ml ddh2o清洗层析柱,最后用20%乙醇填充层析柱。
[0145]
以上各步骤中使用到的缓冲液见表3。
[0146]
表2.用于亲和层析的缓冲体系
[0147]
裂解/洗涤缓冲液1000ml20mm tris-hcl 8.020ml 1m tris-hcl 8.025mm nacl5ml 5m nacl1mm dtt1ml 1m dtt10%甘油100ml甘油10mm咪唑8.05ml 2m咪唑8.0洗脱缓冲液1000ml20mm tris-hcl 8.020ml 1m tris-hcl 8.025mm nacl5ml 5m nacl1mm dtt1ml 1m dtt10%甘油100ml甘油250mm咪唑8.0125ml 2m咪唑8.0透析洗脱液
‑ⅰ
4000ml20mm tris-hcl 8.080ml 1m tris-hcl 8.025mm nacl20ml 5m nacl10%甘油400ml甘油
[0148]
6.结果
[0149]
6.1单质粒系统中udg表达的检测结果
[0150]
发明人首先研究了在37℃、0.5mm iptg、220rpm的诱导条件下诱导培养3-4小时后的udg表达和溶解结果,sds-page的检测结果如图2所示,其中全细胞是指经过诱导后的细胞裂解液,上清是全细胞离心后的可溶部分。通过全细胞可以判断有无靶蛋白表达,通过对比全细胞和上清则可以确定靶蛋白的溶解性。sds-page的检测结果显示所有的udg(u1-u8)都表现出显著的蛋白诱导表达,但可溶性udg的含量很低,仅占总诱导蛋白的5%-10%。
[0151]
随后,发明人通过调整诱导条件发现在较低的温度和诱导剂浓度的诱导条件下(即温度为20℃或16℃,iptg浓度为0.2mm或0.1mm),所有udg蛋白的溶解性有所改善(均提高到10%以上),其中u3和u4的溶解性提高到了30%至40%(图3和表3)。
[0152]
表3.在16℃和0.1mm诱导剂浓度下udg蛋白的溶解性
[0153][0154]
6.2双质粒系统中udg表达的检测结果
[0155]
考虑到生物体内绝大部分蛋白无法通过自发展折叠形成正确的三维结构,为了进一步提高udg蛋白的溶解性,发明人通过双质粒系统引入了分子伴侣素系统groel-groes来协助和提升蛋白的折叠效率,从而改善靶蛋白的溶解性。在探究双质粒系统的诱导表达时,发明人采取了两种诱导方式:同时诱导和分步诱导。
[0156]
同时诱导
[0157]
同时诱导是指在同一时间加入groel-groes和udg的诱导剂进行蛋白的诱导表达。但sds-page的检测结果显示,同时诱导并未显著改善udg蛋白的溶解性(图4)。
[0158]
分步诱导
[0159]
分步诱导是指先诱导分子伴侣素groel-groes,保证分子伴侣素积累到一定蛋白浓度后,再进行靶蛋白udg蛋白的诱导。sds-page的检测结果显示,采用分步诱导时,u3和u4的溶解性得到了显著改善,提升到完全可溶的水平(图4),但其他udg蛋白的表达并没有显著变化(未示出)。
[0160]
为了更加清晰阐明u3和u4溶解性的变化,发明人对比了u3在包含单质粒系统的大肠杆菌表达的结果以及包含双质粒系统的大肠杆菌在同时和分步诱导情况下表达的结果,其中每组的后缀1和2分别代表不同单菌落(图5)。从图5所示的结果可以看出,在相同的诱导条件下(即诱导相同温度、相同诱导时间、相同浓度的诱导剂),与包含单质粒系统(仅包含u3表达基因)的大肠杆菌相比,同时诱导包含双质粒系统的大肠杆菌表达分子伴侣素系统groel-groes和udg,并不能显著的提升u3的溶解性。事实上,根据sds-page图可以判断这两种生产方法中u3的溶解性相似,均为30%至40%(图5)。然而,对包含双质粒系统的大肠杆菌采取分步诱导方法,先诱导分子伴侣素系统groel-groes表达一段时间后,再诱导u3表达,可以显著提高u3的溶解性,使u3变为完全可溶的状态,从而大大提高u3的产量。
[0161]
6.3经亲和层析纯化后的udg含量检测结果
[0162]
对于相同体积的发酵液,采取同时诱导和分步诱导的包含双质粒系统的大肠杆菌所表达的u3在经过相同的亲和层析纯化后,分步诱导组的u3产量(梯度洗脱部分代表udg蛋
白的总量)显著高于同时诱导组的u3产量(图6)。具体地,根据紫外分光光度计uv
280
检测显示,同时诱导组的u3产量是45mg,而分步诱导组的u3产量为97mg。
[0163]
序列信息:
[0164]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1