一种喹唑啉含氮杂环衍生物及制备方法和用途
1.本发明属于药物化学合成技术领域,具体涉及一种喹唑啉含氮杂环衍生物,还涉及该喹唑啉含氮杂环衍生物的制备方法和用途。
背景技术:
2.糖尿病已经成为影响我国居民健康的重大公共卫生问题。截止2019年,全球有4.63亿成年人(占全球总人数1/11)患有糖尿病;到2030年,糖尿病患者预计达到5.78亿。我国糖尿病人口已成为全球之最,2019年国内糖尿病患者约为1.16亿,预计这个数字在2040年达到1.5亿。糖尿病诱发的冠心病、脑卒中等疾病,以及糖尿病足、糖尿病视网膜病变、糖尿病肾病等并发症是我国居民致残、致死的重要原因,给个人、家庭和社会带来沉重的负担。
3.糖尿病的特征主要包括高血糖,功能性胰岛β细胞数量的丢失,降糖激素胰岛素的缺乏以及α细胞持续分泌升糖激素胰高血糖素。尽管糖尿病的流行越来越严重,相关的分子机制仍不清;目前针对糖尿病的治疗药物主要包括胰岛素极其类似物、glp-1受体激动剂、双胍类、α-糖苷酶抑制剂、格列奈类、dpp-4抑制剂等,它们局限于针对糖尿病的表型去缓减症状,并不能有效的阻止糖尿病的发病进程。寻找针对糖尿病的新颖治疗靶点开发抗糖尿病药物具有重要意义。
4.糖尿病的发生与氧化应激密切相关。有研究指出:小鼠胰腺中的抗氧化酶(超氧化物歧化酶、过氧化酶和谷胱甘肽过氧化物酶)的含量明显低于其组织的,由于胰岛β细胞的基本抗氧化酶的低表达,对氧化应激更为敏感,天然的低防御潜力变得明显。糖尿病患者中,胰岛氧化还原稳态失衡,大量活性氧簇(ros)的堆积爆发氧化应激,这种状态与硫氧还蛋白互作蛋白(thioredoxin-interacting protein,txnip)的过表达密切相关。
5.硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,txnip)是一种内源性的细胞氧化还原调节剂,含有391个氨基酸,编码在人类1号染色体和小鼠3号染色体上。txnip首次从1,25-二羟基维生素d3处理的hl-60人早幼粒细胞细胞系中分离得到,最早又被称为维生素d3上调蛋白1(vitamin d3 up-regulated protein 1,vdup-1)。糖尿病小鼠的高血糖会促使txnip表达上升,引发功能性trx含量下降,最终爆发氧化应激。txnip是胰岛β细胞中葡萄糖稳态的主要调节剂。2002年,shalev等人发现,在6000多个人胰岛基因中,txnip是葡萄糖诱导的反应基因中上调表达最高的,上调约11倍。实验表明,txnip是葡萄糖毒性和胰岛β细胞丢失之间的关键纽带,txnip可能在2型糖尿病中发挥重要作用。
技术实现要素:
6.本发明的目的在于提供一种喹唑啉含氮杂环衍生物,用于治疗糖尿病。
7.本发明的第二目的在于提供一种喹唑啉含氮杂环衍生物的制备方法。
8.本发明的第三目的在于提供一种喹唑啉含氮杂环衍生物在制备糖尿病药物的用途。
9.本发明的第四目的在于提供一种治疗糖尿病的药物,包括喹唑啉含氮杂环衍生物或其与酸合成药学上可接受的盐、水合物。
10.本发明所采用的技术方案是,一种喹唑啉含氮杂环衍生物,其结构通式如式(i)所示:
[0011][0012]
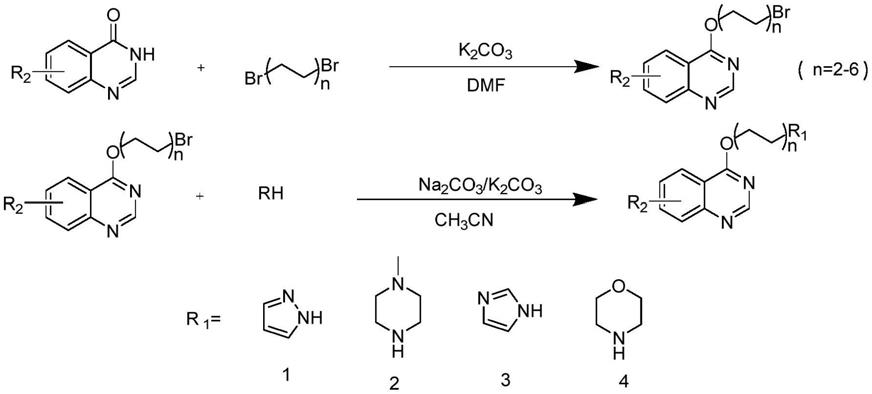
其中:n为1~5,r1为吡咯环、四氢吡咯烷环、甲基哌嗪、吗啡啉、吡唑或咪唑环中的任意一种;r2为结构中5、6、7、8位取代的甲基、三氟甲基或卤素;
[0013]
本发明的特点还在于,
[0014]
优选的,喹唑啉含氮杂环衍生物为4-(2-(1h-吡唑-1-基)乙氧基)喹唑啉、4-(2-(4-甲基哌嗪-1-基)乙氧基)喹唑啉、4-(2-(1h-咪唑-1-基)乙氧基)喹唑啉、4-(2-(喹唑啉-4-基氧基)乙基)吗啉、4-(3-(1h-吡唑-1-基)丙氧基)喹唑啉、4-(3-(4-甲基哌嗪-1-基)丙氧基)喹唑啉、4-(3-(1h-咪唑-1-基)丙氧基)喹唑啉、4-(3-(喹唑啉-4-基氧基)丙基)吗啉、4-(4-(1h-吡唑-1-基)丁氧基)喹唑啉、4-(4-(4-甲基哌嗪-1-基)丁氧基)喹唑啉、4-(4-(1h-咪唑-1-基)丁氧基)喹唑啉、4-(4-(喹唑啉-4-基氧基)丁基)吗啉、4-((5-(1h-吡唑-1-基)戊基)氧基)喹唑啉、4-((5-(4-甲基哌嗪-1-基)戊基)氧基)喹唑啉、4-((5-(1h-咪唑-1-基)戊基)氧基)喹唑啉、4-(5-(喹唑啉-4-基氧基)戊基)吗啉、4-((6-(1h-吡唑-1-基)己基)氧基)喹唑啉、4-(((6-(4-甲基哌嗪-1-基)己基)氧基)喹唑啉、4-((6-(1h-咪唑-1-基)己基)氧基)喹唑啉、4-(6-(喹唑啉-4-基氧基)己基)吗啉中的任意一种;
[0015]
最优选的,喹唑啉含氮杂环衍生物为4-(2-(1h-吡唑-1-基)乙氧基)喹唑啉、4-(2-(4-甲基哌嗪-1-基)乙氧基)喹唑啉、4-(3-(1h-吡唑-1-基)丙氧基)喹唑啉、4-(3-(4-甲基哌嗪-1-基)丙氧基)喹唑啉、4-(4-(1h-吡唑-1-基)丁氧基)喹唑啉、4-(4-(4-甲基哌嗪-1-基)丁氧基)喹唑啉、4-(4-(喹唑啉-4-基氧基)丁基)吗啉、4-(4-(1h-咪唑-1-基)丁氧基)喹唑啉、4-((5-(1h-吡唑-1-基)戊基)氧基)喹唑啉、4-((5-(4-甲基哌嗪-1-基)戊基)氧基)喹唑啉、4-((5-(1h-咪唑-1-基)戊基)氧基)喹唑啉、4-(5-(喹唑啉-4-基氧基)戊基)吗啉、4-(6-(喹唑啉-4-基氧基)己基)吗啉中的任意一种。
[0016]
本发明的有益效果是,以4-羟基喹唑啉为原料,通过不同长度的碳链,引入甲基哌嗪、吗啡啉、咪唑、吡唑四种含氮杂环,合成了二十种喹唑啉含氮杂环衍生物;通过两步反应合成喹唑啉含氮杂环衍生物,反应条件温和,容易重复,且产率高。并且研究了喹唑啉含氮杂环衍生物的胰岛细胞保护活性,是潜在治疗糖尿病的新化学实体。对于抗糖尿病药物的研究与开发具有重要意义。
具体实施方式
[0017]
下面结合具体实施方式对本发明进行详细说明。
[0018]
本发明一种喹唑啉含氮杂环衍生物的制备方法,具体按照以下步骤实施:
[0019]
步骤1,将溴代烃、催化剂k2co3于茄形瓶中,加入dmf,置于磁力搅拌器中搅拌,形成混合液;再将4-羟基喹唑啉溶解于dmf中,在室温下缓慢滴加至混合液中进行反应,即可得到中间体;
[0020]
溴代烃为1,2-二溴乙烷、1,3-二溴丙烷、1,4-二溴丁烷、1,5-二溴戊烷中的任意一种;
[0021]
步骤2,将中间体和氮杂环化合物溶解于乙腈中,加入催化剂k2co3,于80℃的条件下进行反应,反应期间不断用gf254硅胶板进行监测,待反应物反应完全后,加入水和乙酸乙酯进行萃取,将有机层用无水na2so4干燥,减压浓缩,即可得到喹唑啉含氮杂环衍生物;
[0022]
氮杂环化合物为吡咯环、四氢吡咯烷环、甲基哌嗪、吗啡啉、吡唑或咪唑环中的任意一种。
[0023]
本发明的喹唑啉含氮杂环衍生物的制备过程:第一次消去反应是4-羟基喹唑啉在碱性环境下脱去h-3,发生互变异构,生成氧负离子。c-br的电子云偏向溴原子,使得α-c具有一定的电正性。由于溴原子是较好的离去基团,在氧负离子的进攻下脱去溴原子形成c-o键。第二次消去反应是氮杂环中n-h键具有一定的酸性。在碱性环境下n-h键断裂,n原子具有电负性。n原子进攻c-br键,使得溴原子离去,生成新的c-n键。
[0024]
合成路线如下:
[0025][0026]
其中:n为1~5,r1为吡咯环、四氢吡咯烷环、甲基哌嗪、吗啡啉、吡唑或咪唑环等含氮杂环;r2为结构中5、6、7、8位取代的甲基、三氟甲基、卤素等。
[0027]
对合成喹唑啉含氮杂环衍生物进行体外小鼠胰岛β细胞有保护作用研究,化合物作用的细胞存活率均优于或相当于棕榈酸损伤模型组,是一种理想的保护胰岛细胞化学实体,对治疗糖尿病有重要意义。
[0028]
实施例1中间体的制备
[0029]
a、4-(2-溴乙氧基)喹唑啉(a),结构式如下:
[0030][0031]
先量取1,2-二溴乙烷(2.101ml,24.63mmol)和催化剂k2co3(4.17g,30.17mmol)于茄形瓶中,加入约30ml的dmf,置于磁力搅拌器中搅拌。再将4-羟基喹唑啉(3.00g,20.12mmol)溶解于10ml dmf中,在室温下缓慢滴加。待4-羟基喹唑啉的dmf溶液滴加完成后约0.5h,反应完全。溶液用水50ml洗三次后,用无水na2so4将有机层干燥,减压浓缩,得到反应产物。取少量反应产物用甲醇溶解,采用薄层色谱(石油醚:丙酮=2:1)在紫外灯下检测,反应产物有两个rf值差别较大的暗斑,即有两个反应产物。柱色谱分离产物(石油醚:丙酮=7:1),浓缩得到白色晶体a 2.00g,产率为38.5%。经鉴定为4-(2-溴乙氧基)喹唑啉。
[0032]
其中,产物表征如下:
[0033]
mp 99-100℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.2hz,8.0hz,h-8),8.10(1h,s,h-2),7.79(1h,td,j=1.4hz,7.5hz,h-6),7.74(1h,d,j=7.2hz,h-5),7.53(1h,dt,j=1.2hz,7.5hz,h-7),4.39(2h,t,j=5.8hz,och
2-),3.78(2h,t,j=5.8hz,ch2br);esi-ms m/z:252.9[m+h]
+
。
[0034]
b、4-(3-溴丙氧基)喹唑啉(b),化合物b的结构式如下:
[0035][0036]
方法同a,量取1,3-二溴丙烷(3.414ml,32.85mmol)、催化剂k2co3(5.674g,41.05mmol)于茄形瓶中,加入约30ml的dmf,置于磁力搅拌器中搅拌;再将4-羟基喹唑啉(4.00g,26.82mmol)溶解于10ml dmf中,在室温下缓慢滴加。待4-羟基喹唑啉的dmf溶液滴加完成后约0.5h,反应完全。得到白色晶体b1.56g,产率为21.4%,经鉴定为4-(3-溴丙氧基)喹唑啉。
[0037]
mp 115-116℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.0hz,8.0hz,h-8),8.11(1h,s,h-2),7.78(1h,td,j=1.5hz,7.5hz,h-6),7.72(1h,dd,j=0.8hz,8.1hz,h-5),7.52(1h,td,j=2.1hz,7.5hz,h-7),4.19(2h,t,j=6.7hz,och
2-),3.45(2h,t,j=6.1hz,ch2br),2.40(2h,m,-ch
2-);esi-ms m/z:266.9[m+h]
+
。
[0038]
c、4-(4-溴丁氧基)喹唑啉(c),化合物c的结构式如下:
[0039][0040]
方法同上a,量取4-羟基喹唑啉(2.00g,13.41mmol)、催化剂k2co3(2.78g,
20.11mmol)于茄形瓶中,加入约30ml的dmf,置于磁力搅拌器中搅拌;再将1,4-二溴丁烷(1.655ml,13.41mmol)溶解于10ml dmf中,在室温下缓慢滴加。待4-羟基喹唑啉的dmf溶液滴加完成后约0.5h,反应完全。得到白色晶体c1.31g,率为35.5%,经鉴定为4-(4-溴丁氧基)喹唑啉。
[0041]
mp 75-77℃;1h-nmr(400mhz,cdcl3)δ8.32(1h,dd,j=1.2hz,8.0hz,h-8),8.04(1h,s,h-2),7.77(1h,td,j=1.4hz,7.5hz,h-6),7.72(1h,d,j=7.3hz,h-5),7.52(1h,td,j=1.3hz,7.6hz,h-7),4.05(2h,t,j=6.8hz,och
2-),3.45(2h,t,j=6.3hz,ch2br),1.97(4h,t,j=3.6hz,-ch2ch
2-);esi-ms m/z:281.0[m+h]
+
。
[0042]
d、4-((5-溴戊基)氧基)喹唑啉(d),化合物d的结构式如下:
[0043][0044]
方法同上a,量取1,5-二溴戊烷(2.237ml,16.09mmol)、催化剂k2co3(2.78g,20.11mmol)于茄形瓶中,加入约30ml的dmf,置于磁力搅拌器中搅拌;再将4-羟基喹唑啉(2.00g,13.41mmol)溶解于10ml dmf中,在室温下缓慢滴加。待4-羟基喹唑啉的dmf溶液滴加完成后约0.5h,反应完全。得到白色晶体d 2.06g,产率为52.0%,经鉴定为4-((5-溴戊基)氧基)喹唑啉。
[0045]
mp 55-56℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.1hz,8.0hz,h-8),8.04(1h,s,h-2),7.77(1h,td,j=1.4hz,7.5hz,h-6),7.71(1h,d,j=7.3hz,h-5),7.52(1h,td,j=1.2hz,7.5hz,h-7),4.05(2h,t,j=6.8hz,och
2-),3.45(2h,t,j=6.3hz,ch2br),1.89(6h,m,-ch2ch2ch
2-);esi-ms m/z:294.9[m+h]
+
。
[0046]
e、4-((6-溴己基)氧基)喹唑啉(e),化合物e的结构式如下:
[0047][0048]
方法同上a,量取1,6-二溴己烷(5.208ml,13.41mmol)、催化剂k2co3(2.78g,40.96mmol)于茄形瓶中,加入约30ml的dmf,置于磁力搅拌器中搅拌;再将4-羟基喹唑啉(4.00g,26.82mmol)溶解于10mldmf中,在室温下缓慢滴加。待4-羟基喹唑啉的dmf溶液滴加完成后约0.5h,反应完全。得到白色晶体e 4.13g,产率为48.8%,经鉴定为4-((6-溴己基)氧基)喹唑啉。
[0049]
mp 67-68℃;1h-nmr(400mhz,cdcl3)δ8.32(1h,dd,j=1.0hz,8.0hz,h-8),8.03(1h,s,h-2),7.76(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,dd,j=0.8hz,8.0hz,h-5),7.52(1h,td,j=1.3hz,7.4hz,h-7),4.01(2h,t,j=7.3hz,och
2-),3.40(2h,t,j=6.9hz,ch2br),1.85(4h,m,-ch2ch
2-),1.47(4h,m,-ch2ch
2-);esi-ms m/z:309.1[m+h]
+
。
[0050]
实施例2 4-(2-(1h-吡唑-1-基)乙氧基)喹唑啉(a-1)的制备,化合物a-1的结构式如下:
[0051][0052]
取中间体a(250mg,0.99mmol)和吡唑(80mg,1.16mmol)溶解于10ml乙腈中,加入催化剂k2co3(410mg,2.97mmol),于80℃反应。反应期间不断用gf
254
硅胶板进行监测,约40h后,反应物反应完全。加入水(30ml)和乙酸乙酯(3
×
30ml)进行萃取,将有机层用无水na2so4干燥,减压浓缩。得到白色晶体a-1 200mg,产率为84.3%,经鉴定为4-(2-(1h-吡唑-1-基)乙氧基)喹唑啉。
[0053]
mp 117-119℃;1h-nmr(400mhz,cdcl3)δ8.15(1h,d,j=7.6hz,h-8),8.08(1h,s,h-2),7.70(1h,t,j=7.6hz,h-6),7.60(1h,s,h-5),7.58(1h,d,j=5.2hz,pyrazole),7.42(1h,t,j=7.6hz,h-7),6.32(1h,s,pyrazol),4.14(2h,t,j=4.7hz,och
2-),3.40(2h,t,j=4.7hz,ch2n-);esi-ms m/z:242.1[m+h]
+
。
[0054]
实施例3 4-(2-(4-甲基哌嗪-1-基)乙氧基)喹唑啉(a-2)的制备
[0055]
化合物a-2的结构式如下:
[0056][0057]
方法同a-1,取中间体a(250mg,0.99mmol)、1-甲基哌嗪(134.0μl,1.18mmol)溶解于10ml乙腈中,加入催化剂na2co3(310mg,2.92mmol)。于80℃反应约8h反应完全。浓缩得到黄色油状液体a-2 220mg,产率为81.8%,经鉴定为4-(2-(4-甲基哌嗪-1-基)乙氧基)喹唑啉。
[0058]1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.0hz,8.0hz,h-8),8.07(1h,s,h-2),7.76(1h,td,j=1.4hz,7.5hz,h-6),7.71(1h,d,j=7.3hz,h-5),7.50(1h,td,j=1.3hz,7.4hz,h-7),4.09(2h,t,j=5.9hz,och
2-),2.72(2h,t,j=6.0hz,ch2n-),2.56(4h,s,nch2ch2n),2.44(4h,s,nch2ch2n),2.27(3h,s,-ch3);esi-ms m/z:273.1[m+h]
+
。
[0059]
实施例4 4-(2-(1h-咪唑-1-基)乙氧基)喹唑啉(a-3)的制备
[0060]
化合物a-3的结构式如下:
[0061]
[0062]
方法同a-1,取中间体a(230mg,0.91mmol)、咪唑(80mg,1.16mmol)溶解于10ml乙腈中,加入催化剂na2co3(310mg,2.92mmol)。80℃反应约40h反应完全。浓缩得到白色晶体a-3 110mg,产率为50.4%,经鉴定为4-(2-(1h-咪唑-1-基)乙氧基)喹唑啉。
[0063]
mp 140-141℃;1h-nmr(400mhz,cdcl3)δ8.32(1h,dd,j=1.3hz,8.0hz,h-8),7.79(1h,td,j=1.4hz,7.6hz,h-6),7.69(1h,d,j=8.1hz,h-5),7.55(1h,t,j=8.0hz,h-7),7.46(1h,s,h-8),7.39(1h,s,imidazol),7.09(1h,s,imidazol),6.87(1h,s,imidazol)4.42(2h,t,j=5.5hz,och
2-),4.3(2h,t,j=5.4hz,ch2n-);esi-ms m/z:241.1[m+h]
+
。
[0064]
实施例5 4-(2-(喹唑啉-4-基氧基)乙基)吗啉(a-4)的制备
[0065]
化合物a-4的结构式如下:
[0066][0067]
方法同a-1,取中间体a(250mg,0.99mmol)、吗啡啉(105.4μl,1.18mmol)溶解于10ml乙腈中,加入催化剂na2co3(310mg,2.92mmol)。80℃反应约40h反应完全。浓缩得到白色晶体a-4 220mg,产率为85.8%,经鉴定为4-(2-(喹唑啉-4-基氧基)乙基)吗啉。
[0068]
mp 74-76℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.3hz,8.0hz,h-8),8.07(1h,s,h-2),7.77(1h,td,j=1.4hz,7.5hz,h-6),7.71(1h,d,j=7.8hz,h-5),7.51(1h,td,j=1.2hz,7.4hz,h-7),4.10(2h,t,j=5.9hz,och
2-),3.68(4h,t,j=4.5hz,nch2ch
2-o)2.72(2h,t,j=6.0hz,ch2n-),2.52(4h,d,j=4.5hz,nch2ch2o);esi-ms m/z:260.1[m+h]
+
。
[0069]
实施例6 4-(3-(1h-吡唑-1-基)丙氧基)喹唑啉(b-1)的制备
[0070]
化合物b-1的结构式如下:
[0071][0072]
方法同a-1,取中间体b(220mg,0.82mmol)、吡唑(80mg,1.16mmol)溶解于10ml乙腈中,加入催化剂k2co3(390mg,2.82mmol)。80℃反应约35h反应完全。浓缩得到黄色油状液体a-2 190mg,产率为91.1%,经鉴定为4-(3-(1h-吡唑-1-基)丙氧基)喹唑啉。
[0073]1h-nmr(400mhz,cdcl3)δ8.31(1h,td,j=1.1hz,6.9hz,h-8),8.10(1h,d,j=8.1hz,h-2),7.78(1h,m,h-6),7.72(1h,t,j=5.3hz,h-5),7.63(1h,d,j=1.9hz,pyrazole),7.52(1h,td,j=1.3hz,7.4hz,h-7),6.27(1h,t,j=2.0hz,pyrazol),2.41(2h,m,och
2-),2.04(2h,m,ch2n-);esi-ms m/z:255.1[m+h]
+
。
[0074]
实施例7 4-(3-(4-甲基哌嗪-1-基)丙氧基)喹唑啉(b-2)的制备
[0075]
化合物b-2的结构式如下:
[0076][0077]
方法同a-1,取中间体b(250mg,0.93mmol)、1-甲基哌嗪(127.0μl,1.12mmol)溶解于10ml乙腈中,加入催化剂na2co3(300mg,2.83mmol)。80℃反应约8h反应完全。浓缩得到黄色油状液体b-2 170mg,产率为81.8%,经鉴定为4-(3-(4-甲基哌嗪-1-基)丙氧基)喹唑啉。
[0078]1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.0hz,8.0hz,h-8),8.14(1h,s,h-2),7.76(1h,td,j=1.5hz,7.6hz,h-6),7.71(1h,dd,j=0.8hz,8.1hz,h-5),7.51(1h,td,j=1.3hz,7.5hz,h-7),4.09(2h,t,j=6.6hz,och
2-),2.44(4h,s,nch2ch2n),2.38(2h,t,j=6.6hz,ch2n-),2.27(3h,s,-ch3),2.03(4h,m,nch2ch2n);esi-ms m/z:287.1[m+h]
+
。
[0079]
实施例8 4-(3-(1h-咪唑-1-基)丙氧基)喹唑啉(b-3)的制备
[0080]
化合物b-3的结构式如下:
[0081][0082]
方法同a-1,取中间体b(250mg,0.93mmol)、咪唑(80mg,1.16mmol)溶解于10ml乙腈中,加入催化剂na2co3(300mg,2.83mmol)。80℃反应约35h反应完全。浓缩得到黄色油状液体b-3 150mg,产率为63.1%,经鉴定为4-(3-(1h-咪唑-1-基)丙氧基)喹唑啉。
[0083]1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.4hz,7.4hz,h-8),7.95(1h,s,h-2),7.79(1h,td,j=1.5hz,7.6hz,h-6),7.72(1h,d,j=7.7hz,h-5),7.58(1h,s,imidazol)),7.54(1h,td,j=1.2hz,7.5hz,h-7),7.12(1h,s,imidazol),7.00(1h,s,imidazol)4.09(2h,t,j=7.0hz,och
2-),4.01(2h,t,j=7.2hz,ch2n-),2.05(1h,m,-ch
2-),2.26(1h,t,j=7.2hz,-ch
2-);esi-ms m/z:255.1[m+h]
+
。
[0084]
实施例9 4-(3-(喹唑啉-4-基氧基)丙基)吗啉(b-4)的制备
[0085]
化合物b-4的结构式如下:
[0086][0087]
方法同a-1,取中间体b(250mg,0.99mmol)、吗啡啉(100μl,1.12mmol)溶解于10ml乙腈中,加入催化剂na2co3(300mg,2.83mmol)。80℃反应约6h反应完全。浓缩得到黄色油状液体b-4 250mg,产率为98.1%,经鉴定为4-(3-(喹唑啉-4-基氧基)丙基)吗啉。
[0088]1h-nmr(400mhz,cdcl3)δ8.31(1h,d,j=8.0hz,h-8),8.13(1h,s,h-2),7.76(1h,td,j=2.1hz,6.9hz,h-6),7.70(1h,d,j=8.2hz,h-5),7.51(1h,t,j=7.7hz,h-7),4.10(2h,t,j=6.6hz,och
2-),3.67(4h,s,nch2ch2o),2.41(4h,d,j=2.4hz,nch2ch2o),2.39(2h,t,j=6.5hz,ch2n-);esi-ms m/z:274.1[m+h]
+
。
[0089]
实施例10 4-(4-(1h-吡唑-1-基)丁氧基)喹唑啉(c-1)
[0090]
化合物c-1的结构式如下:
[0091][0092]
方法同a-1,取中间体c(100mg,0.36mmol)、吡唑(60mg,0.87mmol)溶解于10ml乙腈中,加入催化剂k2co3(230mg,2.17mmol)。80℃反应约35h反应完全。浓缩得到白色晶体c-1 90mg,产率为82.9%,经鉴定为4-(4-(1h-吡唑-1-基)丁氧基)喹唑啉。
[0093]
mp 106-108℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,td,j=1.2hz,7.9hz,h-8),8.04(1h,s,h-2),7.77(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,dd,j=0.6hz,8.0hz,h-5),7.51(1h,t,j=1.3hz,7.4hz,h-7),6.27(1h,t,j=2.0hz,pyrazol),4.03(2h,t,j=7.3hz,och
2-),2.04(2h,m,ch2n-),1.25(4h,t,j=3.6hz,-ch2ch
2-);esi-ms m/z:269.1[m+h]
+
。
[0094]
实施例11 4-(4-(4-甲基哌嗪-1-基)丁氧基)喹唑啉(c-2)的制备
[0095]
化合物c-2的结构式如下:
[0096][0097]
方法同a-1,取中间体c(30mg,0.11mmol)、1-甲基哌嗪(13.0μl,0.12mmol)溶解于10ml乙腈中,加入催化剂k2co3(0.044mg,0.32mmol)。80℃反应约8h反应完全。浓缩得到黄色油状液体c-2 10mg,产率为31.1%,经鉴定为4-(4-(4-甲基哌嗪-1-基)丁氧基)喹唑啉。
[0098]1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.0hz,7.9hz,h-8),8.04(1h,s,h-2),7.76(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,dd,j=0.8hz,7.6hz,h-5),7.51(1h,td,j=1.3hz,7.4hz,h-7),4.03(2h,t,j=7.3hz,och
2-),2.45(4h,s,nch2ch2n),2.39(2h,t,j=7.4hz,ch2n-),2.28(3h,s,-ch3),1.83(2h,m,-ch2ch
2-),1.58(2h,m,-ch
2-ch
2-),1.25(4h,s,nch2ch2n);esi-ms m/z:301.1[m+h]
+
。
[0099]
实施例12 4-(4-(1h-咪唑-1-基)丁氧基)喹唑啉(c-3)的制备
[0100]
化合物c-3的结构式如下:
[0101][0102]
方法同a-1,取中间体c(200mg,0.71mmol)、咪唑(60mg,0.87mmol)溶解于10ml乙腈
中,加入催化剂na2co3(230mg,2.17mmol)。80℃反应约35h反应完全。浓缩得到黄色油状液体c-3 110mg,产率为57.2%,经鉴定为4-(4-(1h-咪唑-1-基)丁氧基)喹唑啉。
[0103]1h-nmr(400mhz,cdcl3)δ8.30(1h,dd,j=0.8hz,8.0hz,h-8),8.00(1h,s,h-2)7.78(1h,td,j=1.4hz,7.6hz,h-6),7.72(1h,d,j=8.0hz,h-5),7.69(1h,s,imidazol),7.53(1h,t,j=7.0hz,h-7),7.50(1h,s,imidazol),7.10(2h,s,ch2n-),6.92(1h,s,imidazol),4.02(2h,t,j=7.0hz,och
2-),1.84(4h,m,-ch2ch
2-);esi-ms m/z:269.1[m+h]
+
。
[0104]
实施例13 4-(4-(喹唑啉-4-基氧基)丁基)吗啉(c-4)的制备
[0105]
化合物c-4的结构式如下:
[0106][0107]
方法同a-1,取中间体c(200mg,0.71mmol)、吗啡啉(62μl,0.73mmol)溶解于10ml乙腈中,加入催化剂na2co3(230mg,2.17mmol)。80℃反应约6h反应完全。浓缩得到白色晶体c-4 220mg,产率为85.8%,经鉴定为4-(4-(喹唑啉-4-基氧基)丁基)吗啉。
[0108]
mp 81-82℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.0hz,8.0hz,h-8),8.04(1h,s,h-2),7.76(1h,td,j=1.5hz,7.8hz,h-6),7.71(1h,d,j=7.7hz,h-5),7.51(1h,td,j=1.3hz,7.2hz,h-7),4.04(2h,t,j=6.6hz,och
2-),3.70(4h,t,j=4.6hz,nch2ch2o),2.42(4h,t,nch2ch2o),2.38(2h,t,j=7.4hz,ch2n-),1.85(2h,m,-ch
2-),1.58(2h,m,-ch
2-);esi-ms m/z:288.1[m+h]
+
。
[0109]
实施例14 4-((5-(1h-吡唑-1-基)戊基)氧基)喹唑啉(d-1)的制备
[0110]
化合物d-1的结构式如下:
[0111][0112]
方法同a-1,取中间体d(200mg,0.68mmol)、吡唑(51mg,0.74mmol)溶解于10ml乙腈中,加入催化剂k2co3(281mg,2.03mmol)。80℃反应约40h反应完全。浓缩得到白色晶体d-1 160mg,产率为83.1%,经鉴定为4-((5-(1h-吡唑-1-基)戊基)氧基)喹唑啉。
[0113]
mp 93-94℃。1h-nmr(400mhz,cdcl3)δ8.31(1h,d,j=8.0hz,h-8),7.99(1h,s,h-2),7.76(1h,td,j=1.2hz,7.6hz,h-6),7.71(1h,d,j=7.8hz,h-5),7.52(1h,t,j=7.9hz,h-7),7.49(1h,s,pyrazol),7.34(1h,dd,j=2.1hz,8.4hz,pyrazol),6.21(1h,t,j=2.1hz,pyrazol),3.97(2h,t,j=7.3hz,och
2-),4.03(2h,t,j=7.3hz,och
2-),2.04(2h,m,ch2n-),1.82(2h,m,-ch
2-),1.37(2h,m,-ch
2-),1.26(2h,m,-ch
2-);esi-ms m/z:283.1[m+h]
+
。
[0114]
实施例15 4-((5-(4-甲基哌嗪-1-基)戊基)氧基)喹唑啉(d-2)的制备
[0115]
化合物d-2的结构式如下:
[0116][0117]
方法同a-1,取中间体d(200mg,0.68mmol)、1-甲基哌嗪(83μl,0.75mmol)溶解于10ml乙腈中,加入催化剂k2co3(280mg,2.02mmol)。80℃反应约8h反应完全。浓缩得到白色晶体d-2 120mg,产率为56.1%,经鉴定为4-((5-(4-甲基哌嗪-1-基)戊基)氧基)喹唑啉。
[0118]
mp 85-86℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,d,j=8.0hz,h-8),8.03(1h,s,h-2),7.76(1h,td,j=1.2hz,7.5hz,h-6),7.71(1h,d,j=8.1hz,h-5),7.51(1h,t,j=6.9hz,h-7),4.00(2h,t,j=7.4hz,och
2-),2.46(4h,s,nch2ch2n),2.34(2h,t,j=7.6hz,ch2n-),2.28(3h,s,-ch3),1.82(2h,m,-ch
2-),1.56(2h,m,-ch
2-),1.40(2h,m,-ch
2-);esi-ms m/z:315.1[m+h]
+
。
[0119]
实施例16 4-((5-(1h-咪唑-1-基)戊基)氧基)喹唑啉(d-3)的制备
[0120]
化合物d-3的结构式如下:
[0121][0122]
方法同a-1,取中间体d(300mg,1.02mmol)、咪唑(80mg,1.16mmol)溶解于10ml乙腈中,加入催化剂na2co3(320mg,3.02mmol)。80℃反应约35h反应完全。浓缩得到黄色油状液体d-3 120mg,产率为46.6%,经鉴定为4-((5-(1h-咪唑-1-基)戊基)氧基)喹唑啉。
[0123]1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.2hz,8.0hz,h-8),8.00(1h,s,h-2),7.77(1h,td,j=1.5hz,7.5hz,h-6),7.72(1h,s,imidazol),7.71(1h,d,j=2.9hz,h-5),7.52(1h,td,j=1.2hz,7.0hz,h-7),7.50(1h,s,imidazol),6.92(1h,s,imidazol),3.97(2h,m,och
2-),1.85(4h,m,-ch2ch
2-),1.39(2h,m,-ch
2-);esi-ms m/z:283.1[m+h]
+
。
[0124]
实施例17 4-(5-(喹唑啉-4-基氧基)戊基)吗啉(d-4)的制备
[0125]
化合物d-4的结构式如下:
[0126][0127]
方法同a-1,取中间体d(300mg,1.02mmol)、吗啡啉(99μl,1.11mmol)溶解于10ml乙腈中,加入催化剂na2co3(320mg,3.02mmol)。80℃反应约6h反应完全。浓缩得到白色晶体d-4 200mg,产率为65.4%,经鉴定为4-(5-(喹唑啉-4-基氧基)戊基)吗啉。
[0128]
mp 81-82℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.0hz,8.0hz,h-8),8.03(1h,s,h-2),7.76(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,d,j=7.4hz,h-5),7.51(1h,td,j=1.2hz,7.5hz,h-7),4.01(2h,t,j=7.3hz,och
2-),3.70(4h,t,j=4.6hz,nch2ch2o),
2.41(4h,t,j=4.6hz,nch2ch2o),2.33(2h,t,j=7.4hz,ch2n-),1.83(2h,m,-ch
2-),1.55(2h,m,-ch
2-),1.42(2h,m,-ch
2-);esi-msm/z:302.2[m+h]
+
。
[0129]
实施例18 4-((6-(1h-吡唑-1-基)己基)氧基)喹唑啉(e-1)的制备
[0130]
化合物e-1的结构式如下:
[0131][0132]
方法同a-1,取中间体e(240mg,0.78mmol)、吡唑(80mg,1.18mmol)溶解于10ml乙腈中,加入催化剂k2co3(400mg,2.89mmol)。80℃反应约50h反应完全。浓缩得到白色晶体e-1 110mg,产率为47.7%,经鉴定为4-((6-(1h-吡唑-1-基)己基)氧基)喹唑啉。
[0133]
mp 63-64℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.08hz,8.0hz,h-8),8.00(1h,s,h-2),7.76(1h,td,j=1.4hz,7.5hz,h-6),7.71(1h,d,j=7.3hz,h-5),7.5(1h,td,j=1.2hz,7.5hz,h-7),7.48(1h,d,j=1.5hz,pyrazol),7.35(1h,d,j=2.0hz,pyrazol)6.22(1h,t,j=2.0hz,pyrazol),4.12(2h,t,j=7.0hz,och
2-),3.97(2h,t,j=7.3hz,ch2n-),4.03(2h,t,j=7.3hz,och
2-),1.89(2h,m,-ch
2-),1.87(2h,m,-ch
2-),1.37(4h,m,-ch2ch
2-);esi-ms m/z:297.1[m+h]
+
。
[0134]
实施例19 4-(((6-(4-甲基哌嗪-1-基)己基)氧基)喹唑啉(e-2)的制备
[0135]
化合物e-2的结构式如下:
[0136][0137]
方法同a-1,取中间体e(300mg,0.97mmol)、1-甲基哌嗪(110μl,0.97mmol)溶解于10ml乙腈中,加入催化剂na2co3(310mg,2.92mmol)。80℃反应约8h反应完全。浓缩得到白色晶体e-2 230mg,产率为72.0%,经鉴定为4-(((6-(4-甲基哌嗪-1-基)己基)氧基)喹唑啉。
[0138]
mp 47-48℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,d,j=8.0hz,h-8),8.03(1h,s,h-2),7.76(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,d,j=7.7hz,h-5),7.51(1h,t,j=8.1hz,h-7),4.00(2h,t,j=7.3hz,och
2-),2.4(4h,s,nch2ch2n),2.34(2h,d,j=4.4hz,ch2n-),2.28(3h,s,-ch3),1.81(2h,m,-ch
2-),1.50(2h,m,-ch
2-),1.38(4h,m,-ch2ch
2-);esi-ms m/z:329.2[m+h]
+
。
[0139]
实施例20 4-((6-(1h-咪唑-1-基)己基)氧基)喹唑啉(e-3)的制备
[0140]
化合物e-3的结构式如下:
[0141][0142]
方法同a-1,取中间体e(300mg,0.97mmol)、咪唑(70mg,1.02mmol)溶解于10ml乙腈中,加入催化剂na2co3(310mg,2.92mmol)。80℃反应约35h反应完全。浓缩得到黄色油状液体e-3 110mg,产率为48.1%,经鉴定为4-((6-(1h-咪唑-1-基)己基)氧基)喹唑啉。
[0143]1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.1hz,8.0hz,h-8),8.01(1h,s,h-2),7.77(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,d,j=7.2hz,h-5),7.52(1h,td,j=1.2hz,7.5hz,h-7),7.46(1h,s,imidazol),7.04(1h,s,imidazol),6.89(1h,s,imidazol),3.99(2h,t,j=7.3hz,-ch2n),3.99(2h,t,j=7.0hz,och
2-),1.79(4h,m,-ch2ch
2-),1.38(4h,m,-ch2ch
2-);esi-ms m/z:297.2[m+h]
+
。
[0144]
实施例21 4-(6-(喹唑啉-4-基氧基)己基)吗啉(e-4)的制备
[0145]
化合物e-4的结构式如下:
[0146][0147]
方法同a-1,取中间体e(300mg,1.02mmol)、吗啡啉(103μl,1.16mmol)溶解于10ml乙腈中,加入催化剂na2co3(310mg,2.92mmol)。80℃反应约6h反应完全。浓缩得到白色晶体e-4 300mg,产率为97.8%,经鉴定为4-(6-(喹唑啉-4-基氧基)己基)吗啉。
[0148]
mp 56-58℃;1h-nmr(400mhz,cdcl3)δ8.31(1h,dd,j=1.1hz,8.1hz,h-8),8.03(1h,s,h-2),7.76(1h,td,j=1.5hz,7.5hz,h-6),7.71(1h,d,j=7.7hz,h-5),7.51(1h,td,j=1.3hz,7.5hz,h-7),4.00(2h,t,j=7.3hz,och
2-),3.70(4h,t,j=4.5hz,nch2ch2o),2.42(4h,s,nch2ch2o),2.31(2h,t,j=7.8hz,ch2n-),1.81(2h,m,-ch
2-),1.50(2h,m,-ch
2-),1.39(4h,m,-ch2ch
2-);esi-ms m/z:316.2[m+h]
+
。
[0149]
本发明实施例制得的喹唑啉含氮杂环取代衍生物,如表1所示;
[0150]
表1本发明制得的喹唑啉含氮杂环取代衍生物
[0151]
[0152][0153]
喹唑啉含氮杂环衍生物的抗糖尿病活性评价
[0154]
(1)实验原理
[0155]
胰岛细胞分泌的胰岛素能够发挥降血糖作用。因此,降糖药物具有胰岛细胞保护作用。棕榈酸使胰岛β细胞是凋亡而进行的糖尿病损伤模型的建立。通过对比化合物和棕榈酸损伤模型的细胞活力强弱,判断化合物是否对胰岛β细胞有保护作用。
[0156]
(2)细胞培养
[0157]
细胞培养于37℃、5%的co2培养箱中,细胞融合度达80%,可进行细胞传代。吸出完全培养基,并用pbs缓冲液轻轻清洗2遍,加入0.25%含edta胰酶1ml,消化1.5min后用完全培养基(dmem培养基+1%三抗+10%胎牛血清)将细胞冲洗下来。1000r/min离心5min,弃上清收集细胞,铺至5个t25培养瓶中培养,各添加5ml完全培养基,将细胞分散均匀后放置
细胞培养箱中培养。
[0158]
(3)溶液的配置
[0159]
10%牛血清白蛋白(bsa):精密称取bsa粉末1.0g,用pbs缓冲液充分溶解并定容至10ml,滤过除菌,分装后于-20℃保存备用。
[0160]
棕榈酸(palmitate,pa)工作液的配制:精密称取pa粉末0.3590g(359.002mg),加入1.0ml无水乙醇超声溶解,加入无水乙醇稀释后,按照1:19的比例用无菌10%bsa稀释,分别配制成70mm、50mm、30mm、10mm的工作液,现用现配。配制不同浓度的pa工作液用于观察不同浓度pa对细胞活性的影响,确定最佳刺激浓度。
[0161]
化合物溶液的配制:精密称取不同化合物的重量,加入不同体积的二甲基亚砜溶解至25mm。用pbs缓冲液稀释成10mm的工作液,-20℃保存备用
[0162]
(4)测定棕榈酸刺激下药物对细胞的保护作用
[0163]
min6细胞融合度达到80%时,将细胞均匀接种于96孔培养板中,于37℃、5%co2培养箱中培养过夜。加入不同浓度的pa工作液使得培养液中pa终浓度为0μm、100μm、300μm、500μm、700μm,不同浓度的pa刺激24小时后采用cck8试剂测细胞活力;
[0164]
表2pa的浓度与细胞活力的关系
[0165][0166]
cck8结果显示,随着pa浓度的逐渐升高,min6细胞活力呈逐渐下降趋势(表2)。当pa浓度为0.3mmol/l时,细胞活力较正常对照组明显下降,细胞活力为38.3%
±
4.1%,故选用该浓度为最佳刺激浓度。
[0167]
min6细胞融合度达到80%时,将细胞均匀接种于96孔培养板中,于37℃、5%co2培养箱中培养过夜。加入终浓度为100μm的化合物溶液预保护30min后加入终浓度为0.3mmol/l的pa继续孵育24小时后采用cck8试剂测细胞活力。
[0168]
(5)实验结果
[0169]
表3筛查化合物对pa刺激下min6细胞的保护活性
[0170][0171][0172]
表3中可以看出,20个化合物中与pa损伤造模相比大部分都有明显的胰岛细胞保护作用,其中甲基哌嗪取代和吡唑环取代的化合物胰岛细胞保护作用强,当n=5时即烷基链为己烷时活性总体较弱。n=4时即烷基链为戊烷时四种取代类型的活性都强与pa损伤模型组。总体来说,喹唑啉含氮杂环衍生物具有明显的胰岛细胞保护作用,是抗糖尿病的一种新的化学实体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1