一种重组蛋白纯化方法与流程
本发明属于生物医药,具体涉及一种重组蛋白纯化方法。
背景技术:
1、在许多用于生产重组蛋白的纯化方法中常用到蛋白a柱进行亲和层析。利用蛋白a柱的优势在于在工艺初期就能获得高纯度产品。然而,蛋白a树脂的成本比其他常用的离子交换树脂高约30倍,从而导致重组蛋白的生产成本较高,蛋白a树脂在重组蛋白生产相关原料成本中高达35%。
2、而且,重组蛋白产品中残留的微量蛋白a会在施用于人体时导致免疫或其他生理反应。因此,需要对采用蛋白a柱的纯化方法进行持续监测,并需要在每个纯化步骤中去除残余的蛋白a。
3、此外,由于蛋白a基于其与靶标的生物亲和性而起作用,其化学稳定性较差。为了维持蛋白a的活性,不得使用1m的naoh对层析柱进行清洗。但不使用1m的naoh,就很难完全去除层析柱上的杂质,这会导致层析柱在后续使用中的再利用次数显著低于以化学树脂为填料的层析柱。鉴于蛋白a具有上述的缺点,仍需要开发更有效、更经济的重组蛋白纯化方法。
技术实现思路
1、针对现有技术存在的不足,本发明的目的在于提供一种重组蛋白纯化方法。该方法无需使用蛋白a柱,可以制备出高纯度、高质量的重组蛋白。
2、为达此目的,本发明提供了一种重组蛋白纯化方法,所述方法包括如下步骤:获得表达重组蛋白的宿主细胞的培养上清液;将获得的培养上清液依次经过阳离子交换层析、阴离子交换层析、疏水相互作用层析,得到纯化的所述重组蛋白。
3、本文的“重组蛋白”是指能够利用protein a作为配基的纯化树脂进行纯化的重组蛋白,比如包含igg的抗体或fc融合蛋白。
4、宿主细胞经过培养后,培养液中除含有活性重组蛋白外,还含有宿主细胞蛋白(hcp)、宿主细胞来源的核酸分子、细胞生长因子等,需要进行纯化。
5、在本发明一些实施方式中,在所述经过阳离子交换层析、阴离子交换层析、疏水相互作用层析的步骤之前,部分去除所述培养上清液中的所述宿主细胞的蛋白等。在本发明一些实施方式中,所述“部分去除”是指对所述上清液进行初步纯化以去除部分宿主细胞蛋白。经过该步骤后,仍需通过后续的层析步骤以进一步降低宿主细胞蛋白含量。
6、在本发明一些实施方式中,部分去除宿主细胞蛋白的方法包括:将所述培养上清液的ph调节至≤所述重组蛋白等电点-1,使所述宿主细胞的蛋白沉淀,固液分离。
7、在本发明一些实施方式中,使用柠檬酸溶液、醋酸和/或盐酸调节所述培养上清液的ph。
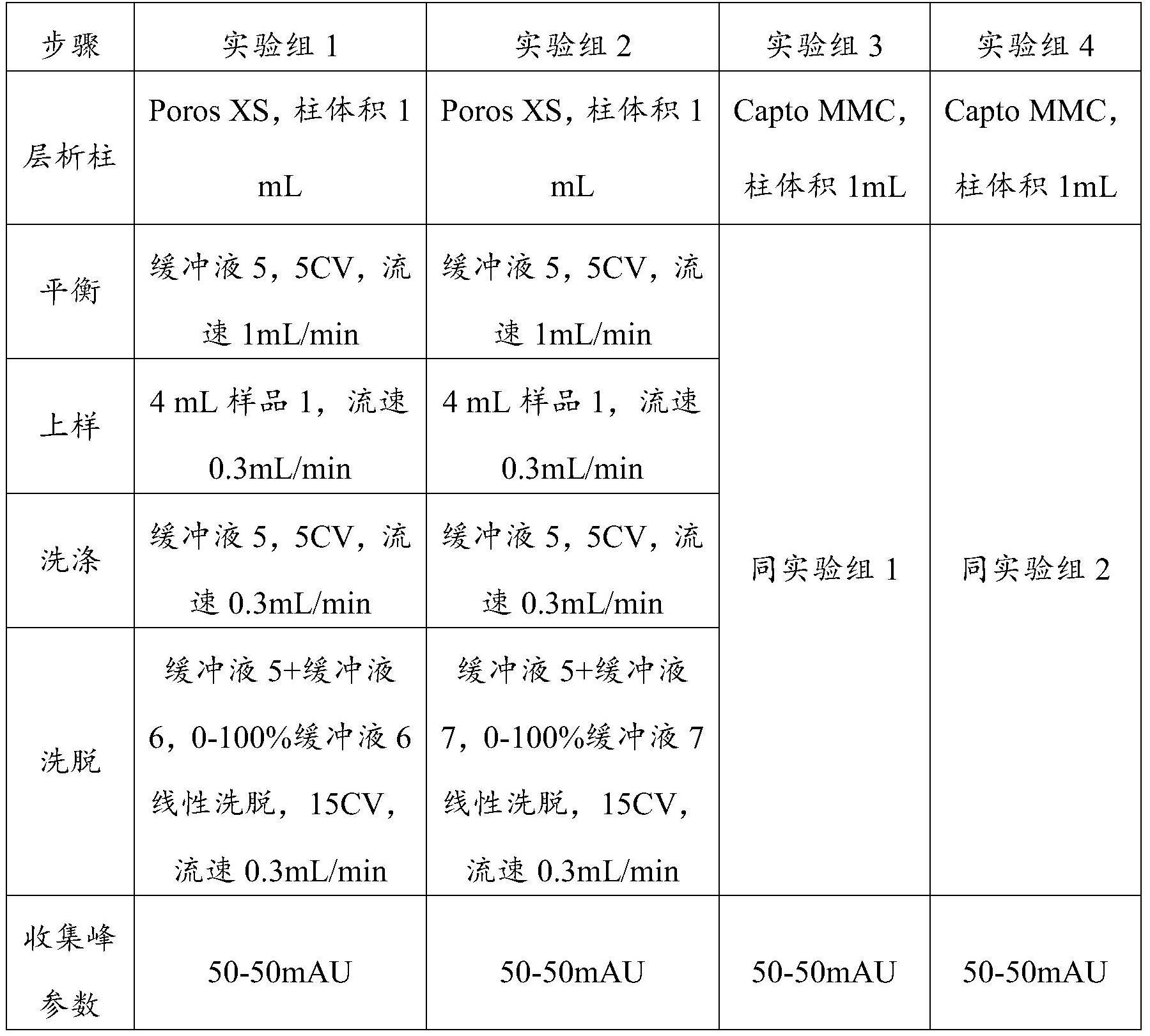
8、在本发明一些实施方式中,所述阳离子交换层析采用的阳离子交换材料包含磺酸官能团或羧酸官能团。在本发明一些实施方式中,所述阳离子交换材料是膜、整料或树脂。在本发明一些实施方式中,所述阳离子交换材料是poros xs树脂。
9、在本发明一些实施方式中,所述阴离子交换层析采用的阴离子交换材料包含叔胺离子官能团、季铵离子官能团、多胺官能团或二乙基氨基乙基官能团。在本发明一些实施方式中,所述阴离子交换材料是膜、整料或树脂。在本发明一些实施方式中,所述阴离子交换材料为capto adhere树脂。
10、在本发明一些实施方式中,所述疏水相互作用层析采用的疏水相互作用交换材料包含丁基、苯基、辛基或聚丙二醇基团。在本发明一些实施方式中,所述疏水相互作用交换材料是膜、整料或树脂。在本发明一些实施方式中,所述疏水相互作用交换材料为captophenyl impres树脂。
11、在本发明一些实施方式中,所述重组蛋白纯化方法还包括:在所述阳离子交换层析和阴离子交换层析之间进行病毒灭活。
12、在本发明一些实施方式中,所述重组蛋白纯化方法还包括:在所述疏水相互作用层析之后进行病毒纳滤。
13、在本发明一些实施方式中,所述重组蛋白纯化方法还包括:在所述病毒纳滤之后进行超滤浓缩。
14、在本发明一些实施方式中,所述重组蛋白为曲妥珠单抗或利妥昔单抗。
15、本发明中,当所述重组蛋白为曲妥珠单抗时,所述阳离子交换层析优选包括如下步骤:
16、(1)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,ph为4.0-6.0,电导率为5.0-15.0ms/cm的缓冲液对阳离子交换层析柱进行平衡,然后上样;优选地,ph为4.4-4.6,电导率为9.3-13.3ms/cm;
17、(2)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,ph为4.0-6.0,电导率为5.0-15.0ms/cm的缓冲液对所述阳离子交换层析柱进行洗涤;优选地,ph为4.4-4.6,电导率为9.3-13.3ms/cm;
18、(3)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,ph为4.5-5.3,电导率为10.0-15.0ms/cm的缓冲液进行预洗脱;优选地,ph为4.92-5.03,电导率为13.16-13.30ms/cm;
19、(4)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,ph为5.5-8.0,电导率为10.0-15.0ms/cm的缓冲液进行洗脱,收集洗脱液;优选地,ph为5.55-5.73,电导率为13.16-13.30ms/cm。
20、优选地,所述阳离子交换层析中,进行平衡的缓冲液用量为5-10倍柱体积。
21、优选地,所述阳离子交换层析中,进行洗涤的缓冲液用量为5-10倍柱体积。
22、优选地,所述阳离子交换层析中,进行预洗脱的缓冲液用量为5-10倍柱体积。
23、优选地,所述阳离子交换层析中,进行洗脱的缓冲液用量为8-12倍柱体积。
24、当所述重组蛋白为曲妥珠单抗时,所述阴离子交换层析优选包括如下步骤:
25、(1)调节所述阳离子交换层析得到的样品的电导率为3.0-15.0ms/cm,ph为6.0-8.0;优选地,电导率为4.0-10.0ms/cm,ph为6.0-6.6;
26、(2)采用含有20-100mm磷酸盐-柠檬酸,ph为6.0-8.0,电导率为3.0-15.0ms/cm的缓冲液对阴离子交换层析柱进行平衡;优选地,ph为6.0-6.5,电导率为4.0-10.0ms/cm;
27、(3)上样,收集流穿样,上样量优选为50.0-150.0mg样品/ml阴离子交换材料。
28、优选地,所述阴离子交换层析中,进行平衡的缓冲液用量为5-10倍柱体积。
29、当所述重组蛋白为曲妥珠单抗时,所述疏水相互作用层析优选包括如下步骤:
30、(1)向所述阴离子交换层析得到的样品中添加硫酸铵至硫酸铵的浓度为0.5-1.5m,并调节ph为6.0-8.0;优选地,硫酸铵的浓度为0.8m,ph为6.0-6.6;
31、(2)采用含有50-100mm磷酸盐-柠檬酸,0.5-1.5m硫酸铵,ph为6.0-8.0的缓冲液对疏水相互作用层析柱进行平衡,然后上样;优选地,硫酸铵的浓度为0.8m,ph为6.0-6.6;
32、(3)采用含有50-100mm磷酸盐-柠檬酸,0.5-1.5m硫酸铵,ph为6.0-8.0的缓冲液对所述疏水相互作用层析柱进行洗涤;优选地,硫酸铵的浓度为0.8m,ph为6.0-6.6;
33、(4)采用含有50-100mm磷酸盐-柠檬酸,硫酸铵,ph=6.0-8.0的洗脱缓冲液进行线性洗脱,洗脱过程中所述洗脱缓冲液中硫酸铵的浓度从0.5-1.5m逐渐降低至0,收集洗脱液。
34、优选地,所述疏水相互作用层析中,进行平衡的缓冲液用量为5-10倍柱体积。
35、优选地,所述疏水相互作用层析中,进行洗涤的缓冲液用量为3-5倍柱体积。
36、优选地,所述疏水相互作用层析中,进行线性洗脱的缓冲液用量为10-20倍柱体积。
37、本发明中,当所述重组蛋白为利妥昔单抗时,所述阳离子交换层析优选包括如下步骤:
38、(1)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,电导率为5.0-15.0ms/cm,ph为4.0-6.0的缓冲液对阳离子交换层析柱进行平衡,然后上样;优选地,电导率为9.3-13.3ms/cm,ph为4.4-4.6;
39、(2)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,电导率为5.0-15.0ms/cm,ph为4.0-6.0的缓冲液对所述阳离子交换层析柱进行洗涤;优选地,电导率为9.3-13.3ms/cm,ph为4.4-4.6;
40、(3)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,电导率为5.0-15.0ms/cm,ph为4.5-5.5的缓冲液进行预洗脱;优选地,电导率为9.3-13.3ms/cm,ph为5.0-5.3;
41、(4)采用含有50-100mm磷酸盐-柠檬酸,50-100mm氯化钠,电导率为5.0-15.0ms/cm,ph为5.5-8.0的缓冲液进行洗脱,收集洗脱液;优选地,电导率为9.3-13.3ms/cm,ph为6.6-7.0。
42、优选地,所述阳离子交换层析中,进行平衡的缓冲液用量为5-10倍柱体积。
43、优选地,所述阳离子交换层析中,进行洗涤的缓冲液用量为5-10倍柱体积。
44、优选地,所述阳离子交换层析中,进行预洗脱的缓冲液用量为5-10倍柱体积。
45、优选地,所述阳离子交换层析中,进行洗脱的缓冲液用量为10-20倍柱体积。
46、当所述重组蛋白为利妥昔单抗时,所述阴离子交换层析优选包括如下步骤:
47、(1)调节所述阳离子交换层析得到的样品ph为6.0-8.0,电导率为3.0-15.0ms/cm;优选地,ph为6.0-7.0,电导率为4.0-15.0ms/cm;
48、(2)采用含有30-50mm磷酸盐-柠檬酸,ph为6.0-8.0,电导率为3.0-15.0ms/cm的缓冲液对阴离子交换层析柱进行平衡;优选地,ph为6.0-7.0,电导率为4.0-15.0ms/cm;
49、(3)上样,收集流穿样;上样量优选为100.0-300.0mg样品/ml阴离子交换材料。
50、优选地,所述阴离子交换层析中,进行平衡的缓冲液用量为10-20倍柱体积。
51、当所述重组蛋白为利妥昔单抗时,所述疏水相互作用层析优选包括如下步骤:
52、(1)向所述阴离子交换层析得到的样品中添加硫酸铵至硫酸铵的浓度为0.25-0.8m,并调节ph至ph为6.0-8.0;优选地,硫酸铵的浓度为0.5m,ph为6.0-6.5;
53、(2)采用含有50-100mm磷酸盐-柠檬酸,0.25-0.8m硫酸铵,ph为6.0-8.0的缓冲液对疏水相互作用层析柱进行平衡,然后上样;优选地,硫酸铵的浓度为0.5m,ph为6.0-6.6;
54、(3)采用含有50-100mm磷酸盐-柠檬酸,0.25-0.8m硫酸铵,ph为6.0-8.0的缓冲液对所述疏水相互作用层析柱进行洗涤;优选地,硫酸铵的浓度为0.5m,ph为6.0-6.6;
55、(4)采用含有50-100mm磷酸盐-柠檬酸,硫酸铵,乙醇,ph=6.0-8.0的洗脱缓冲液进行线性洗脱,洗脱过程中所述洗脱缓冲液中硫酸铵的浓度从0.25-0.8m逐渐降低至0,乙醇的浓度从0逐渐增加至5-20wt%,收集洗脱液。
56、优选地,所述疏水相互作用层析中,进行平衡的缓冲液用量为5-10倍柱体积;
57、优选地,所述疏水相互作用层析中,进行洗涤的缓冲液用量为3-5倍柱体积。
58、优选地,所述疏水相互作用层析中,进行线性洗脱的缓冲液用量为10-20倍柱体积。
59、与现有技术相比,本发明具有以下有益效果:
60、本发明提供的纯化方法将阳离子交换层析与阴离子交换层析、疏水相互作用层析相结合,对细胞培养上清液进行纯化,能够有效降低宿主细胞蛋白等杂质含量,制备出高纯度、高质量的重组蛋白,避免了使用蛋白a亲和层析残留微量蛋白a所导致的免疫或其他生理反应的问题。
- 还没有人留言评论。精彩留言会获得点赞!