环磺酮代谢物的制备方法与流程
本发明属于有机化合物制备,涉及环磺酮代谢物的制备方法,尤其涉及环磺酮代谢物m5和m10的制备方法。
背景技术:
1、农药是重要的农业投入品,农药的使用直接关系到农产品的质量安全和生态环境,新的《农药管理条例》对农药管理工作提出了更高的要求,原药登记的难度提升,主要体现在试验项目的增多。对于原药代谢物的要求体现在环境部分和残留部分,环境部分新增了土壤好氧代谢、土壤厌氧代谢、水-沉积物系统好氧代谢等试验,残留部分新增了植物中代谢、动物中代谢、环境中代谢、加工农产品中农药代谢物残留等试验。完成代谢物相应的毒理试验(如急性经皮毒性试验、亚慢性经口毒性试验、致突变性试验等)至少需要准备2公斤以上的样品,这样大量的样品从植物体中分离得到的难度极大,目前未见到通过分离得到足够满足毒理试验需要量的报道,通过化学手段进行合成的方法也很少,而且合成工艺复杂、合成效率低。同时,农药残留问题一直都是世界各国重点关注的民生问题,世界各国对各种农药残留均有限量标准,农药残留超标会影响到农产品的出口贸易,制备高质量的代谢物标准品对残留量进行检测成为必然。因此,农药代谢物合成研究是农药登记、农残质检和科研领域的急需,社会应用价值极大。
2、环磺酮(tembotrione)化学名为2-(2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰基)环己烷-1,3二酮,cas号为335104-84-2,是由拜耳公司于2007年研制的三酮类hppd抑制剂类除草剂,主要用于玉米田和稻田中禾本科和阔叶科杂草防除,对多种杂草具有杀灭作用,对交叉谱杂草(如狗尾草属、野黎属)以及耐草甘膦类、耐乙酰乳酸合成酶抑制剂类、耐麦草畏类的杂草也具有较高的防除效果。环磺酮近年来的市场表现十分优异,备受关注,随着化合物专利到期,农药的登记是目前很多企业的重要工作之一,因此,需要制备大量的环磺酮代谢物以供毒理试验。
3、欧盟食品安全局对环磺酮代谢物有相关报道,文献reasoned opinion on thesetting of new mrls for tembotrione in kidney and liver of bovine and swine(efsa journal,2012,10,10,2932)、conclusion on the peer review of the pesticiderisk assessment of the active substance tembotrione(efsa journal,2013,11,3,3131)、review of the existing maximum residue levels for tembotrione accordingto article 12 of regulation(ec)no 396/2005(efsa journal,2018,16,9,5417)、tembotrion-volume 3,annex b.7 residue date(february 2007)公开了环磺酮多种代谢物的产生途径以及分子结构,沈阳化工研究院也对环磺酮在植物体、动物体、大鼠体内、环境代谢途径进行了大量研究,证实了环磺酮不同途径多种代谢物的存在。
4、环磺酮代谢物m5化学名为4,6-二羟基-2-[2-氯-4-甲磺酰基-3-(2,2,2-三氟乙氧基)甲基苯甲酰基]环己烷-1,3二酮;环磺酮代谢物m10化学名为4-羟基-2-[2-氯-4-甲磺酰基-3-(2,2,2-三氟乙氧基)甲基苯甲酰基]环己烷-1,3二酮。文献reasoned opinion onthe setting of new mrls for tembotrione in kidney and liver of bovine andswine(efsa journal,2012,10,10,2932)报道环磺酮在植物体代谢,m5放射性强度比例为12~44%,m10放射性强度比例为27.7~30%;文献tembotrion-volume 3,annex b.6toxicology and metabolism(june 2009)报道了环磺酮在大鼠及动物体(畜禽)代谢产生大量的代谢物m10,其放射性强度比例为54~78%。根据农药登记资料要求(中华人民共和国农业部公告第2569号)的相关规定,放射性强度比例大于10%的代谢物为主要代谢物,需提供相应的毒理试验报告。完成相应的毒理试验需要准备大量的样品,目前还未见关于代谢物m5和m10的化学合成方法的相关报道。文献development and establishment of aquechers-based extraction method for determining tembotrione and itsmetabolite ae 1417268 in corn,corn oil and certain animal-origin foods byhplc-ms/ms(food additives&contaminants:parta,2020,37,10,1678-1686)中公开了一种hplc-ms/ms方法,用于定量测定玉米、玉米油、牛肉、猪肉、鸡肉和鸡蛋中的代谢物m5含量,但未涉及化学合成方法。
5、因此,开发一种步骤简单、制备效率高的环磺酮代谢物的合成工艺,是本领域亟待解决的问题。
技术实现思路
1、针对现有技术的不足,本发明的目的在于提供一种环磺酮代谢物的制备方法,特别是提供了环磺酮代谢物m5和m10的制备方法。本发明以环磺酮关键中间体2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯为原料,与式ⅰ所示1,3-环己二酮类化合物进行反应,经缩合、转位、水解三步反应制备得到环磺酮代谢物m5和m10。涉及合成路线简单,操作条件温和,能以较高收率得到高纯度的环磺酮代谢物,充分满足了农药登记中对于环磺酮代谢物的样品量需求。
2、为达此目的,本发明采用以下技术方案:
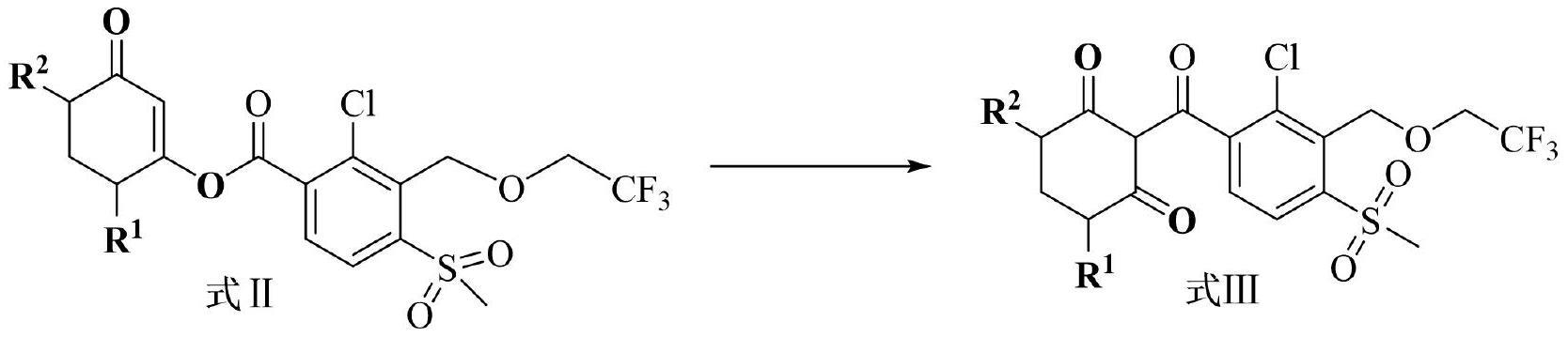
3、一方面,本发明提供一种环磺酮代谢物的制备方法,所述制备方法包括以下步骤:
4、以2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯与式ⅰ所示1,3-环己二酮类化合物为原料,经缩合反应、催化转位反应和水解反应,得到式ⅳ所示环磺酮代谢物,反应过程如下:
5、
6、其中r1是h、c1-c4烷氧基、苄氧基、乙酰氧基、苯甲酰基氧基或烷基硅氧基,r2是h、c1-c4烷氧基、苄氧基、乙酰氧基、苯甲酰基氧基或烷基硅氧基;且r1和r2不同时为h,r3和r4同为羟基或者r3和r4中一者为羟基,另一者为h。
7、本发明中环磺酮关键中间体2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯为原料,与式ⅰ化合物进行反应,经缩合、转位、水解三步反应制备得到环磺酮代谢物。涉及合成路线简单,操作条件温和,能以较高收率得到高纯度的环磺酮代谢物。
8、具体地,本发明提供的环磺酮代谢物的制备方法,包括以下步骤:
9、(1)在缚酸剂存在下2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯与式ⅰ所示1,3-环己二酮类化合物进行缩合反应,制备得到式ⅱ所示化合物,反应式如下:
10、
11、(2)在转位催化剂作用下式ⅱ化合物发生转位反应,生成式ⅲ化合物,反应式如下:
12、
13、(3)在催化剂作用下式ⅲ化合物发生水解反应,生成式ⅳ所示环磺酮代谢物,反应式如下:
14、
15、其中r1是h、c1-c4烷氧基、苄氧基、乙酰氧基、苯甲酰基氧基或烷基硅氧基,r2是h、c1-c4烷氧基、苄氧基、乙酰氧基、苯甲酰基氧基或烷基硅氧基;且r1和r2不同时为h,r3和r4同为羟基或者r3和r4中一者为羟基,另一者为h。
16、在本发明中,当r1和r2独立地选自c1-c4烷氧基、苄氧基、乙酰氧基、苯甲酰基氧基或烷基硅氧基时,式ⅳ所述环磺酮代谢物为m5;当r1和r2其中一者是h,另一者是c1-c4烷氧基、苄氧基、乙酰氧基、苯甲酰基氧基或烷基硅氧基时,式ⅳ所述环磺酮代谢物为m10。
17、优选地,所述烷基硅氧基为二甲基叔丁基硅氧基(otbs)或三乙基硅氧基(otes)。
18、优选地,步骤(1)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯与式ⅰ所示1,3-环己二酮类化合物的摩尔比为1:(1.0~1.5),例如可以为1:1.05、1:1.1、1:1.2、1:1.3、1:1.4或1:1.45等,进一步优选为1:1.05。
19、优选地,步骤(1)所述缚酸剂为三乙胺、吡啶或二异丙基乙胺的任意一种或至少两种的组合,进一步优选为三乙胺。
20、优选地,步骤(1)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯与缚酸剂的摩尔比为1:(1.05~1.5),例如可以为1:1.1、1:1.2、1:1.3、1:1.4或1:1.5等,进一步优选为1:1.1。
21、优选地,步骤(1)所述缩合反应的溶剂选自二氯乙烷、二氯甲烷、氯仿、苯、甲苯和二甲苯中的任意一种或至少两种的组合,进一步优选为二氯乙烷。
22、优选地,以步骤(1)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,所述溶剂的用量为900~2400g,例如1200g、1500g、1800g或2100g,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
23、优选地,步骤(1)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯以滴加的方式加入至反应体系中,有利于反应控制,避免结块现象。
24、优选地,所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的滴加温度为-15~60℃,例如-5℃、0℃、15℃、30℃、45℃或50℃,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为0~10℃。
25、优选地,所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的滴加时间为0.5~3h,例如1h、1.5h、2h或2.5h,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为1~1.5h。
26、优选地,步骤(1)所述缩合反应的温度为-15~60℃,例如-5℃、0℃、15℃、30℃、45℃或50℃,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为0~10℃。
27、优选地,步骤(1)所述缩合反应的时间为2~6h,例如2.5h、3h、3.5h、4h、4.5h、5h或5.5h,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为2.5~3h。
28、在本发明中,步骤(1)所述反应无需后处理,反应液直接用于合成式ⅲ化合物。
29、优选地,步骤(2)所述转位反应在助剂存在下进行,所述助剂为三乙胺或二异丙基乙胺的任意一种或两种的组合,进一步优选为三乙胺。
30、优选地,步骤(2)所述助剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(1.05~1.5):1,例如1.05:1、1.1:1、1.2:1、1.3:1、1.4:1或1.5:1等,进一步优选为1.2:1;
31、优选地,步骤(2)所述转位催化剂为丙酮氰醇。
32、优选地,以步骤(1)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,所述转位催化剂的用量为1~50g,例如可以为2g、4g、6g、8g、10g、20g、30g、40g或45g,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
33、优选地,步骤(2)所述转位反应的溶剂选自二氯乙烷、二氯甲烷、氯仿、苯、甲苯和二甲苯中的任意一种或至少两种的组合,进一步优选与前述合成化合物ⅱ所用溶剂相同。
34、优选地,以步骤(1)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,所述溶剂的用量为900~2400g,例如1200g、1500g、1800g或2100g,进一步优选与前述合成化合物ⅱ所用溶剂量相同。
35、优选地,步骤(2)所述转位反应的温度为5~60℃,例如10℃、15℃、30℃、45℃或50℃,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为20~30℃。
36、优选地,步骤(2)所述转位反应的时间为3~15h,例如5h、7h、9h、11h或13h,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为6~8h。
37、优选地,步骤(2)所述转位反应完成后还包括产物的后处理。
38、优选地,所述后处理包括酸化、分层、水洗和脱溶。
39、优选地,所述酸化为将体系ph值调整至1~5,例如1、1.5、2、2.5、3、3.5、4、4.5或5,优选2~3。
40、在本发明中,所述脱溶得到的粗产品,无需进一步处理,直接用于后续合成式ⅳ化合物。
41、优选地,步骤(3)所述水解反应在助剂存在下进行。
42、优选地,所述助剂为水;
43、优选地,步骤(3)所述助剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(1~10):1,例如可以为1.1:1、1.3:1、1.7:1、2:1、4:1、6:1、8:1或9:1等,进一步优选为(1.2~1.6):1。步骤(3)中如果助剂过少则反应不完全,如果助剂太多,则可能会使得三酮结构断键生成2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酸副产物,使得整体反应收率下降。
44、优选地,步骤(3)所述催化剂为hcl或hbr中的任意一种或两种的组合,进一步优选为hcl。
45、优选地,步骤(3)所述催化剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(0.2~10):1,例如可以为3:1、4:1、6:1、8:1或9:1等,进一步优选为(0.5~2):1。
46、优选地,步骤(3)所述反应在溶剂存在下进行。
47、优选地,所述溶剂选自甲醇、乙醇、叔丁醇、异丙醇、乙腈、苯腈或1,4-二氧六环中的任意一种或至少两种的组合,进一步优选为甲醇。
48、优选地,以步骤(3)所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,所述溶剂的用量为600~3000g,例如900g、1200g、1500g、2000g或2500g,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
49、优选地,步骤(3)所述水解反应的温度为20~60℃,例如25℃、30℃、35℃、40℃、45℃、50℃或55℃,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为30~40℃。
50、优选地,步骤(3)所述水解反应的时间为0.5~5h,例如1h、1.5h、2h、2.5h、3h、3.5h、4h或4.5h,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为1~2h。
51、优选地,步骤(3)所述水解反应完成后还包括产物的后处理。
52、优选地,所述后处理包括重结晶或脱溶后重结晶。
53、优选地,所述重结晶的试剂包括甲醇、乙醇及醇水溶液。
54、优选地,所述重结晶的温度为-5~10℃,例如可以为-4℃、-3℃、-2℃、-1℃、0℃、1℃、2℃、3℃、4℃、5℃、6℃、7℃、8℃或9℃等,优选0~5℃。
55、通过所述分离的步骤后,得到的环磺酮代谢物m5及m10含量大于98.0%。
56、在本发明中,作为优选技术方案,所述制备方法具体包括以下步骤:
57、(1)先将溶剂、缚酸剂和式ⅰ化合物放入反应釜中,于-15~60℃下在0.5~3h内将2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯滴加至反应体系中进行缩合反应,之后于-15~60℃保温反应2~6h得到粗产物,不经处理直接用于式ⅲ化合物的合成;其中所述缚酸剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(1.05~1.5):1;所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯与式ⅰ所示1,3-环己二酮类化合物的摩尔比为1:(1.0~1.5);以所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,溶剂用量为900~2400ml;
58、(2)将溶剂、式ⅱ化合物、助剂和催化剂放入反应釜中,于5~60℃保温反应3~15h得到式ⅲ化合物粗产物,经酸化、分层、水洗和脱溶得到式ⅲ化合物;所述助剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(1.05~1.5):1;以所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,转位催化剂用量为1~50g;以所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,溶剂用量为900~2400g;
59、(3)将溶剂、式ⅲ化合物、助剂和催化剂放入反应釜中,于20~60℃保温反应0.5~5h,经结晶或脱溶后结晶得到式ⅳ化合物;所述助剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(1~10):1;所述催化剂与2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的摩尔比为(0.2~10):1;以所述2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯的用量为1mol计,溶剂用量为600~3000g。
60、相对于现有技术,本发明具有以下有益效果:
61、本发明以2-氯-3-(2,2,2-三氟乙氧基)甲基-4-甲磺酰基苯甲酰氯和式ⅰ化合物为起始原料,在缚酸剂作用下发生缩合反应制备得到式ⅱ化合物,再在助剂、转位催化剂作用下发生分子内转位制备得到式ⅲ化合物,再经酸催化水解制备得到式ⅳ化合物,当r3和r4同为羟基时即为m5,当其中一个为h,另一个为羟基时即为m10,所得产品含量均≥98%,收率高达73%以上。所述制备方法的原料易得,步骤简单,操作便捷,实验过程可控,无需苛刻的反应环境,条件温和,工艺易于实现,实现了环磺酮代谢物的大量制备,能够充分满足农药登记中对于环磺酮代谢物的样品量需求。
- 还没有人留言评论。精彩留言会获得点赞!