一种依帕司他中间体的制备方法与流程
1.本发明涉及一种依帕司他中间体的制备方法,属于有机合成技术领域。
背景技术:
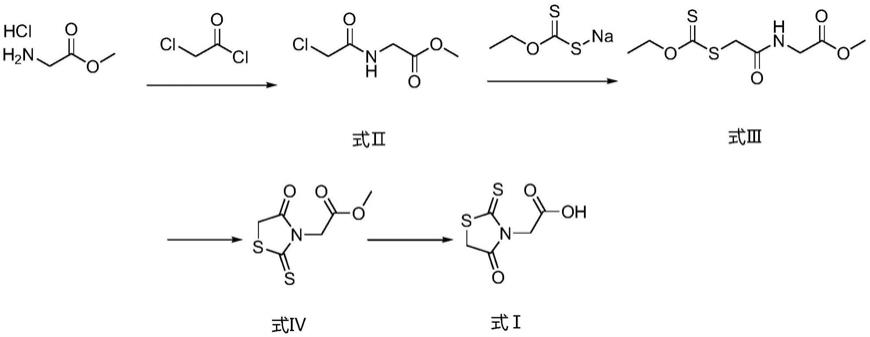
2.依帕司他为醛糖还原酶抑制药,以可逆地抑制与糖尿病性并发症的发病机制相关的多元醇代谢中葡萄糖转化为山梨醇的醛糖还原酶而发挥作用,已知山梨醇能影响神经细胞功能,它在神经元内蓄积会引起糖尿病性支配感觉运动的外周神经病症状。式ⅰ所示化合物为合成依帕司他的中间体,其结构式如下所示。
[0003][0004]
目前,现有合成依帕司他中间体的方法通常以甘氨酸、二硫化碳和α-甲基肉桂醛为起始物料,工艺中使用了剧毒试剂二硫化碳,且二硫化碳有极强的易挥发性、易燃性和爆炸性的特点。运输需要特殊的设备,且大量储存极其危险,很难实现工业化生产使用。
技术实现要素:
[0005]
本发明的目的是提供一种依帕司他中间体的合成方法,使用了比较易得且工业化便于储存的乙基黄原酸钠为起始物料。
[0006]
本发明所提供的制备方法的反应方程式如下所示:
[0007][0008]
具体地,本发明提供的制备方法包括如下步骤:
[0009]
s1、在碱存在的条件下,甘氨酸甲酯盐酸盐与氯乙酰氯进行亲核取代反应,得到式ⅱ所示化合物;
[0010]
所述碱为碳酸氢钠;
[0011]
所述亲核取代反应的溶剂为二氯甲烷与水的混合物,两者的体积比为1:0.5~
1.0,优选1:1;
[0012]
所述亲核取代反应的步骤如下:
[0013]
在0~5℃的条件下,将所述氯乙酰氯滴加至所述甘氨酸甲酯盐酸盐中;
[0014]
滴加完毕后,调节反应体系的ph值至中性,在0~5℃的条件下反应1~3h,然后在25~30℃的条件下反应1~3h;
[0015]
反应结束后进行分液,水相再用二氯甲烷萃取1次,有机相合并,40~45℃减压浓缩,得到无色透明油状物(温度低于20℃时可固化),即为式ⅱ所示化合物;
[0016]
所述甘氨酸甲酯盐酸盐、所述氯乙酰氯与所述碱的摩尔比为1:1.1~1.3:2.5~3.0,优选1:1.1:2.5;
[0017][0018]
s2、式ⅱ所示化合物与乙基黄原酸钠经亲核取代反应得到式ⅲ所示化合物;
[0019][0020]
s3、在叔丁醇钾的催化下,式ⅲ所示化合物经关环反应得到式ⅳ所示化合物;
[0021]
所述关环反应采用的溶剂为四氢呋喃;
[0022]
式ⅲ所示化合物与所述叔丁醇钾的摩尔比为1:2.5~3.0,优选1:3;
[0023][0024]
s4、在酸的作用下,式ⅳ所示化合物经水解得到式ⅰ所示化合物;
[0025][0026]
上述的制备方法中,步骤s2中,将所述乙基黄原酸钠滴加至式ⅱ所示化合物中;
[0027]
所述取代反应的温度可为25~35℃,时间可为5~10h,大量密度低于水的固体生成;
[0028]
反应结束后,过滤(出料时需要用氮气压)再用纯化水洗瓶和淋洗,滤饼60℃鼓风
干燥10~12h;
[0029]
式ⅱ所示化合物与所述乙基黄原酸钠的摩尔比为1:1.05~1.35。
[0030]
上述的制备方法中,步骤s3中,所述关环反应的温度为0~5℃,时间为2~4h;
[0031]
所述关环反应在惰性气氛下进行;
[0032]
所述关环反应结束后,将反应体系缓慢倒入预先冷却至0~5℃的稀盐酸中,再缓慢加入冷的纯化水,保持温度在0~10℃,继续搅拌1h;静置分液,易分层。有机相保留,水相再用二氯甲烷萃取;分液,合并有机相,饱和食盐水洗涤,分液,有机相40~45℃减压浓缩,得到棕红色油状物,即为式ⅳ所示化合物。
[0033]
上述的制备方法中,步骤s4中,所述水解反应在回流状态下进行;
[0034]
所述酸为浓盐酸(浓度为36~38%);
[0035]
所述水解反应的时间为20h;
[0036]
反应完毕,将反应体系降温至20~25℃,然后将反应体系缓慢倒入冷水中,加入乙酸乙酯搅拌溶解后分液,水相再用乙酸乙酯萃取一次,合并有机相,饱和食盐水洗涤,有机相浓缩至快干时加入正己烷带干,然后再加入正己烷室温(20~25℃)搅拌打浆;过滤,固体55℃鼓风干燥8~10h,得到黄色粉末状固体,即为式ⅰ所示化合物,产品符合质量标准后用于下一步反应。
[0037]
本发明提供的依帕司他中间体的合成方法,具有如下有益效果:
[0038]
本发明方法中多步反应得到的产物中间体均为固体,便于对其进行质控,工艺规避掉了易燃易爆试剂二硫化碳的使用,使工艺产业化生产具备了更好的可能性。
附图说明
[0039]
图1为本发明实施例1制备的式ⅱ所示化合物的质谱。
[0040]
图2为本发明实施例1制备的式ⅱ所示化合物的核磁共振氢谱。
[0041]
图3为本发明实施例1制备的式ⅲ所示化合物的质谱。
[0042]
图4为本发明实施例1制备的式ⅲ所示化合物的核磁共振氢谱。
[0043]
图5为本发明实施例1制备的式ⅳ所示化合物的核磁共振氢谱。
[0044]
图6为本发明实施例1制备的式ⅰ所示化合物的核磁共振氢谱。
[0045]
图7为本发明实施例1制备的式ⅰ所示化合物的hplc谱图。
[0046]
图8为本发明实施例1中制备式ⅰ所示化合物的反应体系的tlc板,其中,1表示syp-4,2表示混点,3表示反应液(乙酸乙酯萃取,点有机相),pe:ea:hac=3:2:0.5,uv=254nm。
具体实施方式
[0047]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0048]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0049]
实施例1、
[0050]
按照下述反应方程式制备式ⅰ所示化合物:
[0051][0052]
一、制备式ⅱ所示化合物
[0053]
往10l三口瓶中加入588.8g碳酸氢钠和4.0l的纯化水,搅拌5min,体系为混悬液。然后加入4.0l二氯甲烷,继续搅拌5min;缓慢加入400.0g的甘氨酸甲酯盐酸盐,20~30℃搅拌30min,体系渐渐全部溶清。
[0054]
降温至0~5℃,缓慢滴加395.8g的氯乙酰氯,控温在0~5℃,30min滴完,有气泡产生。再用80.3g碳酸氢钠调至中性,控温0~5℃搅拌1h,将反应体系升温至25~30℃,搅拌1h,tlc监控(碘显色剂,二氯甲烷:甲醇=10:1,v/v),反应完全。该反应体系中,甘氨酸甲酯盐酸盐、氯乙酰氯与碳酸氢钠的摩尔比为1:1.1:2.5。
[0055]
分液,水相再用2.0l的二氯甲烷萃取1次。有机相合并,40~45℃减压浓缩,得到无色透明油状物(温度低于20℃时可固化),即为式ⅱ所示化合物,转化率为95%。
[0056]
所制备的化合物的质谱和核磁共振氢谱分别如图1和图2所示。
[0057]
本发明考察了碳酸氢钠的用量对于收率的影响,结果如表1所示。
[0058]
表1碳酸氢钠的用量对于收率的影响
[0059]
碳酸氢钠加入当量收料量(g)收率(%)纯度(%)1.19.4571.66/1.59.6673.25/2.010.8282.05/2.512.2793.0499.3402.612.2392.7499.150
[0060]
由表1中的数据可以看出,当碳酸氢钠的加入量为甘氨酸甲酯盐酸盐的2.5倍当量时,式ⅱ所示化合物的收率最大,且纯度最好,因此优选2.5倍当量的碳酸氢钠。
[0061]
本发明还考察了仅采用纯化水作为反应溶剂的反应效果:
[0062]
仅将纯化水替换上述反应步骤中的纯化水和二氯甲烷的混合物,且在滴加氯乙酰氯之前,采用碳酸氢钠使体系的ph值至6~7,其余与上述相同。
[0063]
上述条件下的反应转化率为77%。
[0064]
对比上述结果可以看出,本发明通过采用水和二氯甲烷的混合体系作为反应溶剂,可以使反应完毕的产物溶解到有机相中,从而使反应始终处于一种正向的促进状态,最终提升了转化率。且该反应体系不需要调控ph值,简化了工艺。
[0065]
二、制备式ⅲ所示化合物
[0066][0067]
氮气保护,将5.6l纯化水加入到20l反应釜中,然后加入535.9g的乙基黄原酸钠,25~35℃搅拌溶解,体系全部溶清。滴加式ⅱ所示化合物的水溶液(式ⅱ所示化合物的浓缩液和0.8l纯化水配制),控温25~35℃,30min滴完。
[0068]
控制温度在25~35℃,有大量密度低于水的固体(式ⅲ所示化合物)生成。
[0069]
过滤(出料时需要用氮气压)再用约3.0l纯化水洗瓶和淋洗,滤饼60℃鼓风干燥10~12h。
[0070]
收率:得到灰白色的固体:610.2g,收率76.2%。
[0071]
所制备的化合物的质谱和核磁共振氢谱分别如图3和图4所示。
[0072]
三、制备式ⅳ所示化合物
[0073][0074]
氮气保护,将1.8l的四氢呋喃加入到10l三口瓶中,降温至0~5℃,加入386.9g的叔丁醇钾(式ⅲ所示化合物与叔丁醇钾的摩尔比为1:3.0),白色悬浊液。往反应体系中滴加式ⅲ所示化合物的四氢呋喃溶液(600.0g式ⅲ所示化合物和3.0l四氢呋喃溶解配制),控温0~5℃,1h滴完。
[0075]
控温0~5℃,搅拌反应3~4h,tlc监控(石油醚:乙酸乙酯=2:1,uv=254nm)原料反应完全。
[0076]
反应完毕,将反应体系缓慢倒入预先冷却至0~5℃的稀盐酸(1.2l浓盐酸和2.4l纯化水配制)中,再缓慢加入2.4l的二氯甲烷,保持温度在0~5℃,继续搅拌1h。
[0077]
静置分液,易分层。有机相保留,水相再用1.2l二氯甲烷萃取。分液,合并有机相,2.4l饱和食盐水洗涤,分液,有机相40℃减压浓缩,得到棕红色油状物,即为式ⅳ所示化合物。
[0078]
所制备的化合物的核磁共振氢谱分别如图5所示。
[0079]
本步骤中反应溶剂和催化剂是按照下述实验确定的:
[0080]
1)反应溶剂的选择
[0081]
采用不同反应溶剂时的结果如表1中所示。
[0082]
纯度检测方法如下:
[0083]
供试品溶液:取本品(式ⅰ)适量,精密称定,加甲醇适量溶解并定量稀释制成每1ml中约含1mg的溶液。
[0084]
系统适用性溶液:取式ii、式iii、式iv、式i的甲酯、式i的乙酯对照品约2mg,精密称定,置20ml棕色量瓶中,加甲醇适量使溶解,用流动相稀释至刻度,摇匀,作为杂质贮备
液;取式i对照品约20mg,精密称定,置20ml量瓶中,加甲醇适量使溶解,精密加入各杂质贮备液0.1ml,用流动相稀释至刻度。
[0085]
色谱条件:用十八烷基硅烷键合硅胶为填充剂(ymc-pack ods-am,4.6
×
150mm,5μm或效能相当的色谱柱),以甲醇-水(25:75)(用磷酸调ph至2.5)为流动相a,乙腈为流动相b。检测波长为280nm和230nm(用于式i乙酯检测),流速为每分钟0.7ml,柱温为30℃,进样体积10μl。
[0086]
表2梯度程序
[0087][0088][0089]
系统适用性要求系统适用性溶液中各峰之间的分离度应符合要求。除溶剂峰外,出峰顺序如表3所示。
[0090]
表3出峰顺序
[0091][0092]
表4不同反应溶剂时的纯度和收率
[0093][0094]
由表4中的数据可以看出,四氢呋喃体系得到的产物纯度最好,且收率最高。
[0095]
2)碱种类的选择
[0096]
表5不同碱时的纯度和收率
[0097][0098]
由表5中的数据可以看出,230nm下,叔丁醇钾体系的杂质种类多于甲醇钠,且杂质较大;280nm下,叔丁醇钾体系下syp-3、syp-4、syp-4-im01三者纯度总和低于甲醇钠体系。
[0099]
四、制备式ⅰ所示化合物
[0100][0101]
将式ⅳ所示化合物的浓缩液(用少量二氯甲烷溶解)转入5l三口瓶中,然后加入3.9l浓盐酸(浓度为36~38%),加热蒸出二氯甲烷,然后加热至回流,体系回流反应20h;tlc监测(石油醚:乙酸乙酯=2:1,uv=254nm)原料反应完全。
[0102]
反应完毕,将反应体系降温至20~25℃,然后将反应体系缓慢倒入3.9l冷水中,加入3.9l乙酸乙酯搅拌溶解后分液,水相再用2.4l乙酸乙酯萃取一次,合并有机相,2.4l饱和食盐水洗涤,有机相浓缩至快干时加入0.6l正己烷带干,然后再加入2.4l正己烷室温(20~25℃)搅拌打浆1h。过滤,固体55℃鼓风干燥8~10h。
[0103]
得到黄色粉末状固体,即为式ⅰ所示化合物:303.54g,收率66.5%(以式ⅱ所示化合物计),其核磁共振氢谱如图6所示。
[0104]
本实施例制备的式ⅰ所示化合物的hplc谱图(检测方法同上)如图7所示,可以看出,按照本发明得到的式i样品纯度较好,中间态和酯交换杂质可以被很好得清除。
[0105]
本步骤中水解条件等反应条件是按照下述实验确定的:
[0106]
1)水解条件的选择
[0107]
表6不同水解条件时的反应结果
[0108][0109]
由表6中的数据可以看出,酸水解杂质相对大些,碱水解没有明显杂质,只是少量原料式iv未反应完全,接下来可以通过延长反应时间来使原料反应完全。
[0110]
2)反应时间及后处理的选择
[0111]
表7不同反应时间的反应结果
[0112]
反应时间式iv(%)式i(%)最大杂质(%)rrt≈0.6964h0.25795.9492.779
[0113]
表8不同后处理的反应结果
[0114]
反应时间式i(%)式iv(%)最大杂质(%)rrt≈0.696活性炭脱色98.5180.4990.233正己烷精制99.3740.1750.054
[0115]
由上述数据可以看出,碱性水解反应时间由2h延长至4h,式iv剩余量很少,但浓缩物中有一个2.779%的未知单杂,该杂质可以通过活性炭脱色或者正己烷精制除掉大部分,活性炭脱色前后无明显效果,综合考虑,碱水解反应4h,后处理得到的浓缩物正己烷打浆出料。
[0116]
碱水解放大备料过程中(式i-191029-2批),发现式i后处理浓缩甲醇过程中,式i部分被破坏分解,随后又用式i固体用甲醇溶解后,滴加30%氢氧化钠溶液,45~50℃保温反应破坏,点板发现式i大部分分解。
[0117]
表9式i-191029-2批固体液相数据
[0118][0119]
式i-191104批tlc板如图8所示。
[0120]
综合考虑,式i该步水解反应还是选择酸水解,接下来重新对氢溴酸、浓盐酸水解条件进行选择。
[0121]
3)酸水解的选择
[0122]
表10不同酸水解的反应结果
[0123]
反应溶剂后处理方式收料量(g)收率(%)式i纯度(%)氢溴酸浓缩物正己烷打浆7.18g77.0100浓盐酸浓缩物正己烷打浆7.28g78.1100
[0124]
采用氢溴酸和盐酸作水解的酸,得到的式i收率和质量基本一致,从物料成本的角度考虑,将水解的酸选为浓盐酸。
[0125]
4)浓盐酸水解时间的选择
[0126]
表11不同浓盐酸水解时间时的反应结果
[0127]
反应时间式i(%)式iv(%)式iii乙酯(%)20h97.15未检出未检出22h96.72未检出未检出
[0128]
反应时间20h和22h时,原料均能反应完全,22h时式i纯度略差,综合考虑,选择水解时间为20h。
[0129]
5)稀盐酸与弱碱水解的选择(目的是考察稀盐酸和弱碱的反应情况)
[0130]
表12稀盐酸与弱碱水解时的反应结果
[0131][0132]
由上表数据可知:6n盐酸低温下反应缓慢,杂质体系较杂;氢氧化锂水解,酰胺键断裂,均不宜采用。
[0133]
6)氢溴酸和浓盐酸水解选择(230nm监控syp-4-im05产生情况)
[0134]
表13氢溴酸和浓盐酸水解时的反应结果
[0135][0136]
氢溴酸水解时式i异丙酯杂质一开始就很大,浓盐酸逐渐变大,选择浓盐酸水解,但反应时需要液相进行监控。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1