一种粒径控制的罗沙司他原料药的结晶工艺的制作方法
1.本发明涉及一种粒径控制的罗沙司他原料药的结晶工艺,属于药物化学技术领域。
背景技术:
2.罗沙司他(roxadustat,fg-4592)是珐博进(fibrogen)公司开发的用于治疗肾性贫血的首个口服小分子 hif-phi,能够在氧分压正常的情况下抑制 hif-脯氨酰羟化酶,稳定hif-α,促内源性 epo 生成及改善铁吸收利用,综合调控促进红细胞生成。2018年12月,国家药品监督管理局通过优先审评审批程序批准罗沙司他胶囊上市,规格:20mg,50mg;适应症为用于慢性肾脏病透析患者的贫血治疗;2019年8月批准适用于非透析依赖性慢性肾病(ndd-ckd)的贫血治疗。
3.。
4.在原料药的生产中,粒径是一项不可或缺的指标。根据不同制剂溶出度的要求,原料药的粒径应该控制在不同的粒径段,以达到药效的最大化。原料药的粒径分布,可能会对终产品的性能如溶解度、生物利用度、含量均匀度和稳定性等产生显著的影响。此外,原料药的粒径分布也会影响药物的流动性、总混均匀度、可压性等可生产性,之后可能影响药物的安全性、有效性和质量。在进行仿制药一致性评价中,粒径是部分固体制剂的关键质量属性,若粒径偏大则溶出过慢无法与参比制剂一致,若粒径太小则易溶出过快。
5.目前,尚无针对罗沙司他原料药粒径控制方面的研究报道,原研专利cn103435546a和cn103539735a公布了一种罗沙司他的结晶工艺,其采用在水溶液中直接调酸析晶的方式得到。但该工艺方法得到的原料药粒径偏小,且分布不均,制剂溶出过快。
6.通常,原料药的粒径可以通过控制药物粉碎的参数或改善结晶工艺来控制。申请人经过研究发现,目前通过常规粉碎手段无法获得粒径合格的罗沙司他原料药:(1)通过盘齿磨无法将罗沙司他原料药的粒径粉碎到45 μm以下,粒径偏大;(2)通过气流粉碎则会将罗沙司他原料药的粒径粉碎到25 μm以下,粒径过细,溶出过快。
7.因此,目前急需一种符合制剂需求的粒径d(90)为25~45 μm的罗沙司他原料药的结晶工艺。。
技术实现要素:
8.本发明要解决的技术问题是如何提供一种符合制剂需求的粒径d(90)为25~45 μm的罗沙司他原料药的问题。
9.为解决上述技术问题,本发明提出的技术方案为一种粒径控制的罗沙司他原料药
的结晶工艺,包含以下步骤:(1)将罗沙司他(i)和水置于反应釜中,加入无机碱或无机碱的水溶液,罗沙司他(i)溶解,过滤,母液置于析晶釜中,升温至65~90 ℃,缓慢滴入第一部分乙酸水溶液,调节ph至6.4~6.7;(2)保持析晶釜温度65~90 ℃,一次性加入罗沙司他晶种,并快速加入第二部分乙酸水溶液,体系保持搅拌;(3)趁热离心,滤饼干燥后得到粒径控制的罗沙司他原料药。
10.本发明的结晶工艺制备得到的罗沙司他原料药的粒径d(90)为25~45 μm。
11.本发明的结晶工艺中,所述罗沙司他(i)还包含先用无机碱的水溶液溶清后过滤,再用乙酸水溶液重结晶提纯的步骤。
12.本发明的结晶工艺,所述无机碱选自氢氧化钠、氢氧化钾、氢氧化锂、碳酸钠或者碳酸钾。
13.本发明的结晶工艺,所述析晶釜温度优选为70~80 ℃。
14.本发明的结晶工艺,第一部分乙酸水溶液的加入量使得母液ph调节至6.4~6.7;相对于罗沙司他(i),第二部分乙酸水溶液的摩尔比为1.0∶1.0~2.0,优选为1.0∶1.5~2.0。
15.进一步的,罗沙司他(i)通过以下方法制备得到,化合物(ii)与甘氨酸或甘氨酸钠反应,制备得到罗沙司他(i)。
16.其中:r选自h或c
1-8
烷基,优选为h、甲基或者乙基。
17.本发明的实施例,化合物(ii)与甘氨酸钠反应,制备得到罗沙司他(i),其中r为甲基。
18.本发明的罗沙司他(i)也可以通过其他任何已经披露的制备方法制备得到,或者通过市场购买直接获得。
19.本发明的有益效果:本发明的结晶工艺可以制造出符合制剂需求的粒径d(90)为25~45 μm的罗沙司他原料药。且本发明的结晶工艺安全简单,收率高,适于工业化生产。
附图说明
20.图1、实施例1中不同粒径原料药的处方制剂累积溶出度图。
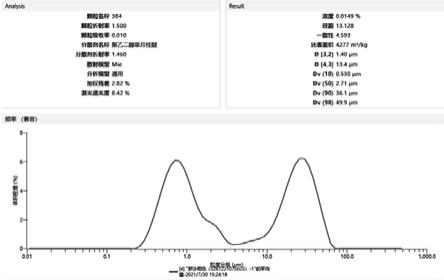
21.图2、实施例5中s26122107002s批次罗沙司他原料药粒径分布图。
具体实施方式
22.实施例1、不同粒径原料药的处方制剂溶出对比实验考察罗沙司他原料药粒径大小对胶囊溶出速率以及溶出终点的累积溶出度的影响。
23.1)通过调整结晶工艺,结合粉碎手段得到不同粒径的罗沙司他原料药,如表1所示:表1 。
24.2)将不同粒径的罗沙司他原料药按下述工艺分别制成胶囊:将罗沙司他与乳糖,微晶纤维素,交联羧甲基纤维素钠,聚维酮过锥式整粒机过筛混合,在湿法制粒锅中搅拌混合,之后在200 rpm搅拌,1500 rpm切割的条件下加入纯化水制粒,经流化床干燥,0.8 mm筛网整粒后,加入硬脂酸镁总混,灌装胶囊。
25.其中批次no. 008的罗沙司他原料药d(90) 小于10 μm,观察到其原料间的静电力严重,不易处理,未制备成胶囊。
26.3)将参比制剂和上述工艺方法制备得到的胶囊在转速为75 rpm,ph为6.8的介质中进行溶出实验,实验结果如表2所示:表2其中:参比制剂来源于国内上市产品爱瑞卓,法博进公司。
27.实验结论:当原料药粒径d(90)<10 μm时,原料间的静电力严重,不易处理;当原料药粒径d(90)=15.3 μm时,胶囊制剂溶出过快;当原料药粒径d(90)为25.6~45.7 μm时,胶囊制剂有较好的溶出行为,15 min累积溶出度≥85%,与参比制剂相似;
当原料药粒径d(90)≥65.3 μm时,溶出减缓,胶囊制剂15 min的累积溶出度<85%,与参比不相似;当原料药粒径d(90)≥93.3 μm时,胶囊制剂45 min累积溶出度<85%,未达到溶出终点;因此d(90)为25~45 μm是符合制剂需求的罗沙司他原料药粒径范围。
28.实施例2、结晶条件筛选(a)温度筛选结晶过程中,在相同的搅拌速度下,考察不同的滴加温度对粒径的影响。
29.将罗沙司他(i)和水置于反应釜中,加入氢氧化钠水溶液,罗沙司他(i)溶解,过滤,母液置于析晶釜中,升温至不同的温度,滴入第一部分乙酸水溶液,调节ph至6.6;加入罗沙司他晶种,并快速加入第二部分乙酸水溶液,体系保持搅拌;趁热离心,滤饼干燥得罗沙司他原料药,取样后检测粒径,实验结果如表3所示:表3 。
30.结论:结晶过程中,在相同的搅拌速度下,滴加温度越低,粒径越小,温度在65~90℃加入乙酸,粒径相差不大。
31.(b)ph值筛选将罗沙司他(i)和水置于反应釜中,加入氢氧化钠水溶液,罗沙司他(i)溶解,过滤,母液置于析晶釜中,升温70 ℃,滴入第一部分乙酸水溶液,调节母液ph至不同的范围;加入罗沙司他晶种,并快速加入第二部分乙酸水溶液,体系保持搅拌;趁热离心,滤饼干燥得罗沙司他原料药,取样后检测粒径,实验结果如表4所示:表4 。
32.结论:当体系ph为6.0左右时,体系搅拌约3~5min时,有大量固体析出;当体系ph为7.0左右时,晶种加至10%时,体系也仅刚刚出现浑浊;为了更好的控制析晶过程,保证在晶种存在下诱导析晶,因此优选控制体系ph为6.4~6.7。
33.(c)第二部分乙酸水溶液加入方式筛选将罗沙司他(i)和水置于反应釜中,加入氢氧化钠水溶液,罗沙司他(i)溶解,过滤,母液置于析晶釜中,升温80 ℃,滴入第一部分乙酸水溶液,调节ph至6.4;加入罗沙司他晶种,分两种方式加入第二部分乙酸水溶液,体系保持搅拌;趁热离心,滤饼干燥得罗沙司他原料药,取样后检测粒径,实验结果如表5所示:表5
ꢀ
。
34.结论:结晶过程中,第二部分乙酸的滴加方式对罗沙司他成品粒径有较大影响,当酸溶液滴加慢时,析出产品粒径较大,第二部分乙酸的滴加方式优选一次性快速加入。
35.(d)第二部分乙酸水溶液加入量筛选将罗沙司他(i)和水置于反应釜中,加入氢氧化钠水溶液,罗沙司他(i)溶解,过滤,母液置于析晶釜中,升温75 ℃,滴入第一部分乙酸水溶液,调节ph至6.5;加入罗沙司他晶种,并快速加入不同当量的第二部分乙酸水溶液,体系保持搅拌;趁热离心,滤饼干燥得罗沙司他原料药,取样后检测粒径,实验结果如表6所示:表6 。
36.结论:第二部分乙酸用量为1.5~2.0 eq.得到的粒径均符合要求,当第二部分乙酸用量为1.0 eq.时,结晶收率偏低;当第二部分乙酸用量超过2.0 eq.时,粒径偏大,因此第二部分乙酸水溶液用量优选1.5~2.0 eq.。
37.实施例3将5.3 kg 的4-羟基-1-甲基-7-苯氧基异喹啉-3-甲酸甲酯(化合物ii-1)、5.83 kg甘氨酸钠和51 kg甲醇置于反应釜回流反应12小时,降温过滤,滤饼用乙酸乙酯和水溶清后分液,水层升温至70 ℃后加入乙酸水溶液,降温后离心得到罗沙司他湿粗品。将罗沙司他湿粗品加入水中,加入氢氧化钠水溶液后将体系过滤,滤液升温至65~75 ℃后加入乙酸水溶液,趁热过滤后干燥得到罗沙司他(i)55.6 kg,纯度:99.5%,收率:90%。
38.实施例4反应釜1中825 g甘氨酸、2.33 kg碳酸钠、10 l水和10 l四氢呋喃后待用;反应釜2中加入14 l四氢呋喃、2.95 kg 4-羟基-1-甲基-7-苯氧基异喹啉-3-甲酸(化合物ii-2)、2.95 kg 1-羟基苯并三唑和2.58 kg的二异丙基乙胺,降温至-10 ℃,加入1.5 kg n,n'-二异丙基碳二亚胺,搅拌30分钟,将其加入至反应釜1,保温25~30 ℃反应1小时。加入纯化水40 kg,过滤,水相用盐酸调节ph 至2~3,过滤,滤饼干燥得罗沙司他(i)。
39.实施例5将5.3 kg罗沙司他(i)、53 kg纯化水置于反应釜中,加入氢氧化钠水溶液,罗沙司他(i)溶解,过滤,将母液置于析晶釜中,升温至70~80 ℃,缓慢滴入第一部分乙酸水溶液,调节ph至6.4~6.7;保持析晶釜温度70~80 ℃,一次性加入罗沙司他晶种0.26 kg,并快速加入第二部分乙酸水溶液,体系保持搅拌6小时;趁热离心,并使用10.6 kg的纯化水洗涤析晶釜和管道并转入离心机中,滤饼干燥后得到粒径控制的罗沙司他原料药5.4 kg,扣除晶种收率:97%。
40.本实验重复3次,得到的粒径控制的罗沙司他原料药的粒径分布,如表7所示:表7 。
41.本发明的结晶工艺可以制造出符合制剂需求的粒径d(90)为25~45 μm的罗沙司他原料药,且本发明的结晶工艺安全简单,收率高,重复性好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1