一种吲唑类衍生物的结晶形式及其制备方法与流程
1.本公开属于医药技术领域,涉及一种吲唑类衍生物的结晶形式及其制备方法,具体涉及化合物(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮的a、b、c、d、e、f、g、h、i、j、k晶型及其制备方法。
背景技术:
2.乳腺癌是女性最常见的恶性肿瘤之一,据2012年globalcan统计数据显示(ca cancer j clin 2015;65:87
–
108),全球一年约有170万新发癌症病例,52万死亡病例,无论发病率和死亡率都居女性恶性肿瘤首位。国家癌症中心发布的2017年《中国肿瘤登记年报》显示,乳腺癌居女性恶性肿瘤发病率首位,每年新发病例约27.9万,并以每年2%左右的速度递增。
3.约有70%的乳腺癌患者为雌激素受体(estrogen receptor,er)阳性乳腺癌,在这部分乳腺癌患者的治疗中,内分泌治疗(endocrine therapy)占有重要地位。内分泌治疗主要分三类,分别是芳香化酶抑制剂(aromatase inhibitor,ai),能够抑制雄激素转化为雌激素,降低体内雌激素的水平,选择性雌激素受体调节剂(selective estrogen receptor modulator,serm),拮抗雌激素受体的活性,和选择性雌激素受体降解剂(selective estrogen receptor degrader,serd),不仅可以拮抗雌激素受体的活性,还能够促进受体的降解(pharmacol ther.2017dec28)。虽然内分泌治疗是雌激素受体阳性乳腺癌的首选治疗,但约有30%接受辅助治疗的病人会发生复发,而几乎所有的转移性乳腺癌病人都会产生耐药而发生进展。对内分泌治疗产生耐药的机制主要分两类,一类集中在雌激素受体信号通路本身,包括编码雌激素受体的基因esr1的激活突变、扩增、与其他基因的融合,雌激素受体共调解因子和下游控制细胞周期因子的失调等,另一类机制包括与雌激素受体信号通路有交叉反应的信号通路的激活,如生长因子受体通路等(nat rev clin oncol.2015oct;12(10):573-83)。
4.2013年两项研究,在11~55%的接受过芳香化酶抑制剂治疗的雌激素受体阳性转移性乳腺癌病人中检测到了esr1基因突变,进一步研究发现突变受体可以不依赖雌激素发生磷酸化,发挥转录作用,使雌激素依赖的mcf7接种的肿瘤在体内可以不再依赖雌激素生长,而且突变受体会使serm他莫昔芬(tamoxifen)和serd氟维司群(fulvestrant)的活性降低。因此esr1基因突变可能是雌激素阳性乳腺癌发生耐药的机制之一(nat rev clin oncol.2015oct;12(10):573-83and nat genet 2013;45:1439
–
45)。在随后进行的多个研究中,都在雌激素受体阳性转移性乳腺癌病人中发现了一定比例的esr1基因突变,突变比例大约在30%左右。在bolero-2临床试验中发现,经过ais治疗后进展的雌激素受体阳性转移性乳腺癌病人的ctdna中有29%存在er y537s和er d538g突变。在依西美坦(exemestane)单用组,发生突变病人的无进展生存期(progression free survival,pfs)和总生存期(overall survival,os)都比没有发生突变的病人短[nat genet 2013;45:
1446
–
51]。
[0005]
综上所述,esr1基因突变大多发生在经过ais治疗而进展的转移性雌激素受体阳性乳腺癌病人中,这些病人对ais治疗不再敏感,因此需要开发针对esr1基因突变的雌激素受体拮抗剂。
[0006]
eisai公司开发的first-in-class的雌激素受体共价结合拮抗剂h3b-6545对野生型和突变型雌激素受体都有较强的抑制活性,且能够通过和受体的共价结合发挥更长时间的药效,目前正在进行临床一二期试验。目前公开的针对esr1基因突变的雌激素受体拮抗剂的专利有wo2016196346和wo2016196342。
[0007]
pct/cn2020/096744提供了一种吲唑类衍生物,其化学名为(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮(式i),为患者提供新的治疗选择。
[0008][0009]
本领域人员应知,药物的活性成分的晶型结构往往影响到该药物的理化稳定性。结晶条件及储存条件的不同有可能导致化合物的晶型结构的变化,有时还会伴随着产生其他形态的晶型。一般来说,无定型的药物产品没有规则的晶型结构,往往伴有产物稳定性较差,析晶较细,过滤较难,易结块,流动性差等缺陷。鉴于固体药物晶型及其稳定性在临床治疗中的重要性,深入研究化合物(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮晶型,对开发适合工业生产且生物活性良好的药物是具有重要意义。
技术实现要素:
[0010]
本公开提供了化合物(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮的a晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在6.274、7.099、16.432、18.079、18.557、19.747和20.345处有特征峰。
[0011][0012]
在一些实施方案中,所述式i化合物的a晶型在6.274、7.099、13.392、16.432、18.079、18.557、19.747、20.345、21.660和22.955处有特征峰。
[0013]
在一些实施方案中,所述式i化合物的a晶型在6.274、7.099、11.092、13.392、16.432、18.079、18.557、19.747、20.345、21.660、22.955、23.222和24.717处有特征峰。
[0014]
在一些实施方案中,所述式i化合物的a晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图1所示。
[0015]
本公开还提供了一种制备式i化合物a晶型的方法,包括:
[0016]
方法一:
[0017]
(a)将(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮与溶剂(i)混合,加热或搅拌溶解,所述溶剂(i)选自水、c
1-6
烷基醇、乙酸乙酯、乙腈、叔丁基甲基醚和甲苯中的至少一种,所述c
1-6
烷基醇选自甲醇、乙醇、异丙醇;
[0018]
(b)打浆析晶;
[0019]
或者,方法二:
[0020]
(a)将(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮与溶剂(ii)混合,加热或搅拌溶解,所述溶剂(ii)选自c
1-6
烷基醇、丙酮、丁酮、四氢呋喃、乙醚、二氯甲烷、1,4-二氧六环中的至少一种,所述c
1-6
烷基醇选自甲醇、乙醇、异丙醇,优选甲醇;
[0021]
(b)加入溶剂(iii),析晶;所述溶剂(iii)选自水、正庚烷、正己烷、环己烷、丙酮和异丙醚中的至少一种。
[0022]
本公开所述溶剂(i)、(ii)、(iii)所用体积(μl)可以为式i化合物质量(mg)的1-200倍,在非限制性实施方案中可以为1、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、200。
[0023]
本公开提供了式(i)化合物的b晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在11.890、15.735、16.572、17.336、19.659、19.998和21.700处有特征峰。
[0024]
在一些实施方案中,所述式i化合物的b晶型在8.551、11.890、15.735、16.572、17.336、19.659、19.998、20.631、21.700和23.203处有特征峰。
[0025]
在一些实施方案中,所述式i化合物的b晶型在6.591、8.551、11.890、14.295、15.735、16.572、17.336、19.659、19.998、20.631、21.700、23.203和28.468处有特征峰。
[0026]
在一些实施方案中,所述式i化合物的b晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图2所示。
[0027]
本公开提供了式i化合物的c晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在15.446、15.665、16.532、19.601、19.992、21.115和21.587处有特征峰。
[0028]
在一些实施方案中,所述式i化合物的c晶型在8.588、11.900、15.446、15.665、16.532、19.601、19.992、21.115、21.587和22.480处有特征峰。
[0029]
在一些实施方案中,所述式i化合物的c晶型在6.620、8.588、11.491、11.900、15.446、15.665、16.532、17.238、19.601、19.992、21.115、21.587和22.480处有特征峰。
[0030]
在一些实施方案中,所述式i化合物的c晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图3所示。
[0031]
本公开提供了式i化合物的d晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在6.221、15.841、16.399、18.174、18.691、21.979和24.165处有特征峰。
[0032]
在一些实施方案中,所述式i化合物的d晶型在6.221、12.438、14.574、15.841、16.399、18.174、18.691、21.979、24.165和25.187处有特征峰。
[0033]
在一些实施方案中,所述式i化合物的d晶型在6.221、11.129、12.438、13.377、14.574、15.841、16.399、18.174、18.691、19.744、21.979、24.165和25.187处有特征峰。
[0034]
在一些实施方案中,所述式i化合物的d晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图4所示。
[0035]
本公开提供了式i化合物的e晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在11.977、17.466、19.674、20.327和23.732处有特征峰。
[0036]
在一些实施方案中,所述式i化合物的e晶型在8.618、11.977、15.708、17.466、19.674、20.327、22.799和23.732处有特征峰。
[0037]
在一些实施方案中,所述式i化合物的e晶型在6.752、8.618、11.977、13.656、15.708、17.466、19.674、20.327、22.799、23.732和26.111处有特征峰。
[0038]
在一些实施方案中,所述式i化合物的e晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图5所示。
[0039]
本公开提供了式i化合物的f晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在17.203和20.283处有特征峰。
[0040]
在一些实施方案中,所述式i化合物的f晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图6所示。
[0041]
本公开提供了式i化合物的g晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在11.495、17.038、18.727、19.843和23.370处有特征峰。
[0042]
在一些实施方案中,所述式i化合物的g晶型在8.594、11.495、17.038、18.727、19.843、21.183、23.370和26.004处有特征峰。
[0043]
在一些实施方案中,所述式i化合物的g晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图7所示。
[0044]
本公开提供了式i化合物的h晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在15.354、17.963、19.806、21.022、21.440、22.453和26.973处有特征峰。
[0045]
在一些实施方案中,所述式i化合物的h晶型在15.354、16.019、17.963、19.806、21.022、21.440、22.453、22.871、23.900和26.973处有特征峰。
[0046]
在一些实施方案中,所述式i化合物的h晶型在6.487、11.402、15.354、16.019、17.963、19.806、20.509、21.022、21.440、22.453、22.871、23.900和26.973处有特征峰。
[0047]
在一些实施方案中,所述式i化合物的h晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图8所示。
[0048]
本公开提供了式i化合物的i晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在14.104、15.917、17.196、17.576、21.105、21.743和21.942处有特征峰。
[0049]
在一些实施方案中,所述式i化合物的i晶型在10.872、14.104、15.917、17.196、17.576、20.402、21.105、21.743、21.942和23.266处有特征峰。
[0050]
在一些实施方案中,所述式i化合物的i晶型在7.224、10.872、14.104、15.917、17.196、17.576、19.809、20.402、21.105、21.743、21.942、23.266和25.962处有特征峰。
[0051]
在一些实施方案中,所述式i化合物的i晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图9所示。
[0052]
本公开提供了式i化合物的j晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在8.748、11.641、14.428、16.940、18.776、20.758和23.482处有特征峰。
[0053]
在一些实施方案中,所述式i化合物的j晶型在8.748、11.641、14.428、15.106、
16.940、17.622、18.776、20.758、22.519和23.482处有特征峰。
[0054]
在一些实施方案中,所述式i化合物的j晶型在8.748、11.641、13.213、14.428、15.106、16.940、17.622、18.776、19.521、20.338、20.758、22.519和23.482处有特征峰。
[0055]
在一些实施方案中,所述式i化合物的j晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图10所示。
[0056]
本公开提供了式i化合物的k晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在15.776、17.035、18.873、20.048、20.748、21.753和23.526处有特征峰。
[0057]
在一些实施方案中,所述式i化合物的k晶型在8.768、11.736、14.482、15.776、17.035、18.873、20.048、20.748、21.753和23.526处有特征峰。
[0058]
在一些实施方案中,所述式i化合物的k晶型在6.450、8.768、11.736、14.482、15.258、15.776、17.035、18.873、20.048、20.748、21.753、23.526和26.129处有特征峰。
[0059]
在一些实施方案中,所述式i化合物的k晶型以衍射角2θ角度表示的x-射线粉末衍射图谱如图11所示。
[0060]
在一些实施方案中,本公开所述晶型制备方法还包括过滤、洗涤或干燥等步骤。
[0061]
本公开还提供了一种由前述任意一种晶型制备得到药物组合物。
[0062]
本公开还提供了一种药物组合物,含有前述式i化合物的晶型或由前述方法制备得到的晶型,和任选自药学上可接受的载体、稀释剂或赋形剂。
[0063]
本公开还提供了一种药物组合物的制备方法,包括将前述式i化合物的晶型或前述方法制备得到的晶型与药学上可接受的载体、稀释剂或赋形剂混合的步骤。
[0064]
本公开还提供了前述式i化合物的晶型或由前述方法制备的式i化合物晶型或前述组合物或前述制备方法制备得到的组合物在制备雌激素受体调节剂中的用途。
[0065]
本公开还提供了前述式i化合物的晶型或由前述方法制备的式i化合物晶型或前述组合物或前述制备方法制备得到的组合物在制备预防和/或治疗雌激素受体介导的或依赖性的疾病或病症的药物中的用途,优选所述雌激素受体介导的或依赖性的疾病或病症为癌症,更优选为乳腺癌、卵巢癌、子宫内膜癌、前列腺癌或子宫癌;最优选乳腺癌。
[0066]
本公开所述的“2θ或2θ角度”是指衍射角,θ为布拉格角,单位为
°
或度;每个特征峰2θ的误差范围为
±
0.20,可以为-0.20、-0.19、-0.18、-0.17、-0.16、-0.15、-0.14、-0.13、-0.12、-0.11、-0.10、-0.09、-0.08、-0.07、-0.06、-0.05、-0.04、-0.03、-0.02、-0.01、0.00、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.20。
[0067]
本公开中所述的“差示扫描量热分析或dsc”是指在样品升温或恒温过程中,测量样品与参考物之间的温度差、热流差,以表征所有与热效应有关的物理变化和化学变化,得到样品的相变信息。
[0068]
本公开所述晶型的制备方法中还包括过滤,干燥等步骤。
[0069]
本公开中所述干燥温度一般为25℃~100℃,优选40℃~70℃,可以常压干燥,也可以减压干燥。
[0070]“药物组合物”表示含有一种或多种本文所述化合物或其生理学上可药用的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
附图说明
[0071]
图1:式i化合物a晶型的xrpd图谱。
[0072]
图2:式i化合物b晶型的xrpd图谱。
[0073]
图3:式i化合物c晶型的xrpd图谱。
[0074]
图4:式i化合物d晶型的xrpd图谱。
[0075]
图5:式i化合物e晶型的xrpd图谱。
[0076]
图6:式i化合物f晶型的xrpd图谱。
[0077]
图7:式i化合物g晶型的xrpd图谱。
[0078]
图8:式i化合物h晶型的xrpd图谱。
[0079]
图9:式i化合物i晶型的xrpd图谱。
[0080]
图10:式i化合物j晶型的xrpd图谱。
[0081]
图11:式i化合物k晶型的xrpd图谱。
具体实施方式
[0082]
以下将结合实施例或实验例更详细地解释本公开,本公开中的实施例或实验例仅用于说明本公开中的技术方案,并非限定本公开中的实质和范围。
[0083]
本公开中所用试剂可通过商业途径获得。
[0084]
本公开中实验所用仪器的测试条件:
[0085]
1、差示扫描量热仪(differential scanning calorimeter,dsc)
[0086]
仪器型号:mettler toledo dsc 3+
[0087]
吹扫气:氮气;氮气吹扫速度:50ml/min
[0088]
升温速率:10.0℃/min
[0089]
温度范围:25-300℃
[0090]
2、x-射线粉末衍射谱(x-ray powder diffraction,xrpd)
[0091]
仪器型号:bruker d8 discover x-射线粉末衍射仪
[0092]
射线:单色cu-kα射线
[0093]
扫描方式:θ/2θ,扫描范围(2θ范围):3~50
°
[0094]
电压:40kv,电流:40ma
[0095]
3、热重分析仪(thermogravimetric analysis,tga)
[0096]
仪器型号:mettler toledo tga2
[0097]
吹扫气:氮气;氮气吹扫速度:50ml/min
[0098]
升温速率:10.0℃/min
[0099]
温度范围:25-300℃
[0100]
4、有关物质及含量检测:高效液相色谱检测;仪器型号:agilent 1260dad或thermo ultimate 3000;色谱柱:phenomenex kinetex evoc18 4.6*250mm,5um;流动相a:kh2po4,流动相b:乙腈;流速:1.0ml/min;柱温:40℃;检测波长:214nm。
[0101]
5、纯化化合物采用的柱层析的洗脱剂的体系和薄层色谱法的展开剂体系包括:a:二氯甲烷/甲醇体系,b:正己烷/乙酸乙酯体系
[0102]
6、化合物的结构是通过核磁共振(nmr)或/和质谱(ms)来确定的。nmr位移(δ)以
10-6
(ppm)的单位给出。nmr的测定是用bruker avance-400核磁仪,测定溶剂为氘代二甲基亚砜(dmso-d6)、氘代氯仿(cdcl3)、氘代甲醇(cd3od),内标为四甲基硅烷(tms)。
[0103]
ms的测定用agilent 1200/1290dad-6110/6120quadrupole ms液质联用仪(生产商:agilent,ms型号:6110/6120quadrupole ms)、waters acquity uplc-qd/sqd(生产商:waters,ms型号:waters acquity qda detector/waters sq detector)、thermo ultimate 3000-q exactive(生产商:thermo,ms型号:thermo q exactive)。
[0104]
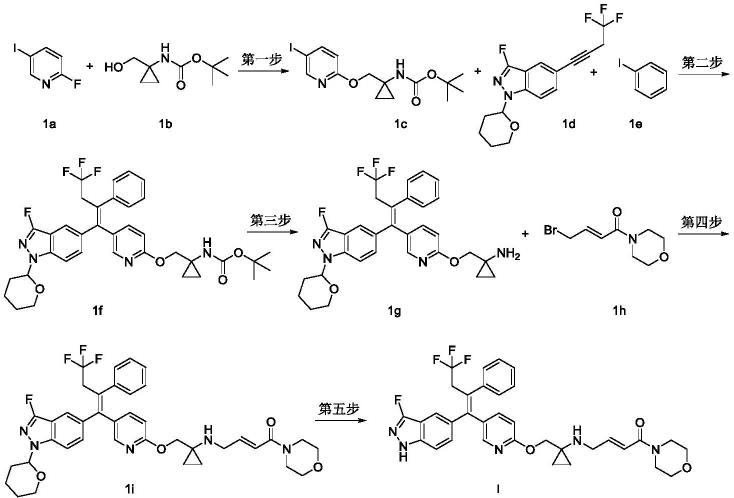
实施例1:式i化合物(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮的制备
[0105][0106]
第一步:(1-(((5-碘吡啶-2-基)氧基)甲基)环丙基)氨基甲酸叔丁酯1c
[0107]
将氢化钠(0.4g,10.7mmol)溶于n,n-二甲基甲酰胺(20ml),室温下加入1-(羟甲基)环丙基氨基甲酸叔丁酯1b(1.0g,5.3mmol,采用公知的方法“journal of organic chemistry,2002,67(11),3965-3968”制备而得),加完后缓慢加入2-氟-5-碘吡啶1a(1.8g,8.0mmol)。室温搅拌2小时后停止反应。反应液减压浓缩,残余物用薄层色谱法以展开剂体系b纯化所得残余物,得到标题产物1c(2.4g),产率:86%。
[0108]
ms m/z(esi):391.0[m+1]
[0109]
第二步:(z)-(1-(((5-(4,4,4-三氟-1-(3-氟-1-(四氢-2h-吡喃-2-基)-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基甲酸叔丁酯1f
[0110]
将3-氟-1-(四氢-2h-吡喃-2-基)-5-(4,4,4-三氟丁-1-炔-1-基)-1h-吲唑1d(1.8g,5.5mmol,采用专利申请wo2018098305中说明书第84页的实施例3公开的方法制备得到)溶于甲基四氢呋喃(40ml),加入双联频哪醇硼酸酯(1.7g,6.6mmol),四三苯基膦铂(137mg,0.1mmol),抽换氩气3次,升温至85℃搅拌3小时。冷却至室温,加入化合物1c(2.0g,5.2mmol),双三苯基磷二氯化钯(741mg,1.1mmol),碳酸铯(3.6g,11.0mmol)和水(1ml),室温搅拌过夜。加入碘苯1e(1.2g,6.1mmol),氢氧化钾(1.5g,27.6mmol),抽换氩气3次,升温至85℃搅拌2小时后冷却至室温停止反应。反应液减压浓缩,残余物用薄层色谱法以展开剂
体系b纯化所得残余物,得到标题产物1f(3.0g),产率:88%。
[0111]
ms m/z(esi):667.2[m+1]
[0112]
第三步:(z)-(1-(((5-(4,4,4-三氟-1-(3-氟-1-(四氢-2h-吡喃-2-基)-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)-1-胺1g
[0113]
将化合物1f(1.8g,2.7mmol)溶于二氯甲烷(15ml),加入三氟乙酸(3ml),室温搅拌反应5小时,停止反应。反应液减压浓缩,用饱和碳酸氢钠溶液(100ml)将反应液调至ph 8左右,无水硫酸钠干燥,过滤,滤液减压浓缩,得到标题产物1g粗品(1.4g),产率:89%,产物不经纯化直接进行下一步反应。
[0114]
(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1-(四氢-2h-吡喃-2-基)-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮1i
[0115]
将化合物1g(1.7g,2.8mmol)溶于n,n-二甲基甲酰胺(20ml),室温下加入二异丙基乙胺(1.1g,8.5mmol),然后加入(e)-4-溴-1-吗啡啉基丁-2-烯-1-酮1h(0.7g,2.8mmol,采用专利申请us2016347717中说明书第65页的实施例15公开的方法制备得到),搅拌反应2小时。停止并冷却反应,加入饱和碳酸氢钠溶液(15ml),用乙酸乙酯萃取(50ml
×
2),合并有机相,用饱和氯化钠溶液洗涤(50ml
×
4),无水硫酸钠干燥,过滤,滤液减压浓缩,用薄层色谱法以展开剂体系a纯化所得残余物,得到标题产物1i(1.3g),产率:65%。
[0116]
ms m/z(esi):720.2[m+1]
[0117]
第五步:(e)-1-吗啉基-4-((1-(((5-((z)-4,4,4-三氟-1-(3-氟-1h-吲唑-5-基)-2-苯基丁-1-烯-1-基)吡啶-2-基)氧基)甲基)环丙基)氨基)丁-2-烯-1-酮i
[0118]
将化合物1i(2.0g,2.8mmol)溶于甲醇(5ml),加入盐酸(12n,10ml)搅拌反应3小时。停止并冷却反应,浓缩反应液,加入饱和碳酸氢钠溶液(15ml),用二氯甲烷萃取(50ml
×
4),合并有机相,依次用水洗(30ml
×
3),饱和氯化钠溶液洗涤(50ml),无水硫酸钠干燥,过滤,滤液减压浓缩,用薄层色谱法以展开剂体系a纯化所得残余物,得到标题产物1(1.3g),产率:73%。
[0119]
ms m/z(esi):636.2[m+1];
[0120]1h nmr(400mhz,cd3od)7.65(d,2h),7.49(d,1h),7.30-7.22(m,7h),6.82-6.76(m,1h),6.60-6.52(m,2h),4.15(s,2h),3.62-3.39(m,12h),0.76-0.64(m,4h)。经x-射线粉末衍射检测,该产物晶型为无定型。
[0121]
测试例1:式i化合物对雌激素受体报告基因活性的抑制作用的测定
[0122]
1、实验目的
[0123]
本实验的目的是测试本公开化合物对雌激素受体报告基因活性的抑制作用,根据ic
50
大小评价化合物的体外活性。
[0124]
2、实验方法
[0125]
表达雌激素受体反应元件控制的荧光素酶报告基因ere-luc(金唯智生物科技有限公司合成)的mcf7细胞(atcc,htb-22)mcf7/ere-luc使用含有10%胎牛血清和500μg/ml g418的mem(ge healthcare,sh30024.01)培养基进行培养。实验第一天,使用含有10%活性炭处理的胎牛血清(biosun,bs-0004-500)的mem不完全培养基将mcf7/ere-luc细胞以30,000个/孔的密度种于96孔板,每孔100μl细胞悬液,放置37℃,5%co2的细胞培养箱培养过
atg ctg;r-cag cat ctc cag cag cag gcc ata gag ggg cac cac gtt。将突变体esr1的cdna克隆至目标慢病毒载体pcdh-cmv-mcs-ef1-puro上。然后将带有突变体esr1基因序列的慢病毒质粒以及慢病毒包装质粒通过lipofectamine 3000transfection reagent(thermofisher scientific,catil3000075)转染到hek-293t细胞(atcc,crl-3216)中。转染后48小时,将带有病毒的培养基上清过滤、超速离心获得病毒沉淀,用适量的培养基重悬溶解后,加入到mcf7细胞(atcc,htb-22)中,并加入终浓度为8μg/ml的polybrene孵育过夜。转染两天后,在细胞培养液中加入1μg/ml的嘌呤霉素进行抗性筛选,约两周后得到能够稳定表达erαy537s与erαd538g突变体的mcf7细胞系。
[0141]
细胞增殖抑制实验
[0142]
将表达erα突变体的mcf7细胞用含有10%胎牛血清的mem(ge healthcare,sh30024.01)完全培养基进行培养。实验第一天,使用完全培养基将细胞以3,000个/孔的密度种于96孔板,每孔100μl细胞悬液,放置37℃,5%co2的细胞培养箱培养过夜。第二天吸掉培养基,每孔更换为135μl含有2%胎牛血清的mem不完全培养基,同时每孔加入15μl用不完全培养基配制的不同浓度的待测化合物,化合物的终浓度是从100nm开始进行4倍梯度稀释的9个浓度点,设置含有0.5%dmso的空白对照,放置37℃,5%co2的细胞培养箱培养144小时。第八天,取出96孔细胞培养板,每孔加入150μlluminescent cell viability assay(promega,g7573),室温放置10分钟后,使用多标记微孔板酶标仪(perkinelmer,victor 3)读取发光信号值,用graphpad prism软件根据化合物的浓度和发光信号值计算化合物抑制活性的ic
50
值,本公开化合物对表达erα突变体mcf7 d538g细胞增殖的抑制效应的ic
50
为2nm,对表达erα突变体mcf7 erαy537s细胞增殖的抑制效应的ic
50
为3nm,结果显示本公开化合物对表达erα突变体mcf7细胞增殖具有明显的抑制作用。
[0143]
测试例4、本公开化合物的balb/c裸鼠药代动力学测试
[0144]
1、摘要
[0145]
以balb/c裸鼠为受试动物,应用lc/ms/ms法测定了balb/c裸鼠灌胃给予式i化合物后不同时刻血浆中的药物浓度。研究本公开式i化合物在balb/c裸鼠体内的药代动力学行为,评价其药动学特征。
[0146]
2、试验方案
[0147]
2.1试验药品
[0148]
式i化合物。
[0149]
2.2试验动物
[0150]
balb/c裸鼠36只,雌性,平均分成4组,9只为1组,购自杰思捷实验动物有限公司提供,动物生产许可证号scxk(沪)2013-0006。
[0151]
2.3药物配制
[0152]
称取适量样品,加5%体积的dmso、5%体积的吐温80和90%体积的生理盐水配制成0.1mg/ml的无色澄清透明液体。
[0153]
2.4给药
[0154]
禁食一夜后分别灌胃给药,给药体积0.2ml/10g,式i化合物给药剂量为30mg/kg。
[0155]
3、操作
[0156]
balb/c裸鼠36只,雌性;禁食一夜后灌胃给药。于给药后0.5,1.0,2.0,4.0,6.0,
8.0,11.0,24.0h采血0.1ml(每个时间点3只动物),置于肝素化试管中,3500rpm离心10min分离血浆,于-20℃保存。测定不同浓度的药物灌胃给药后裸鼠血浆中的待测化合物含量:取给药后各时刻的裸鼠血浆25μl,加入内标溶液喜树碱40μl(100ng/ml),乙腈200μl,涡旋混合5分钟,离心10分钟(4000转/分钟),血浆样品取上清液0.5μl进行lc/ms/ms分析。
[0157]
4、balb/c裸鼠药代动力学参数结果
[0158]
本公开式i化合物的药代动力学参数如下:
[0159][0160]
结论:本公开化合物的药代吸收良好,具有明显的药代吸收效果。
[0161]
测试例5、雌激素受体erα野生型和erαy537s突变型共价修饰生物学评价
[0162]
1、实验目的
[0163]
本实验的目的是测定本公开化合物对雌激素受体erα野生型和erαy537s突变型的共价修饰作用。
[0164]
2、实验方法
[0165]
雌激素受体erα野生型和erαy537s突变型的配体结合区域(lbd,ligand binding domain,aa296-554)由大肠杆菌表达并纯化。将2μm erα野生型或erαy537s突变型蛋白和10μm化合物加入到含有50mm tris-hcl,ph7.5,150mm nacl,1mm tcep,5%glycerol的缓冲液中混匀,置于4℃孵育24小时后,进行高分辨质谱检测。或者将1μm erα野生型或erαy537s突变型蛋白和3μm化合物加入到含有50mm tris-hcl,ph7.5,150mm nacl,1mm tcep,5%glycerol的缓冲液中混匀,置于37℃孵育15分钟后,进行高分辨质谱检测。在质谱检测结果图谱中分子量为蛋白与化合物之和的峰即为共价修饰产物,通过计算未结合化合物蛋白与总蛋白的比值算出共价修饰的百分比。
[0166]
共价修饰24小时后共价修饰比:
[0167][0168]
结论:测试化合物对erα野生型或erαy537s突变型蛋白均具有很好的共价修饰作用。
[0169]
实施例2:式i化合物a晶型的制备
[0170]
将式i所示化合物(1.5g,2.36mmol)加入10ml丁酮,加热至回流,搅拌澄清,再加入10ml正己烷,清液回流1分钟,缓慢降温到60℃时析出白色固体,自然降到室温,搅拌16小时后形成白色浑浊液,过滤,收集滤饼,真空干燥,得到标题产物(1.0g,收率:66.7%)。
[0171]
经x-射线粉末衍射检测,将该产物定义为晶型a,xrd谱图如图1,特征峰如表1所示。
[0172]
dsc谱图显示吸热峰峰值188.26℃;tga谱图显示25℃-90℃失重0.58%。
[0173]
dvs检测显示在正常存储条件下(即25℃、60%rh),该样品吸湿增重约为0.05%;
在加速实验条件(即70%rh),吸湿增重约为0.06%;在极端条件下(90%rh),吸湿增重约为0.16%。dvs检测后复测晶型,晶型未转变。
[0174]
表1
[0175][0176][0177]
实施例3:式i化合物a晶型的制备
[0178]
将式i所示化合物(10mg,15.73μmol)加入0.5ml乙酸乙酯和正己烷(v/v=1:2),溶清,后补加1滴正己烷逐渐析出白色固体,在室温下搅拌16小时,过滤,收集滤饼,真空干燥。得到标题产物(5mg,收率:50%)。
[0179]
经x-射线粉末衍射检测,该产物为晶型a。
[0180]
实施例4:式i化合物a晶型的制备
[0181]
将式i所示化合物(10mg,15.73μmol)加入0.5ml甲基叔丁基醚,搅拌溶清,后逐渐形成白色浑浊液,过滤,收集滤饼,真空干燥。得到标题产物(5mg,收率:50%)。
[0182]
经x-射线粉末衍射检测,该产物为晶型a。
[0183]
实施例5:式i化合物a晶型的制备
[0184]
将式i所示化合物(10mg,15.73μmol)加入0.5ml异丙醇溶剂,溶清,搅拌16小时仍
然溶清,加入0.5ml的正己烷搅拌4小时,析出白色固体,过滤,收集滤饼,真空干燥,得到标题产物(5mg,收率:50%)。
[0185]
经x-射线粉末衍射检测,该产物为晶型a。
[0186]
实施例6:式i化合物a晶型的制备
[0187]
将式i所示化合物(10mg,15.73μmol)加入到0.5ml乙醇和乙醚(v/v=1:1)中,溶清,搅拌16小时仍然溶清,加入0.5ml的正己烷搅拌4小时,析出白色固体,过滤,收集滤饼,真空干燥,得到标题产物(5mg,收率50%)。
[0188]
经x-射线粉末衍射检测,该产物为晶型a。
[0189]
实施例7:式i化合物a晶型的制备
[0190]
将式i所示化合物(10mg,15.73μmol)加入0.5ml甲苯,溶清,后逐渐形成白色浑浊液,过滤,收集滤饼,真空干燥,得到标题产物(5mg,收率50%)。
[0191]
经x-射线粉末衍射检测,该产物为晶型a。
[0192]
实施例8:式i化合物a晶型的制备
[0193]
将式i所示化合物(50mg,78.66μmol)加入到100ml的三口瓶中,氩气保护下,缓慢加入2ml乙腈,加热至60℃,溶清,搅拌1小时,后冷却至室温搅拌16小时,过滤,收集滤饼,真空干燥,得到标题产物(40mg,收率:80%)。
[0194]
经x-射线粉末衍射检测,该产物为晶型a。
[0195]
实施例9:式i化合物b、c晶型的制备
[0196]
将式i所示化合物粗品(16.7g,26.3mmol),用高效液相色谱法(waters-2767,洗脱体系:碳酸氢铵,水,乙腈)纯化,制备液冻干处理,得到标题产物(7.3g,收率:43.7%)。
[0197]
经x-射线粉末衍射检测,该产物定义为晶型b,如图2所示,特征峰如表2所示。dsc谱图显示吸热峰峰值124.58℃,185.66℃,放热峰峰值149.54℃、161.02℃;tga谱图显示25℃-200℃失重0.73%。
[0198]
dvs检测显示在正常存储条件下(即25℃、60%rh),该样品吸湿增重约为1.68%;在加速实验条件(即70%rh),吸湿增重约为2.25%;在极端条件下(90%rh),吸湿增重约为2.79%。在0%-95%rh湿度变化过程中,该样品的解吸附过程与吸附过程不重合。dvs检测后复测晶型,晶型发生转变,定义为晶型c,如图3,特征峰如表3所示。
[0199]
表2
[0200]
峰序号2θ值[
°
或度]相对强度%14.2944.926.59117.038.55120.3411.89032.1513.2746.4614.2959.7715.735100.0816.57281.7917.33629.31019.65953.4
1119.99851.41220.63123.21321.70072.11423.20317.31524.0787.61625.0038.51725.6553.91826.5922.81927.3994.42028.46811.42130.7294.8
[0201]
表3
[0202][0203][0204]
实施例10:式i化合物d晶型的制备
[0205]
20mg式i化合物加入2ml异丙醚,在50℃下打浆1天得产物,该产物定义为晶型d。其xrpd谱图如图4所示,其特征峰位置如下表4所示。dsc谱图显示吸热峰峰值181.86℃;tga谱图显示25℃-200℃失重1.34%。
[0206]
dvs检测显示在正常存储条件下(即25℃、60%rh),该样品吸湿增重约为0.12%;在加速实验条件(即70%rh),吸湿增重约为0.15%;在极端条件下(90%rh),吸湿增重约为
0.25%。dvs检测后复测晶型,晶型未转变。
[0207]
表4
[0208]
峰序号2θ值[
°
或度]相对强度%16.22158.0211.12912.9312.43820.3413.37713.0514.57424.3615.84140.2716.39958.0818.174100.0918.69169.41019.74413.41121.97945.11223.23814.41324.16545.71425.18717.51526.5066.91627.16611.61730.75412.0
[0209]
实施例11:式i化合物e晶型的制备
[0210]
10mg式i化合物加入1ml水中,打浆3天得产物。该产物定义为晶型e。其xrpd谱图如图5所示,其特征峰位置如下表5所示。dsc谱图显示吸热峰峰值144.77℃、183.08℃、184.90℃,放热峰值157.32℃;tga谱图显示25℃-210℃失重1.58%。
[0211]
表5
[0212]
峰序号2θ值[
°
或度]相对强度%16.7529.528.61814.0311.97737.5413.6568.8515.70816.4617.466100.0719.67460.4820.32761.5922.79916.91023.73220.01126.1115.51229.0033.4
[0213]
实施例12:式i化合物f晶型的制备
[0214]
10mg式i化合物加入1ml二氯甲烷/甲醇至溶清,慢挥发得产物。该产物定义为晶型f。其xrpd谱图如图6所示,其特征峰位置如下表6所示。dsc谱图显示吸热峰峰值68.81℃、127.47℃、182.91℃、184.73℃,放热峰值152.65℃;tga谱图显示25℃-210℃失重2.76%。
[0215]
表6
[0216]
峰序号2θ值[
°
或度]相对强度%117.20377.8%220.283100.0%
[0217]
实施例13:式i化合物g晶型的制备
[0218]
10mg式i化合物加入100μl 1,4-二氧六环溶解,再加入10%水/丙酮搅拌,挥发析晶得产物。该产物定义为晶型g。其xrpd谱图如图7所示,其特征峰位置如下表7所示。dsc谱图显示吸热峰峰值128.10℃、148.77℃、184.85℃,放热峰值155.46℃;tga谱图显示25℃-200℃失重1.56%。
[0219]
表7
[0220]
峰序号2θ值[
°
或度]相对强度%18.59415.8211.49538.2317.038100.0418.72724.8519.84325.4621.18319.1723.37029.0826.00410.0
[0221]
实施例14:式i化合物h晶型的制备
[0222]
10mg式i化合物加入1.0ml 10%水/异丙醇溶剂溶清,慢挥发得产物。该产物定义为晶型h。其xrpd谱图如图8所示,其特征峰位置如下表8所示。dsc谱图显示吸热峰峰值72.79℃、122.09℃、184.13℃、185.35℃,放热峰值149.48℃、160.14℃;tga谱图显示25℃-210℃失重3.22%。
[0223]
表8
[0224]
峰序号2θ值[
°
或度]相对强度%16.48711.628.1448.838.7978.3411.40216.0514.0975.7615.35497.8716.01918.1817.96333.0919.80626.9
1020.50913.21121.02264.91221.44031.21322.453100.01422.87117.11523.90017.31624.7443.61725.1647.81826.4087.51926.97333.82028.3119.82131.01811.5
[0225]
实施例15:式i化合物i、j晶型的制备
[0226]
20mg式i化合物加入2ml甲醇中搅拌溶清,并进行慢挥发得产物,该产物定义为晶型i,其xrpd谱图如图9所示,其特征峰位置如下表9所示。继续干燥产物后,测得产物晶型j,其xrpd谱图如图10所示,其特征峰位置如下表10所示。dsc谱图显示吸热峰峰值133.86℃、152.75℃、185.41℃;tga谱图显示25℃-200℃失重0.99%。
[0227]
表9
[0228]
[0229][0230]
表10
[0231]
峰序号2θ值[
°
或度]相对强度%18.74839.8210.1925.2311.64152.6413.21313.4514.42843.8615.10626.9716.94076.5817.62234.9918.776100.01019.52119.71120.33817.41220.75851.71322.51919.81423.48257.41526.0854.61626.6545.6
1727.83611.71828.3175.9
[0232]
实施例16:式i化合物k晶型的制备
[0233]
20mg式i化合物加入2ml 10%水/丙酮,常温下打浆得产物,该产物定义为晶型k,其xrpd谱图如图11所示,其特征峰位置如下表11所示。dsc谱图显示吸热峰峰值117.29℃、130.13℃、185.36℃,放热峰值144.64℃、156.64℃;tga谱图显示25℃-200℃失重1.72%。
[0234]
表11
[0235]
峰序号2θ值[
°
或度]相对强度%16.45012.928.76834.0311.73641.5413.2276.1514.48235.9615.25819.8715.77650.1817.035100.0918.87384.81020.04893.51120.74884.71221.75351.51323.52654.41425.0867.91526.12912.8
[0236]
实施例17:式i化合物a晶型影响因素实验
[0237]
取前述实施例制备得到的式i化合物晶型a于开口的称量瓶中,考察在高温(40℃、60℃)、光照(4500lx
±
500lx)、高湿(90%
±
5%、75%
±
5%)条件下样品的稳定性,取样考察期为30天,结果如下表。
[0238]
表12
[0239][0240][0241]
实验结果显示式i化合物的a晶型在上述条件下具有良好的物理化学稳定性。
[0242]
实施例18:式i化合物a晶型长期加速条件下稳定性研究
[0243]
参照前述实施例制备得到式i化合物晶型a进行6个月的长期(25℃、60%rh)、加速(40℃、75%rh)稳定性考察,结果如下表。
[0244]
表13
[0245][0246]
实验结果显示式i化合物的a晶型样品长期(25℃、60%rh)、加速(40℃、75%rh)条件下放置6m,物理化学稳定性良好。
[0247]
实施例19:式i化合物d晶型影响因素实验
[0248]
将游离态晶型d敞口平摊放置,分别考察在光照(4500lux)、高温(40℃、60℃)、高湿(rh75%、rh 92.5%)条件下样品的稳定性,取样考察期为1个月,结果如下表。
[0249]
表14
[0250][0251][0252]
实验结果显示式i化合物的d晶型在上述条件下具有良好的物理化学稳定性。
[0253]
实施例20:式i化合物d晶型长期加速条件下稳定性研究
[0254]
将游离态d晶型分别放置25℃,60%rh和40℃,75%rh条件考察其稳定性,结果如下表。
[0255]
表15
[0256][0257]
实验结果显示式i化合物的d晶型样品长期(25℃、60%rh)、加速(40℃、75%rh)条件下放置6m,物理化学稳定性良好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1