LMH细胞克隆株及利用LMH细胞克隆株全悬浮培养禽腺病毒-4型的方法与流程
xf-lmh在病毒的全悬浮培养中的应用。
9.优选地,所述全悬浮培养为全悬浮无血清培养。
10.本发明还提供所述lmh细胞克隆株qyhzz-xf-lmh在病毒疫苗制备中的应用。
11.以上所述的病毒为lmh细胞克隆株qyhzz-xf-lmh敏感的动物病毒。
12.优选地,所述病毒为禽腺病毒。更优选为禽腺病毒-4型。
13.进一步地,本发明提供一种禽腺病毒-4型的全悬浮培养方法,所述方法包括:将所述lmh细胞克隆株qyhzz-xf-lmh接种于全悬浮无血清培养基中,再接种禽腺病毒-4型毒株进行全悬浮无血清培养,获得病毒液。
14.以上所述方法中,接种禽腺病毒-4型毒株时的细胞密度为(3-4)
×
106个细胞/ml。
15.以上所述方法中,禽腺病毒-4型毒株的接种量优选为1-2%(体积比)。
16.以上所述方法中,使用的全悬浮无血清培养基可为任意适用于lmh全悬浮培养的全悬浮无血清培养基。优选为全悬浮无血清培养基lmh-susⅲ。
17.上述细胞和病毒培养的条件如下:温度36.8-37℃,溶氧45-55%,搅拌转速60-90rpm,ph 7.0-7.2。
18.在接种前,所述lmh细胞克隆株qyhzz-xf-lmh经复苏和逐级放大培养。
19.上述培养中,在细胞活率降至70%以下,细胞密度降至2
×
106个细胞/ml以下时,结束培养。
20.上述培养可在生物反应器中进行。
21.上述收集的病毒液经灭活处理(例如:于37℃甲醛溶液灭活24h)后,再经乳化后制备为禽腺病毒-4型疫苗。
22.作为本发明的优选方案,所述方法包括如下步骤:
23.(1)种毒制备:采用所述lmh细胞克隆株qyhzz-xf-lmh进行禽腺病毒-4型毒株的传代并制备种毒,种毒的tcid
50
≥10
8.0
/0.1ml;
24.(2)qyhzz-xf-lmh细胞培养:将所述qyhzz-xf-lmh细胞复苏并进行摇瓶全悬浮无血清传代培养,将传代的细胞在生物反应器中接种于全悬浮无血清培养基中进行逐级放大培养,细胞的初始接种密度优选为(1.2-1.5)
×
106个细胞/ml,于温度36.8-37℃、溶氧45-55%、搅拌转速60-90rpm、ph 7.0-7.2条件下进行培养,得到qyhzz-xf-lmh细胞种子液;
25.(3)禽腺病毒-4型的培养:将步骤(2)得到的qyhzz-xf-lmh细胞种子液在生物反应器中接种于全悬浮无血清培养基中,细胞初始接种密度为(1.2-1.5)
×
106个细胞/ml,培养70-75h,按照1-2%(体积比)的接种量接种步骤(1)制备的种毒,接种病毒时的细胞密度为(3-4)
×
106个细胞/ml;培养条件如下:温度36.8-37℃、溶氧45-55%、搅拌转速60-90rpm、ph 7.0-7.2,接种病毒后继续培养60-72h,培养结束后,收集病毒液。
26.以上步骤(2)中,先将qyhzz-xf-lmh细胞复苏后,于摇瓶中进行全悬浮无血清传代培养,再依次于1000ml摇瓶、50l生物反应器和250l生物反应器中进行逐级放大培养。
27.本发明的有益效果在于:本发明提供的lmh细胞克隆株qyhzz-xf-lmh能够在全悬浮无血清培养过程中快速增殖,保持较高的细胞活率,在接种禽腺病毒后,能够使得病毒快速繁殖,在较短时间内获得较高的病毒效价,病毒的效价高于鸡胚培养病毒。由该细胞株制备得到的禽腺病毒抗原的质量较好,经动物免疫和攻毒保护试验证明具有较高的免疫原性、保护力和安全性。
28.基于上述全悬浮lmh细胞克隆株qyhzz-xf-lmh,本发明还提供禽腺病毒-4型的全悬浮培养方法,该方法能够满足大规模病毒扩增生产的需要,可适用于禽腺病毒-4型及其疫苗的规模化生产,有利于降低生产成本和劳动强度,提高生产效率和产能,为细胞源疫苗产业化和规模化生产提供了技术基础。
附图说明
29.图1为本发明实施例1中lmh健康细胞贴壁培养24h的显微镜下形态(100
×
)。
30.图2为本发明实施例1中lmh健康细胞贴壁培养48h的显微镜下形态(100
×
)。
31.图3为本发明实施例1中贴壁培养的lmh健康细胞接种fadv-4型后培养48h的显微镜下形态(100
×
)。
32.图4为本发明实施例1中贴壁培养的lmh健康细胞接种fadv-4型后培养72h的显微镜下形态(100
×
)。
33.图5本发明实施例2中全悬浮qyhzz-xf-lmh健康细胞培养24h的显微镜下形态。
34.图6为本发明实施例2中全悬浮qyhzz-xf-lmh健康细胞培养72h的显微镜下形态。
35.图7本发明实施例2中全悬浮qyhzz-xf-lmh健康细胞接种fadv-4型后培养72h的显微镜下形态。
36.图8为本发明实施例3中250l规模生物反应器的禽腺病毒-4型全悬浮培养生产工艺流程示意图,其中,lmh全悬浮细胞为qyhzz-xf-lmh细胞。
37.图9为本发明实施例3中三批250l生物反应器qyhzz-xf-lmh健康细胞的生长增殖趋势曲线,其中,xf-lmh001、xf-lmh002、xf-lmh003分别代表三批250l生物反应器培养。
38.图10为本发明实施例3中250l生物反应器全悬浮qyhzz-xf-lmh健康细胞培养24h的显微镜下形态。
39.图11为本发明实施例3中250l生物反应器全悬浮qyhzz-xf-lmh健康细胞培养72h的显微镜下形态。
40.图12为本发明实施例3中250l生物反应器全悬浮qyhzz-xf-lmh健康细胞接种fadv-4型后培养72h的显微镜下形态。
具体实施方式
41.以下实施例用于说明本发明,但不用来限制本发明的范围。
42.以下实施例中使用的全悬浮无血清培养基和贴壁培养基均购自苏州沃美生物科技有限公司。
43.以下实施例中使用的禽腺病毒-4型毒株为i群4型禽腺病毒毒株zmxzav-4株,该毒株已于2017年6月19日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,),分类命名为禽腺病毒4型,保藏编号为cgmcc no.14296,该毒株已在专利申请cn 109207436 a中公开。
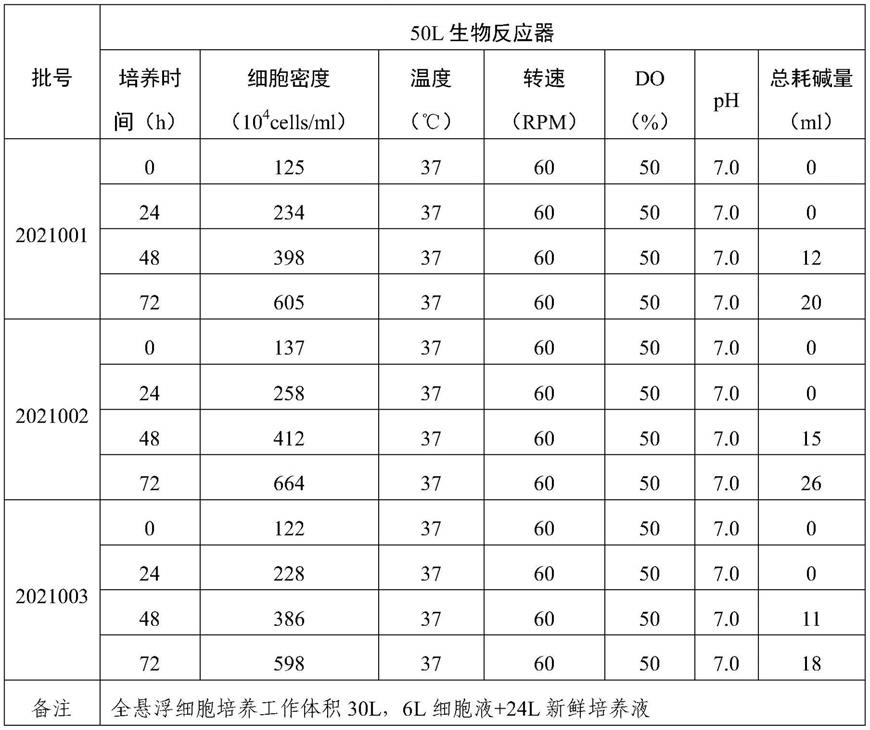
44.实施例1 lmh贴壁细胞株种子库的建立
45.将生长状态良好的100%汇合的贴壁lmh细胞以1:3或1:4比例进行分散,如此进行贴壁细胞传代培养,并对不同代次的贴壁细胞进行液氮冻存,建立贴壁细胞株种子库。lmh
细胞贴壁培养24h、48h的形态分别如图1和图2所示。
46.将长满单层的贴壁lmh细胞,按2%接毒比例接种禽腺病毒4型(fadv-4型),接毒后每日观察病变,病变达到90%以上收获病毒液。lmh细胞接种fadv-4型后培养48h、72h的形态分别如图3和图4所示。
47.实施例2全悬浮lmh细胞的驯化和种子库的建立
48.将禽腺病毒4型(fadv-4型)在lmh细胞上进行适应性驯化传代培养和单克隆筛选,并建立全悬浮细胞种子库,为生物反应器规模化培养提供细胞种子库,其中,全悬浮驯化和筛选的主要流程如下:
49.将贴壁lmh细胞逐步降低血清含量(血清含量分别为10%、8%、6%、4%、2%、1%)到无血清贴壁培养(贴壁培养基为ccm-1),采用有限稀释法和无血清全悬浮培养基lmh-susⅲ进行lmh细胞逐的全悬浮无血清单细胞驯化,并筛选适应禽腺病毒4型扩增的全悬浮细胞株。
50.经驯化和筛选,最终获得一株适应禽腺病毒-4型扩增的全悬浮lmh细胞克隆株,命名为qyhzz-xf-lmh,该细胞克隆株以120~150
×
104个细胞/ml初始密度分散后于5%co2、37℃、140rpm条件下培养72h后,细胞密度可达500~600
×
104个cells/ml,细胞活率98%以上。
51.qyhzz-xf-lmh全悬浮培养24、72h的形态分别如图5和图6所示。
52.lmh细胞克隆株qyhzz-xf-lmh已于2021年12月9日保藏于中国典型培养物保藏中心(简称cctcc,地址:中国武汉,武汉大学,邮编430072),分类命名为悬浮的鸡肝癌细胞qyhzz-xf-lmh,保藏编号为cctcc no:c2021162。
53.将悬浮细胞qyhzz-xf-lmh按照比例为1:3或1:4进行分散并传代,每传2~3代进行离心换液。如此进行全悬浮细胞传代培养,并对不同代次的全悬浮细胞进行液氮冻存,建立全悬浮细胞株种子库。
54.将密度达500~600
×
104个细胞/ml xf-lmh细胞,按2%接毒比例接种禽腺病毒4型,接毒后每日取样进行细胞密度和活率分析,观察细胞病变,病变达到90%以上收获病毒液。
55.全悬浮qyhzz-xf-lmh细胞接种fadv-4型后培养72h的形态如图7所示。病毒效价tcid
50
/0.1ml≥10
8.5
。
56.实施例3 250l生物反应器规模的禽腺病毒4型全悬浮培养工艺建立
57.利用lmh细胞克隆株qyhzz-xf-lmh在250l生物反应器中进行禽腺病毒-4型的全悬浮无血清培养,具体包括如下步骤(流程示意图如图8所示):
58.1、采用三角透气摇瓶复苏实施例2得到的适应禽腺病毒-4型的全悬浮细胞qyhzz-xf-lmh:使用的培养基为全悬浮无血清培养基lmh-susⅲ,培养条件如下:37℃,5%co2,培养时间为48h;
59.2、对步骤1经复苏后的全悬浮细胞qyhzz-xf-lmh采用摇瓶进行传代培养:使用的培养基为全悬浮无血清培养基lmh-susⅲ,培养条件如下:37℃,5%co2,培养时间为48h;
60.3、采用三角摇瓶以全悬浮细胞qyhzz-xf-lmh进行禽腺病毒-4型毒株的传代并制备种毒:使用的培养基为全悬浮无血清培养基lmh-susⅲ,培养条件如下:37℃,5%co2,培养时间为48h,制备得到的种毒的tcid
50
≥10
8.0
/0.1ml;
61.4、50l生物反应器(工作体积30l)qyhzz-xf-lmh全悬浮细胞培养:将步骤2得到的qyhzz-xf-lmh细胞接种于50l生物反应器中进行全悬浮培养,培养基为全悬浮无血清培养基lmh-susⅲ,细胞初始密度120-150
×
104个cells/ml,设定反应器培养参数如下:温度:37℃,do:50%,转数:80rpm,ph:7.0,细胞培养周期72h;
62.5、250l生物反应器(工作体积125l)qyhzz-xf-lmh全悬浮细胞培养:将步骤4得到的qyhzz-xf-lmh细胞接种于250l生物反应器中进行全悬浮培养,培养基为全悬浮无血清培养基lmh-susⅲ,细胞初始密度120-150
×
104个cells/ml,设定反应器培养参数如下:温度:37℃,do:50%,转数:60rpm,ph:7.0,细胞培养周期72h;
63.6、250l生物反应器(工作体积250l)qyhzz-xf-lmh全悬浮细胞接毒(fadv-4型)培养:将步骤5得到的qyhzz-xf-lmh细胞接种于250l生物反应器中,培养基为全悬浮无血清培养基lmh-susⅲ,细胞初始接种密度为120-150
×
104个细胞/ml,细胞培养72h后,接种步骤3制备的禽腺病毒-4型种毒,病毒接种时补加培养液总体积50%的全悬浮无血清培养基lmh-susⅲ,接种病毒时的细胞密度为300-350
×
104个细胞/ml,按照体积比2%接种病毒的种毒液,设定反应器培养参数如下:温度:37℃,do:50%,转数:80rpm,ph:7.1;
64.7、每隔24h取样进行细胞密度和活力分析,细胞活率降到70%以下,细胞密度降到100
×
104个cells/ml以下,结束培养(接种病毒后继续培养72h),收获病毒液(250l)。
65.将病毒液于37℃灭活24h,得到病毒抗原,将抗原离心,经乳化制备疫苗,进行动物免疫试验和动物攻毒保护试验。
66.以上培养过程中,三批250l生物反应器qyhzz-xf-lmh健康细胞生长增殖趋势曲线如图9所示,培养24h和72h的全悬浮细胞qyhzz-xf-lmh的形态如图10和图11所示。qyhzz-xf-lmh细胞培养72h,细胞密度是初始密度的5倍以上,细胞活率99%以上,细胞生长良好。
67.在接种病毒后,培养72h的全悬浮细胞qyhzz-xf-lmh的形态如图12所示。三批培养的病毒效价tcid
50
/0.1ml≥10
8.5
。
68.全悬浮细胞qyhzz-xf-lmh的培养过程中主要指标监测结果如表1、表2、表3、表4和表5所示(三批实验的结果)。
69.表1三批50l生物反应器qyhzz-xf-lmh全悬浮细胞培养过程
[0070][0071]
表2三批250l生物反应器qyhzz-xf-lmh全悬浮细胞培养过程
[0072][0073]
表3三批250l生物反应器qyhzz-xf-lmh全悬浮细胞接毒后(fadv-4型)培养过程
[0074]
[0075][0076]
表4 250l反应器全悬浮细胞和毒种情况
[0077][0078]
表5 250l反应器全悬浮细胞接毒后tcid
50
检测结果
[0079][0080]
实施例4新流腺三联灭活疫苗的制备
[0081]
将实施例3经全悬浮培养得到的三批禽腺病毒4型病毒液制备为新流腺三联灭活疫苗(批号分别为2021001、2021002、2021003),具体方法如下:
[0082]
1、疫苗制备
[0083]
(1)油相制备:取矿物油95份,硬脂酸铝1份,在油相制备管中混合均匀并加热至80℃后,再加入5份司本-80,至温度达到115℃时维持30分钟,冷却后完成油相制备。
[0084]
(2)水相制备:将灭活的新城疫病毒液、禽流感病毒液、实施例3制备的禽腺病毒-4型毒液以1:1:1比例混合,得到混合抗原液,取混合抗原液95份,灭菌的吐温-80 5份,充分混匀,使吐温-80完全溶解。
[0085]
(3)乳化:取油相2份放入乳化罐中,开动电机,慢速转动搅拌,同时徐徐加入水相1份后,再以3500r/min搅拌5分钟,10000r/min搅拌5分钟,完成乳化制备,乳化后,取疫苗
10ml加入离心管中,以3000r/min离心15分钟,管底析出的水相应不超过0.5ml。
[0086]
2、疫苗的性状
[0087]
外观:乳白色均匀乳剂。
[0088]
剂型:油包水型,取一清洁吸管,吸取少许疫苗滴于清洁冷水表面,除第一滴外,均未扩散。
[0089]
稳定性:吸取疫苗10ml加入离心管中,以3000rpm离心15分钟,管底析出的水相不超过0.5ml。
[0090]
3、无菌检查
[0091]
按现行《中国兽药典》附录进行检验,结果表明,无菌生长。
[0092]
实施例5新流腺三联灭活疫苗的安全检验
[0093]
对实施例4制备的新流腺三联灭活疫苗进行安全性检测,具体方法如下:
[0094]
1、最小使用日龄、不同途径一次单剂量接种的安全性试验
[0095]
将70只1日龄spf鸡,三批新流腺灭活疫苗(批号为2021001、2021002、2021003)分别进行肌肉注射和皮下注射各10只spf鸡,剂量为1ml/只;对照组10只sfp鸡颈部皮下注射灭菌生理盐水,剂量为1ml/只。各组鸡在相同条件下分别饲养管理,连续观察14日;如有死亡,将死亡的鸡逐一剖检,观察内脏有无病变;观察活鸡有无不良反应。接种后14天将存活的鸡全部剖杀,观察内脏有无病变。
[0096]
最小使用日龄不同途径单剂量接种的安全试验结果如表6所示。
[0097]
表6最小使用日龄、不同途径单剂量接种的安全性试验结果
[0098][0099]
2、单剂量重复接种的安全性试验
[0100]
将40只14日龄spf鸡,分成4组,每组10只,采用三批新流腺灭活疫苗(批号为2021001、2021002、2021003)对其中3组分别进行皮下注射各10只spf鸡,剂量为1ml/只;对照组10只sfp鸡颈部皮下注射灭菌生理盐水,剂量为1ml/只。各组鸡在相同条件下分别饲养管理,连续观察14日;如有死亡,将死亡的鸡逐一剖检,观察内脏有无病变;观察活鸡有无不良反应。接种后14天将存活的鸡全部剖杀,观察内脏有无病变。对鸡只的局部炎症、组织病变等进行评判。第二次免疫后14天将存活的鸡全部剖杀,观察内脏有无病变。
[0101]
单剂量重复接种安全性试验的结果见表7。
[0102]
表7单剂量重复接种的安全性试验结果
[0103][0104]
实施例6新流腺三联灭活疫苗的免疫效力检验和攻毒保护试验
[0105]
对实施例4制备的新流腺三联灭活疫苗进行安全性检测,具体方法如下:
[0106]
1、免疫效力检验:取14日龄spf鸡50只,每只免疫0.3ml疫苗,免疫后28天采血测琼扩抗体,并进行后续的动物攻毒保护试验。
[0107]
免疫效力检验结果如表8和表9所示,结果表明,新流腺三联灭活疫苗免疫鸡后,可产生较高水平的抗体。
[0108]
表8新流腺三联灭活疫苗的禽腺病毒-4型免疫效力检验结果
[0109][0110]
注:表8中,
“‑”
代表无抗体琼扩效价。
[0111]
表9新流腺三联灭活疫苗的新城疫病毒(nd)和禽流感病毒(h9)免疫效力检验结果
[0112][0113]
2、攻毒保护试验(fadv-4型)
[0114]
攻毒剂量:0.2ml(组织毒攻毒用毒琼扩效价≥1:1)或0.5ml(细胞毒攻毒用毒tcid
50
/0.1ml≥10
8.0
)。
[0115]
攻毒方法:分别颈部皮下注射fadv-i群4型株原病毒液,攻毒后48h-144h观察鸡死亡情况,对照鸡应至少9只发病,相对保护率应不低于80%。
[0116]
结果如表10所示,三批疫苗对于fadv-i群4型株具有100%的保护力。
[0117]
表10禽腺病毒-4型病毒攻毒结果
[0118][0119]
注:表10中,死亡鸡标记为“dn”,其中n代表死亡天数;
“‑”
未死亡。
[0120]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1