一种制备双链RNA的方法
一种制备双链rna的方法
技术领域
1.本发明属于核酸技术领域,具体涉及一种制备双链rna的方法。
背景技术:
2.双链rna(dsrna)结构在自然界中普遍存在,其常作为长链rna,如核糖体rna(rrna)、信使rna(mrna)以及类病毒(一种仅由rna组成的病毒)等的一小部分。长度为几百~几千个碱基对的长双链rna,如pre-mirna(其由mrna的一部分和与其互补的rna链组成)和双链rna病毒等也被发现广泛存在。其中最有前景的应用之一是以小干扰rna(small interfering rnas,sirnas)为工具来发挥作用的rna干扰(rna interference, rnai)技术,其是用于转录后基因调控的有力工具(nature genet,2002,32,107-108;embo j,2001,20,6877-6888;proc natl acad sci usa,2002,99,9942-9947.)。近年来rnai技术被尝试应用于农业(病虫害防治)(insect sci,2013,20,4-14;pest manag sci,2016,72,801-809)和水产养殖业(虾病防治)(j biotechnol,2020,321,48-56;j virol methods,2013,188,64-69;iop conf ser earth environ sci,2020,584,012051.)中。但目前dsrna的大量、高效合成尚未实现,这在很大程度上制约了rnai农(渔)药、rnai疫苗的推广使用。因此,亟需建立一种可满足dsrna高效、低成本、简易制备的方法,以满足科研需求和市场需求。
3.dsrna在体内/外均可制备(anal bioanal chem,2018,410,3239-3252)。体内制备(重组过表达)时需要先将用于转录的模板重组到质粒载体当中,然后将其导入大肠杆菌(e.coli)(j. biotechnol,2020,321,48-56;j virol methods,2013,188,64-69;iop conf.ser.earth environ sci,2020,584,012051.)、植物细胞(uk patent,no.wo2020183416-a1,sep17,2020)或哺乳动物细胞(methods mol biol,2013,942,291-314.)中进行诱导培养。整个过程需经历表达载体构建、转染、细胞培养、裂解、产物提取纯化(需去除宿主自身的rrna等杂质)等诸多步骤,较为繁琐;并且胞内机质复杂,产物易被核酸酶降解的同时生物安全性也难以保证。目前这些体内制备技术尚处于研究阶段,未被用于实际生产。
4.体外制备方法可分为化学合成和酶法合成(转录)两大类。化学合成法(固相合成)存在合成步骤繁琐(embo j,2001,20,6877-6888;nat struct biol,1998,5,203-212;isr j chem,2013,53,326-349)、产物纯度较差(anal biochem,2001,298,196-206;chin j biotech,2018,34,664)、难以实现大量合成、生物安全性较差(使用多种有机试剂)(chin j biotech,2018,34,664)等诸多缺陷。相较化学合成而言,酶法因在液相环境中进行而更易于实现大规模生产,且由于在整个过程中没有涉及到有害有机试剂,因此产品的安全性更好(isr j chem,2013,53,326-349;chimia,2005,59,812-816)。近些年的研究还表明酶法可满足带修饰rna的合成,发展前景良好(org biomol chem,2018,16,5800-5807;molecules,2020,25,5492)。按照模板为线性还是环状,现有dsrna酶法合成方法可分为线性转录和滚环转录。线性转录可分为两种情况,一种是用两种线性双链dna模板分别转录出sense链和antisense链,然后退火杂交获得dsrna(nucleic acids res,2002,30,e46;
nucleic acids res,2003,31,e38);另一种是直接用含有回文序列的线性双链dna模板制备得到同时含有sense序列和antisense序列的发卡型结构的rna,再由体内的dicer酶加工处理得到目标sirna(mol biotechnol,2017,59,73-83)。上述两种方法中所用到的线性双链dna模板中均包含启动子序列,且为了能高效起始转录,有些模板中启动子下游的最初两个碱基须为gg,要想得到精确的产物,后续需酶切去除多余转录出的cc(nucleic acids res,2003,31,e38)。由此可见上述线性转录法均较繁琐,且效率低下,难以满足实际应用需求。相较线性转录而言,滚环转录的效率要高出许多。现有滚环转录法也可分为两类。一类是直接用一个环状单链dna(哑铃环(oligonucleotides,2006,16,353-363)或“y”型单环(nano lett,2018,18,4279-4284))同时转录出sense序列和antisense序列。这种方法虽较简便,但需对模板进行加长设计,这样就会额外转录出无用序列,需后续纯化。还有一类是用两种环状单链dna分别转录出sense序列和antisense序列,再退火杂交得到目的dsrna(sci rep,2017,7,10005;adv sci (weinh),2017,4,1600523)。采用这种方法时,由于环状单链dna的转录效率易受模板序列和自身二级结构的影响(j am chem soc,1995,117,7818-7819;proc natl acad sci usa,2002,99,54-59;nucl acids res,2013,41,2552-2564;nucl acids res,2014,42,10596-10604;science advance today,2015,25226.),可能会发生不对称转录(一个环状单链dna转录效率高,一个转录效率低),使得产物为dsrna和ssrna(单链rna)的混合物。由此可见现有方法均难以实现dsrna的大量、高效合成。
技术实现要素:
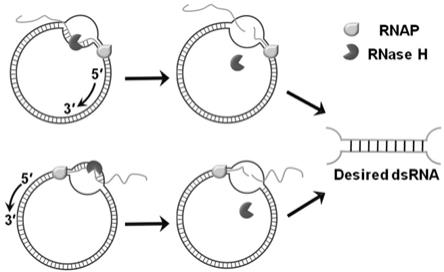
5.针对现有双链rna制备方法步骤繁琐、效率低、成本高昂且难以实现大量制备的问题,本发明提供了一种制备双链rna的方法,针对要制备的双链rna,先设计一个含有5-15bp泡状结构(bubble)的、无启动子的环状双链dna模板;然后在体系中同时加入上述环状双链dna模板、rna聚合酶、核糖核酸酶h、ntps、rna酶抑制剂、无机焦磷酸酶进行转录。在转录过程中rna聚合酶进行无偏好性的高效双向滚环转录,rnase h则在该模板中泡状结构处未杂交的dna部分的辅助下及时实现对转录产物的酶切。在rna聚合酶、核糖核酸酶h和含泡状结构无启动子环状双链dna模板三者之间的默契配合下实现了目的双链rna产物的一步、高效、大量制备。该方法非常简便高效,低成本,可操作性较强,适用于工业化大规模生产。
6.本发明采用的技术方案如下:一种制备双链rna的方法,包括以下步骤:步骤一,设计并制备环状双链dna模板,所述环状双链dna模板含有不互补的泡状结构部分和互补部分,不含启动子序列,所述互补部分与要制备的双链rna长度相同且序列相同,序列中t对应u,所述泡状结构处于环状双链dna模板中互补部分的两端,泡状结构的长度为5-15bp,泡状结构的两条链之间连续互补的碱基不超过2个;步骤二,将制备的环状双链dna模板纯化,去除环状双链dna模板中混杂着的线性单链dna;步骤三,将纯化的环状双链dna模板、rna聚合酶、核糖核酸酶h、ntps、rna酶抑制剂、无机焦磷酸酶和相应的rna聚合酶缓冲液混合,进行转录,所述rna聚合酶为 t7 rna聚合酶、sp6 rna聚合酶或者t3 rna聚合酶,在转录过程中rna聚合酶进行无偏好性的高效双向滚环转录,核糖核酸酶h则在环状双链dna模板中泡状结构处单链dna的辅助下及时实现
对含有重复序列的转录产物的酶切,获得满足要求的目的双链rna单体。
7.泡状结构的上、下链的序列相同或不同均可。泡状结构处的上、下链中均应避免形成发卡结构或polya、polyt等序列。
8.泡状结构尺寸应在5-15碱基之间,否则会导致双链rna的产量降低。
9.不考虑环状双链dna模板制备的难易程度,所述本发明可制备的双链rna产物单体的长度为70bp以上;优选70-1000bp,再优选为90-437bp,更优选为96-278bp。
10.进一步的,当所述环状双链dna模板长度小于90bp时,采用一段法,设计一条成环前体线性链制备环状单链dna,环状单链dna和线性单链dna退火杂交后加入dna连接酶和对应的连接酶缓冲液进行连接反应;当所述环状双链dna模板长度大于90bp时,采用一锅法或分步法制备环状单链dna,然后将环状单链dna和其互补链所对应的多条短dna链混合,退火杂交后加入dna连接酶和对应的连接酶缓冲液进行连接反应;所述环状单链dna和线性单链dna杂交后,线性单链dna的两端距离泡状结构的边缘应大于15 nt。设计成环前体线性链时,需避免将断点设计在泡状结构处,否则在制备环状双链dna模板的退火杂交过程中无法形成nick(连接酶发挥连接作用所必需的结构)。
11.进一步的,所述制备环状双链dna模板的方法,当所述环状双链dna模板长度为70-90bp时,采用一步法环化制备所述环状单链dna;当所述环状双链dna模板长度大于90bp时,设计多段40-90nt的5
¢
磷酸化的dna片段和相应的splint,采用一锅法,进行一步或分步连接反应制备环状单链dna或线性单链dna。
12.进一步的,所述退火杂交条件为:先在90℃下保温1-3min,然后以0.1℃/s的速度降温至20-25℃并保温10min。
13.进一步的,当使用t4dna连接酶和相应的t4dna连接酶缓冲液时,在4-37℃范围内保温2-24h进行连接;当使用taqdna连接酶和相应的taqdna连接酶缓冲液时,在45-80℃范围内保温2-24h进行连接。
14.进一步的,当使用t4dna连接酶时,采用终浓度为0.05-1
×
的缓冲液,当缓冲液浓度为1
×
时,其组成为:40mm tris-hcl,10mm mgcl2,10mm dtt,500μm atp(ph 7.8@25℃);当使用taq dna连接酶时,采用终浓度为1
×
的缓冲液,其组成为:20mm tris-hcl,25mm kac,10mm mg(ac)2,10mm dtt,1.0mm nad,0.1%triton x-100(ph 7.6@25℃)。
15.进一步的,所述步骤二的环状双链dna模板的纯化过程中,用exo i和exo iii共同酶切去除环状双链dna模板中混杂着的所有线性单链dna,exo i的酶切反应采用终浓度为0.5
×
的缓冲液,其组成为:33.5mm glycine-koh(ph 9.5@25℃),3.35mm mgcl2,0.5mm dtt;exo iii的酶切反应采用终浓度为0.5
×
的缓冲液,其组成为:33mm tris-hcl(ph 8.0@30℃),0.33mm mgcl2。
16.进一步的,所述步骤三在37℃下恒温反应0.5-72h制备双链rna。
17.进一步的,双链rna的制备过程中,rna聚合酶的转录反应采用终浓度为1
×
的缓冲液,其组成为:40mm tris-hcl(ph 7.9@25℃),6.0mm mgcl2,10mm dtt,10mm nacl和2mm spermidine。
18.有益效果:本发明制备双链rna的方法中所用到的转录模板中无需引入启动子序列,因而转
录产物中不会引入由启动子转录产生的多余序列,极大方便了后续的产物纯化过程。
19.双向转录效率相同,避免了非对称转录导致的一条rna链过量的情况的发生,特别适合制备双链rna。
20.相较于现有的双链rna制备方法,本发明所涉及的制备双链rna的方法非常简便、易操作,无需严苛条件,仅需扩大反应体系、延长转录时间、供给转录体系充足的ntps即可实现目的双链rna产物的大量制备。
21.利用本方法制备得到的双链rna本身纯度较高(仅首尾两端的2-8nt为单链rna),若对产物纯度要求较高,后续可用rnase a/rnase 1/rnase t1等酶切去除首尾两端的单链rna,用dnase i等dna酶去除环状双链dna模板,用抽提醇沉、hplc等方式对产物进一步纯化。
22.综上,本发明大大简化了双链rna的制备流程,具有良好的应用潜力。
附图说明
23.图1实施例1制备双链rna的示意图;图2实施例1环状单链dna的制备方法示意图;图3实施例1环状双链dna模板的制备方法示意图;图4实施例1用b15制备双链rna的结果(用t7 rna聚合酶制备),其中a为b15的序列设计示意图,b为b15在75℃下制备的结果示意图;c为用b15制备双链rna的结果以及对转录产物的酶切验证结果;图5实施例2用b12制备双链rna的结果,其中a为b12的序列设计示意图,b为b12在75℃下制备的结果示意图;c为用b12制备双链rna的结果以及对转录产物的酶切验证结果;图6实施例3用b9制备双链rna的结果,其中a为b9的序列设计示意图,b为b9在75℃下制备的结果示意图;c为用b9制备双链rna的结果以及对转录产物的酶切验证结果;图7实施例4用b5制备双链rna的结果,其中a为b5的序列设计示意图,b为b5在75℃下制备的结果示意图;c为用b5制备双链rna的结果以及对转录产物的酶切验证结果;图8实施例5用b9t制备双链rna的结果,其中a为b9t的序列设计示意图,b为b9t在75℃下制备的结果示意图;c为用b9t制备双链rna的结果以及对转录产物的酶切验证结果;图9实施例6用b5t制备双链rna的结果,其中a为b5t的序列设计示意图,b为b5t在75℃下制备的结果示意图;c为用b5t制备双链rna的结果以及对转录产物的酶切验证结果;图10实施例7用环96制备双链rna的结果,其中a为环96的序列设计示意图,b为环96在65℃下制备的结果示意图;c为用环96制备双链rna的结果以及对转录产物的酶切验证结果;图11实施例8用环155制备双链rna的结果,其中a为环155的序列设计示意图,b为环155在65℃下制备的结果示意图;c为用环155制备双链rna的结果以及对转录产物的酶切验证结果;图12实施例9用环278制备双链rna的结果,其中a为环278的序列设计示意图,b为环278在65℃下制备的结果示意图;c为用环278制备双链rna的结果以及对转录产物的酶切验证结果;图13实施例10用b15制备双链rna的结果(用sp6 rna聚合酶制备)。
c1-ba,终浓度为2μm)、t4 dna连接酶(t4 dnl,终浓度为0.125u/μl)和对应的t4 dna连接酶缓冲液(终浓度为1
×
)混合,37℃下反应12h制备c1。
[0029]1×
t4 dnl buffer的组成:40mm tris-hcl,10mm mgcl2,10mm dtt,500μm atp(ph 7.8@25℃)。
[0030]
la的制备:将前体线性链(a-a和a-b,终浓度为1μm)、splint(splint a-ab,终浓度为2μm)、t4 dna连接酶(t4 dnl,终浓度为0.125u/μl)和对应的t4 dna连接酶缓冲液(终浓度为1
×
)混合,37℃下反应12h制备la。
[0031]1×
t4 dnl buffer的组成:40mm tris-hcl,10mm mgcl2,10mm dtt,500μm atp (ph 7.8@25℃)(3)制备b15(泡状结构长度为15bp的环状双链dna模板)先将c1(终浓度为1μm)、la(终浓度为1.2μm)以及taq dnl buffer(终浓度为1
×
)混的mix在90℃下保温1~3min,然后以0.1℃/s的速度降温至60℃,再以0.1℃/s的速度降温至20-25℃并保温10min使得c1和la充分杂交形成nick。将pcr调到75℃下运行,然后在样品中加入taq dnl(终浓度为4u/μl)在75℃下连接12h。
[0032]1×
taq dnl buffer的组成:20mm tris-hcl,25mm kac,10mm mg(ac)2,10mm dtt,1mm nad,0.1%triton x-100(ph 7.6@25℃)。
[0033]
(4)纯化b15在(3)中制备得到的b15中加入exo i(终浓度约为1u/μl)、exo iii(终浓度约为4u/μl)及其对应的buffer(各自终浓度均为0.5
×
)。颠倒混匀并离心后在37℃下过夜酶切,以去除体系中剩余的la以及splint。
[0034]
0.5
×
exo i buffer的组成为:33.5mm glycine-koh (ph 9.5@25℃),3.35mm mgcl2,0.5mm dtt;0.5
×
exo iii buffer的组成为:33mm tris-hcl(ph 8.0@30℃),0.33mm mgcl2。
[0035]
(5)用b15转录制备双链rna转录体系及反应条件(100μl):[b15]=50 nm,[each ntp]=0.5mm,[t7 rnap]=2u/μl,[rnase inhibitor]=2u/μl,[rnap buffer]=1
×
,([rnase h])=0.25u/μl。在37℃下转录12h,再在70℃下处理10min终止反应。
[0036]1×
rnap buffer的组成为:40mm tris-hcl(ph 7.9@25℃),6mm mgcl2,10mm dtt,10mm nacl和2mm spermidine。
[0037]
(6)用shortcut rnase iii酶切转录产物以确认转录产物为双链:取出10μl转录产物,然后在体系中(总体积为20μl)加入shortcut rnase iii(终浓度为0.2u/μl)、shortcut reaction buffer(终浓度为1
×
)和mncl2(终浓度为1
×
)。在37℃下酶切40 min,然后取出部分酶切产物与loading buffer混合(loading buffer中有edta,可以螯合掉金属离子,从而终止反应)。
[0038]
(7)电泳检测对实验结果进行8%尿素变性聚丙烯酰胺凝胶电泳检测,再用image lab软件分析环状双链dna模板的制备结果、其对应的双链rna的制备结果(转录结果)以及shortcut rnase iii的转录产物酶切结果。
[0039]
图4为结果图,其中图4中a为b15的序列设计示意图,其含有一个上、下链序列相同、方向相反的15bp泡状结构;图4中b为b15在75℃下制备的结果示意图;图4中c为用b15制备双链rna(体系中仅有t7 rnap或t7 rnap和rnase h共存)的结果以及shortcut rnase iii对转录产物的酶切验证结果,图中的标注“s”指shortcut rnase iii酶切的结果。结果表明当转录体系中仅有t7 rnap时,转录产物为堵在胶孔处的多聚串联重复序列;当t7 rnap和rnase h共存于转录体系时,转录产物集中分布于一个固定的长度;shortcut rnase iii酶切后,上述转录产物均被切短了,长度集中在一小段固定区域,根据该酶的酶切特性(其可将长双链rna酶切成18-25bp的短双链rna),可以判定b15的转录产物为我们想要的双链rna。
[0040]
实施例2(1)原料a-a链(5
¢→3¢
):actccggtggaatgaaggaccaagtctgtcatgcactgaaatcagtctcattgctttataa(5
¢‑
磷酸化,长度为61nt,seq id no:1);a-b链(5
¢→3¢
):acaaccagctaagacactgccataccctgtagaaccgaatttgtgcag(5
¢‑
磷酸化,长度为48nt,seq id no:2);splint a-ab(5
¢→3¢
):agctggttgtttataaagca(长度为20nt,seq id no:3);splint a-ba(5
¢→3¢
):accggagtctgcacaa(长度为16nt,seq id no:4);c2-a链(5
¢→3¢
,同c1-a):ttataaagcaatgagactgatttcagtgcatgacagacttggtccttcattccaccgga(5
¢‑
磷酸化,长度为59nt,seq id no:5);c2-b链(5
¢→3¢
):gtctgcacaaattcggttctacacccataccgtcagtcttagctggttgt(5
¢‑
磷酸化,长度为50nt,seq id no:9);splint c1-ab(5
¢→3¢
):gtgcagactccggtgg(长度为16nt,seq id no:7);splint c1-ba(5
¢→3¢
):ctttataaacaaccag(长度为16nt,seq id no:8)。
[0041]
环状单链dna(c2)的制备、b12(泡状结构长度为12bp的环状双链dna模板)的制备及纯化、用b12制备双链rna的反应体系及条件以及电泳检测制备结果的条件同实施例1,此处不再赘述。
[0042]
(2)转录结束后在转录产物中加入a链或c2链的一部分与之杂交,然后加入rnase h进行二次酶切以判断转录产物为单/双链的体系及反应条件:在10μl转录产物中加入lc2-a(lc1-a)/la-a(终浓度为0.1μm)和rnase h buffer(终浓度为0.5
×
),然后在65℃下处理10min,再以0.1℃/s的速度降温至37℃,再在37℃下保持5min,接着加入rnase h(终浓度为0.25u/μl),在37℃下酶切40min。反应结束后在70℃
下处理10min,以灭活rnase h。
[0043]
图5中c为实验结果,可以看到加入rnase h进行二次酶切后泳道上方的弥散条带减少了,且泳道靠下位置处的短产物量得到了提高。这表明加入的单链dna并未发挥作用(其若发挥作用,产物会被切成寡核苷酸,而是新加入的rnase h识别了泡状结构处的单链与rna产物杂交产生的dna/rna chimera并进一步发挥了酶切作用。上述结果说明b12的转录产物为双链,不是单链。
[0044]
实施例3(1)原料a-a链(5
¢→3¢
):actccggtggaatgaaggaccaagtctgtcatgcactgaaatcagtctcattgctttataa(5
¢‑
磷酸化,长度为61nt,seq id no:1);a-b链(5
¢→3¢
):acaaccagctaagacactgccataccctgtagaaccgaatttgtgcag(5
¢‑
磷酸化,长度为48nt,seq id no:2);splint a-ab(5
¢→3¢
):agctggttgtttataaagca(长度为20nt,seq id no:3);splint a-ba(5
¢→3¢
):accggagtctgcacaa(长度为16nt,seq id no:4);c3-a链(5
¢→3¢
,同c1-a):ttataaagcaatgagactgatttcagtgcatgacagacttggtccttcattccaccgga(5
¢‑
磷酸化,长度为59nt,seq id no:5);c3-b链(5
¢→3¢
):gtctgcacaaattcggttctacacccataccgagtgtcttagctggttgt(5
¢‑
磷酸化,长度为50nt,seq id no:10);splint c1-ab(5
¢→3¢
):gtgcagactccggtgg(长度为16nt,seq id no:7);splint c1-ba(5
¢→3¢
):ctttataaacaaccag(长度为16nt,seq id no:8)。
[0045]
环状单链dna(c3)的制备、b9(泡状结构长度为9bp的环状双链dna模板)的制备及纯化、用b9制备双链rna的反应体系及条件、b9转录产物的shortcut rnase iii酶切表征实验以及电泳检测制备结果的条件同实施例1,此处不再赘述。
[0046]
图6中c为实验结果,可以看到结果同图4中c基本一致,因此我们判定b9的转录产物为双链rna。
[0047]
实施例4(1)原料a-a链(5
¢→3¢
):actccggtggaatgaaggaccaagtctgtcatgcactgaaatcagtctcattgctttataa(5
¢‑
磷酸化,长度为61nt,seq id no:1);a-b链(5
¢→3¢
):
acaaccagctaagacactgccataccctgtagaaccgaatttgtgcag(5
¢‑
磷酸化,长度为48nt,seq id no:2);splint a-ab(5
¢→3¢
):agctggttgtttataaagca(长度为20nt,seq id no:3);splint a-ba(5
¢→3¢
):accggagtctgcacaa(长度为16nt,seq id no:4);e-a链(5
¢→3¢
,同c1-a):ttataaagcaatgagactgatttcagtgcatgacagacttggtccttcattccaccgga(5
¢‑
磷酸化,长度为59nt,seq id no:5);e-b链(5
¢→3¢
):gtctgcacaaattcggttctacacccattggcagtgtcttagctggttgt(5
¢‑
磷酸化,长度为50nt,seq id no:11);splint c1-ab(5
¢→3¢
):gtgcagactccggtgg(长度为16nt,seq id no:7);splint c1-ba(5
¢→3¢
):ctttataaacaaccag(长度为16nt,seq id no:8)。
[0048]
环状单链dna(ce)的制备、b5(泡状结构长度为5bp的环状双链dna模板)的制备及纯化、用b5制备双链rna的反应体系及条件、b5转录产物的shortcut rnase iii酶切表征实验以及电泳检测制备结果的条件同实施例1,此处不再赘述。
[0049]
图7中c为实验结果,可以看到结果同图4中c基本一致,因此我们判定b5的转录产物为双链rna。但应当注意的是,当泡状结构尺寸为5bp时,可以看到当t7 rnap和rnase h共存于转录体系时,转录结束后并没有固定长度的短rna产物出现,只是有弥散条带出现,大部分产物仍集中在胶孔处,说明这么小的泡状结构尺寸限制了rnase h对转录产物的酶切分离,使得产物单体的分离效果不理想。因此在设计转录模板时泡状结构尺寸应≥5bp。
[0050]
实施例5(1)原料a-a链(5
¢→3¢
):actccggtggaatgaaggaccaagtctgtcatgcactgaaatcagtctcattgctttataa(5
¢‑
磷酸化,长度为61nt,seq id no:1);a-b链(5
¢→3¢
):acaaccagctaagacactgccataccctgtagaaccgaatttgtgcag(5
¢‑
磷酸化,长度为48nt,seq id no:2);splint a-ab(5
¢→3¢
):agctggttgtttataaagca(长度为20nt,seq id no:3);splint a-ba(5
¢→3¢
):accggagtctgcacaa(长度为16nt,seq id no:4);h2-a链(5
¢→3¢
,同c1-a):ttataaagcaatgagactgatttcagtgcatgacagacttggtccttcattccaccgga(5
¢‑
磷酸化,长度为59nt,seq id no:5);
h2-b链(5
¢→3¢
):gtctgcacaaattcggttctacatttttttttagtgtcttagctggttgt(5
¢‑
磷酸化,长度为50nt,seq id no:12);splint c1-ab(5
¢→3¢
):gtgcagactccggtgg(长度为16nt,seq id no:7);splint c1-ba(5
¢→3¢
):ctttataaacaaccag(长度为16nt,seq id no:8)。
[0051]
环状单链dna(ch2)的制备、b9t(带有polyt的泡状结构长度为9bp的环状双链dna模板)的制备及纯化、用b9t制备双链rna的反应体系及条件、以及电泳检测制备结果的条件同实施例1,此处不再赘述。
[0052]
(2)转录结束后在转录产物中加入a链或h2链的一部分与之杂交,然后加入rnase h进行二次酶切以判断转录产物为单/双链的体系及反应条件:在10μl转录产物中加入lh2-a(lc1-a)/la-a(终浓度为1μm)和rnase h buffer(终浓度为0.5
×
),然后在65℃下处理10min,再以0.1℃/s的速度降温至37℃,再在37℃下处理5min,接着加入rnase h(终浓度为0.25u/μl),在37℃下酶切2h。反应结束后在70℃下处理10min,以灭活rnase h。
[0053]
图8中c为实验结果,可以看到结果与图5中c类似,在加入rnase h进行二次酶切后泳道上方的弥散条带减少了,且泳道靠下位置处的短产物量得到了极大提高。这表明加入的单链dna并未发挥作用,说明b9t的转录产物也为双链。但应当注意的是,与b9的转录结果(图6中c)相比,可以看到泡状结构处polyt的存在很大程度上影响了rnase h对转录产物的酶切分离,在设计转录模板时应尽量避免此类特殊序列。
[0054]
实施例6(1)原料a-a链(5
¢→3¢
):actccggtggaatgaaggaccaagtctgtcatgcactgaaatcagtctcattgctttataa(5
¢‑
磷酸化,长度为61nt,seq id no:1);a-b链(5
¢→3¢
):acaaccagctaagacactgccataccctgtagaaccgaatttgtgcag(5
¢‑
磷酸化,长度为48nt,seq id no:2);splint a-ab(5
¢→3¢
):agctggttgtttataaagca(长度为20nt,seq id no:3);splint a-ba(5
¢→3¢
):accggagtctgcacaa(长度为16nt,seq id no:4);j2-a链(5
¢→3¢
,同c1-a):ttataaagcaatgagactgatttcagtgcatgacagacttggtccttcattccaccgga(5
¢‑
磷酸化,长度为59nt,seq id no:5);j2-b链(5
¢→3¢
):gtctgcacaaattcggttctacattttttggcagtgtcttagctggttgt(5
¢‑
磷酸化,长度为50nt,seq id no:13);
splint c1-ab(5
¢→3¢
):gtgcagactccggtgg(长度为16nt,seq id no:7);splint c1-ba(5
¢→3¢
):ctttataaacaaccag(长度为16nt,seq id no:8)。
[0055]
环状单链dna(cj2)的制备、b5t(带有polyt的泡状结构长度为5bp的环状双链dna模板)的制备及纯化、用b5t制备双链rna的反应体系及条件、以及电泳检测制备结果的条件同实施例1,此处不再赘述。
[0056]
(2)转录结束后在转录产物中加入a链或j2链的一部分与之杂交,然后加入rnase h进行二次酶切以判断转录产物为单/双链的体系及反应条件:在10μl转录产物中加入lj2-a(lc1-a)/la-a(终浓度为1μm)和rnase h buffer(终浓度为0.5
×
),然后在65℃下处理10min,再以0.1℃/s的速度降温至37℃,再在37℃下处理5min,接着加入rnase h(终浓度为0.25u/μl),在37℃下酶切40min。反应结束后在70℃下处理10min,以灭活rnase h。
[0057]
图9中c为实验结果,可以看到在加入rnase h进行二次酶切后堵在胶孔处的长产物未减少,这表明加入的单链dna未发挥作用,说明b5t的转录产物也为双链。
[0058]
实施例7(1)原料a链(5
¢→3¢
):ccaggaatcagcggcaaattcctctactttcctcgtcacatctt(5
¢‑
磷酸化,长度为44nt,seq id no:14,下划线处为泡状结构所在位置);b链(5
¢→3¢
):cgactcctgtactgacaacactctcacacgacacatccgcgtcacaaaaggt(5
¢‑
磷酸化,长度为52nt,seq id no:15);splint ab(5
¢→3¢
):acaggagtcgaagatgtgac(长度为20nt,seq id no:16);splint ba(5
¢→3¢
):tgattcctggaccttttgtg(长度为20nt,seq id no:17);a1链(5
¢→3¢
):aagatgtgagctcctttcatctccaatttgccgctgattcctgg(5
¢‑
磷酸化,长度为44nt,seq id no:18,下划线处为泡状结构所在位置);b1链(5
¢→3¢
):accttttgtgacgcggatgtgtcgtgtgagagtgttgtcagtacaggagtcg(5
¢‑
磷酸化,长度为52nt,seq id no:19);splint a1b1(5
¢→3¢
):cacaaaaggtccaggaatca(长度为20nt,seq id no:20);splint b1a1(5
¢→3¢
):ctcacatcttcgactcctgt(长度为20nt,seq id no:21)。
[0059]
96nt的单环制备方法同实施例1,但96bp的环状双链dna模板的制备方法与实施例1-6均不同。具体地:将制备好的96nt单环和与其互补链对应的两条短dna链(a1和b1)退火
dnl,终浓度为0.25u/μl)和对应的t4 dna连接酶缓冲液(终浓度为1
×
)混合,37℃下反应2h。
[0063]
c-a1b1c1的制备:将制备好的l-a1b1(终浓度为2μm)、c1(终浓度为2μm)、splint(splint a1c1和splint c1b1,终浓度均为3μm)、t4 dna连接酶(t4 dnl,终浓度为0.125u/μl)和对应的t4 dna连接酶缓冲液(终浓度为0.5
×
)混合,37℃下反应2h。
[0064]
155bp的环状双链dna模板的制备方法与实施例7相同。具体地:将制备好的155nt单环和与其互补链对应的三条短dna链(a、b和c)退火杂交(退火条件同实施例1)后直接加入taq dnl进行连接。155bp的环状双链dna模板的纯化方法及后续的转录条件同实施例1,此处不再赘述。
[0065]
图11为用长度为155bp的环状双链dna模板制备双链rna的结果。结果显示转录产物也为双链rna,表明本方法具有良好的通用性。
[0066]
实施例9(1)原料b链(5
¢→3¢
):cgactcctgtactgacaacactctcacacgacacatccgcgtcacaaaaggt(5
¢‑
磷酸化,长度为52nt,seq id no:15);c链(5
¢→3¢
):gaagaaactcatgacatcgaattgttgagcgaagaatatgacgccactcctttcatcaa(5
¢‑
磷酸化,长度为59nt,seq id no:22);d链(5
¢→3¢
):aatcggcagtccattcgcagaagcaactgtactcaaattcggtaaactccaacgc(5
¢‑
磷酸化,长度为55nt,seq id no:28,下划线处为泡状结构所在位置);e链(5
¢→3¢
):actcagtacgcatacttcgtcactgctgatgacatcagggttggttcaatgtccgccga(5
¢‑
磷酸化,长度为59nt,seq id no:29);f链(5
¢→3¢
):cggctaccacaacatttctaccaaggatggtgactgcggttcactcctctttg(5
¢‑
磷酸化,长度为53nt,seq id no:30);splint bc(5
¢→3¢
):gagtttcttcaccttttgtg(长度为20nt,seq id no:23);splint cd(5
¢→3¢
):actgccgattttgatgaaag(长度为20nt,seq id no:31);splint de(5
¢→3¢
):cgtactgagtgcgttggagt(长度为20nt,seq id no:32);splint ef(5
¢→3¢
):gtggtagccgtcggcggaca(长度为20nt,seq id no:33);splint fb(5
¢→3¢
):acaggagtcgcaaagaggag(长度为20nt,seq id no:34);
b1链(5
¢→3¢
):accttttgtgacgcggatgtgtcgtgtgagagtgttgtcagtacaggagtcg(5
¢‑
磷酸化,长度为52nt,seq id no:19);c1链(5
¢→3¢
):ttgatgaaaggagtggcgtcatattcttcgctcaacaattcgatgtcatgagtttcttc(5
¢‑
磷酸化,长度为59nt,seq id no:25);d1链(5
¢→3¢
):gcgttggagtttaccgaatttgagttgtcaacgaagacgcaatggactgccgatt(5
¢‑
磷酸化,长度为55nt,seq id no:35,下划线处为泡状结构所在位置);e1链(5
¢→3¢
):tcggcggacattgaaccaaccctgatgtcatcagcagtgacgaagtatgcgtactgagt(5
¢‑
磷酸化,长度为59nt,seq id no:36);f1链(5
¢→3¢
):caaagaggagtgaaccgcagtcaccatccttggtagaaatgttgtggtagccg(5
¢‑
磷酸化,长度为53nt,seq id no:37);splint c1b1(5
¢→3¢
):cacaaaaggtgaagaaactc(长度为20nt,seq id no:27);splint d1c1(5
¢→3¢
):ctttcatcaaaatcggcagt(长度为20nt,seq id no:38);splint e1d1(5
¢→3¢
):actccaacgcactcagtacg(长度为20nt,seq id no:39);splint f1e1(5
¢→3¢
):tgtccgccgacggctaccac(长度为20nt,seq id no:40);splint b1f1(5
¢→3¢
):ctcctctttgcgactcctgt(长度为20nt,seq id no:41)。
[0067]
278nt的单环制备方法同实施例8,即采用分步的方式制备。具体地,先制备l-b1c1和l-d1e1,再以l-d1e1和f1为原料制备l-d1e1f1,最后以l-b1c1和l-d1e1f1为原料制备c-b1c1d1e1f1(278nt的单环)。
[0068]
l-b1c1的制备:将b1和c1(终浓度为4μm)、splint(splint c1b1,终浓度为6μm)、t4 dna连接酶(t4 dnl,终浓度为0.25u/μl)和对应的t4 dna连接酶缓冲液(终浓度为1
×
)混合,37℃下反应2h。
[0069]
l-d1e1的制备:将d1和e1(终浓度为4μm)、splint(splint e1d1,终浓度为6μm)、t4 dna连接酶(t4 dnl,终浓度为0.25u/μl)和对应的t4 dna连接酶缓冲液(终浓度为1
×
)混合,37℃下反应2h。
[0070]
l-d1e1f1的制备:将制备好的l-d1e1(终浓度为2μm)、f1(终浓度为2μm)、splint(splint f1e1,终浓度为3μm)、t4 dna连接酶(t4 dnl,终浓度为0.125u/μl)和对应的t4 dna连接酶缓冲液(终
浓度为0.5
×
)混合,37℃下反应2h。
[0071]
c-b1c1d1e1f1的制备:将制备好的l-d1e1f1(终浓度为1μm)和l-b1c1(终浓度为1μm)、splint(splint d1c1和splint b1f1,终浓度均为1.5μm)、t4 dna连接酶(t4 dnl,终浓度为0.0625u/μl)和对应的t4 dna连接酶缓冲液(终浓度为0.25
×
)混合,37℃下反应2h。
[0072]
278bp的环状双链dna模板的制备方法与实施例7和实施例8相同。具体地:将制备好的278nt单环和与其互补链对应的五条短dna链(b、c、d、e和f)退火杂交(退火条件同实施例1)后直接加入taq dnl进行连接。278bp的环状双链dna模板的纯化方法及后续的转录条件同实施例1,此处不再赘述。图12为用长度为278bp的环状双链dna模板制备双链rna的结果。结果显示转录产物也为双链rna,表明本方法具有良好的通用性。
[0073]
实施例10所用的原料,单环、单链及环状双链dna的制备及纯化方法同实施例1,此处不再赘述。不同之处在于这里用sp6 rna聚合酶进行转录,转录条件同实施例1。
[0074]
图13为b15在sp6 rna聚合酶的作用下制备双链rna的结果。结果显示转录产物也为双链rna,表明本方法具有良好的通用性,适用于多种常见的rna聚合酶。
[0075]
以上所述的实施例仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1