Kctd19基因在治疗男性不孕不育疾病中的应用
kctd19基因在治疗男性不孕不育疾病中的应用
技术领域
1.本发明属于基因的应用领域,具体涉及睾丸特异性表达kctd19,敲除kctd19小鼠模型的构建、鉴定方法、应用于治疗男性不孕不育疾病药物筛选以及治疗男性不孕不育疾病。
背景技术:
2.随着工业化程度的快速发展,环境污染的加重及工作和社会压力的增大,不孕不育率逐年增加。据统计有10%-15%的育龄夫妻受到不孕不育的影响,并呈年轻化趋势,男性不育约占人类不育病例的50%。近些年,男性不育患者可通过试管婴儿(in vitro fertilization,ivf)和胞浆内单精子注射(intracytoplasmic sperm injection,icsi)等辅助生殖技术获得自己的后代,但这些技术绕过自然受精过程中对异常精子的选择,有传递遗传缺陷给后代的危险,导致后代出生缺陷和生殖健康问题的持续恶化。男性不育主要源于精子发生出现异常而导致的无精子症或少、弱、畸形精子症,对于无精子症患者,由于没有成熟的精子,不能接受辅助生殖技术的治疗,目前的解决方式只能借助精子库里面的精子受精,因而不能得到生物学意义上的后代。由此可见,深入了解精子发生的调控机制,明确男性不育的病因和分子基础,寻找切实可行的预防措施,不仅对认识男性生殖健康具有重要意义,而且能够促进家庭和睦与社会稳定。
3.精子发生(spermatogenesis)是一个错综复杂而有规律的细胞分化过程,尤其在哺乳动物精子第一波生精过程中,生殖细胞严格按照发育时期依次出现,经历精原细胞有丝分裂(mitosis)、精母细胞减数分裂(meiosis)和精子变形(spermiogenesis)三个阶段。第一次减数分裂前期是一个相当特殊的过程,经历dna双链的断裂与修复、同源染色体的配对联会和遗传信息的重组交叉等关键事件,实现同源染色体的交换,增加遗传多样性和后代的适应性,每个事件都有相应的标志性蛋白参与完成。减数分裂进程一旦出错,都会影响精子发生的过程,并最终导致不育。因此,对精子发生减数分裂重要事件的分析有助于理解精子发生异常的原因,从而揭示男性不育的新病因。
4.小鼠动物模型和突变基因的筛选等研究证明基因突变阻断精子发生减数分裂的过程是导致男性不育的重要原因,主要包括许多睾丸特异性表达基因和睾丸高表达基因。例如睾丸特异性组蛋白变异体h3t参与核小体形成开放的染色体结构并启动精子发生。乳腺癌扩增序列2(breast carcinoma amplified sequence 2,bcas2)参与小鼠精原干细胞的可变剪接并启动减数分裂。甲基转移酶3(methyltransferase like 3,mettl3)参与调控精原干细胞分化和减数分裂的起始。组蛋白h2b的泛素化修饰参与染色体结构的正常疏松,端粒重复序列结合因子1(telomeric repeat binding factor 1,trf1)参与端粒末端向核膜的锚定及端粒完整性的保护过程,进而都能影响小鼠精母细胞减数分裂的启动、双链断裂的修复、同源染色体联会、交叉等过程。后期促进复合体apc/c的抑制剂emi2通过调节周期蛋白依赖性蛋白激酶1(cyclin-dependent kinase 1,cdk1)的活性参与小鼠减数分裂双线期精母细胞向中期精母细胞的发育。综上所述,精子发生减数分裂过程中有大量基因参
与完成,这些基因的异常表达,都可能影响精子发生的过程,进而导致雄性小鼠不育。从遗传学角度考虑,如果能够找到并确认导致男性不育的基因,通过基因筛查,基因治疗等相关技术手段,可以对男性不育患者做出明确的病因诊断,提供高效合理的治疗方法。因此,目前影响生殖相关基因的发现及其功能是未来研究男性不育的重中之重,阐明精子发生减数分裂的机制和调节途径对于理解男性不育的病理发生和治疗具有指导作用。
5.kctd19是钾离子通道四聚化结构域蛋白kctd(potassium channel tetramerization domain-containing protein)家族中的成员。已有的研究结果证明,kctd家族成员n端都有一个btb/poz(broad-complex,tram-track;poxvirus and zinc finger)结构域和一个钾离子四聚体通道结构域(k-ketra)。btb/poz结构域最重要的功能是形成蛋白二聚体、介导蛋白之间的相互作用、抑制转录活性和促使蛋白通过泛素-蛋白酶体系统降解。k-ketra结构域是电压门控钾离子通道蛋白中一个非常保守的同源序列,在结构上和btb/poz结构域具有高度相似性,但c端的序列却各不相同,意味着它们有不同的生物学功能。近些年的研究结果证明kctd家族成员作为转录抑制因子在不同的组织器官中发挥着重要的生物学功能。例如:kctd5和kctd11都能与泛素连接酶cullin3蛋白结合,充当连接酶e3与底物直接的接头蛋白;kctd12通过gabab信号通路,抑制胃肠道间质瘤的增殖;kctd15通过调节经典wnt信号通路及转录因子ap-2a的活性,抑制斑马鱼胚胎发育过程中神经嵴的形成;kctd1调节抑制wnt信号通路和转录因子ap-2α的表达,促使β-连环蛋白(β-catenin)的降解;kctd10能够直接结合tbx5并抑制转录活性,调控斑马鱼心脏的正常发育。
6.本课题组研究结果证明睾丸特异性表达蛋白kctd19在粗线期、双线期、中期精母细胞和1-8期圆形精子细胞中高表达。建立kctd19敲除小鼠模型,并进行配种实验,结果证明kctd19的缺失能够导致雄性小鼠不育,睾丸体积和曲细精管直径变小。伊红-苏木精(hematoxylin and eosin,he)染色结果显示敲除kctd19小鼠曲细精管中出现大量的空泡及空腔,生殖细胞的发育阻滞在减数分裂中期阶段,缺失圆形和长形精子细胞。这些结果提示kctd19在精子发生减数分裂过程中具有重要的生物学功能。
技术实现要素:
7.本发明主要以申请人前期的研究结果为基础,利用kctd19敲除动物模型,精母细胞染色体铺片、sta-put沉降法分选小鼠精母细胞、rna-seq和chip-seq等技术,深入研究kctd19在精子发生减数分裂过程中的功能,阐明kctd19与hdac1通过形成转录抑制复合体,引起组蛋白去乙酰化修饰的作用机制,并明确参与下游调控的信号分子,为进一步了解男性生殖健康提供坚实的理论基础。
8.本发明为解决上述技术问题采用如下技术方案,kctd19基因在筛选治疗男性不孕不育疾病药物中的应用,其特征在于:所述kctd19与hdac1通过形成转录抑制复合体,引起组蛋白去乙酰化修饰的作用机制,并明确参与下游调控的信号分子,为进一步筛选治疗男性不孕不育疾病药物提供基础。
9.进一步限定,所述kctd19特异性敲除的非人哺乳动物模型在筛选治疗男性不孕不育疾病药物中的应用,该应用不直接涉及疾病治疗和诊断应用过程。
10.进一步限定,所述非人哺乳动物为小鼠、大鼠、豚鼠、家兔、猴、羊或猪。
11.进一步限定,所述kctd19特异性敲除的非人哺乳动物模型的构建过程为:采用
crispr/cas9技术构建kctd19基因敲除小鼠,获得突变型f0代,将获得的f0代突变小鼠与野生型小鼠配对,获得f1代杂合(+/-)小鼠,最后f1代杂合小鼠自交,得到敲除(-/-)小鼠。
12.本发明与现有技术相比具有以下优点和有益效果:
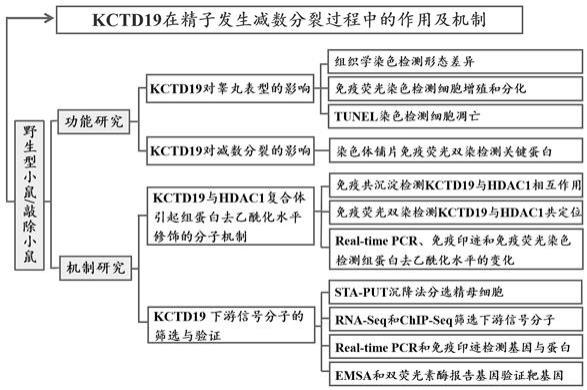
13.1、拓展对kctd19生物学功能的认识:kctd19作为转录抑制因子kctd家族中的重要成员,在精子发生减数分裂过程中的研究较少,具体的作用机制尚不清楚。申请人前期的研究结果证明敲除kctd19导致雄性小鼠不能生育,其精子发生主要阻滞在减数分裂中期阶段。本研究首次应用敲除kctd19动物模型,系统研究kctd19在精子发生减数分裂过程中的功能,阐明kctd19与hdac1通过形成转录抑制复合体引起组蛋白去乙酰化修饰的作用机制,并明确参与下游调控的信号分子。这有助于全面认识kctd19的生物学功能,且有望在精子发生减数分裂过程中的调控机理方面获得突破性的研究进展。
14.2、丰富和完善男性不育的理论体系:有关精子发生减数分裂的研究属于生殖与发育生物学领域的前沿性课题,不仅对调控精子发生的关键基因和作用机理的认识方面具有重要的学术意义,而且能够从源头上揭示小鼠睾丸相关不育疾病的诱发机制,为进一步了解男性生殖健康提供坚实的理论基础。
附图说明
15.图1是kctd19蛋白在小鼠睾丸中的表达。(a)western blotting方法检测kctd19在不同发育时期睾丸中的表达。(b)免疫组织化学方法检测kctd19在成年小鼠睾丸曲细精管精子发生过程中的表达。ser:支持细胞;spg:精原细胞;pl:前细线期精母细胞;l:细线期精母细胞;z:偶线期精母细胞;pa:粗线期精母细胞;d:双线期精母细胞;m:中期精母细胞;s:精子。
16.图2为构建kctd19全身性敲除小鼠。(a)小鼠kctd19基因的敲除策略,箭头表示基因型的鉴定引物。(b)pcr鉴定基因型。(c)qrt-pcr检测敲除kctd19 mrna水平变化。(d)western blotting检测敲除kctd19蛋白水平变化。
17.图3为敲除kctd19小鼠曲细精管阻滞在第一次减数分裂中期。(a)敲除kctd19小鼠睾丸体积明显变小。(b)敲除kctd19小鼠睾丸重量与其体重的比值明显降低(***p《0.001,n=4)。(c)敲除kctd19小鼠生殖细胞发育停滞在减数分裂中期。pa:粗线期精母细胞;rs:圆形精子;es:长形精子;m:中期精母细胞。(d)敲除kctd19小鼠睾丸的曲细精管直径与野生型小鼠相比明显变短(***p《0.001,n=4)。(e)敲除kctd19小鼠附睾尾中没有精子。
18.图4在精子发生减数分裂过程中kctd19与hdac1相互作用。
19.图5为本发明的技术路线图。
具体实施方式
20.以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
21.1、研究方案
22.1)kctd19对精母细胞相关生殖表型的影响
23.申请人拟利用kctd19敲除小鼠模型,收集不同发育阶段(出生后15天、18天、21天
和8周龄)野生型和敲除kctd19小鼠睾丸,固定、脱水、包埋并制备石蜡切片。组织学苏木精-伊红染色方法研究敲除kctd19对不同发育阶段睾丸的形态学和组织学的影响。免疫荧光双染方法检测生殖细胞标记因子mvh/vasa和增殖标记分子ki67的表达情况,观察敲除kctd19对生殖细胞增殖的影响。tunel染色检测kctd19对生殖细胞凋亡的影响。将上述结果与野生型小鼠的实验结果进行比较,阐明敲除kctd19对小鼠精母细胞形态、细胞增殖和凋亡的影响。
24.2)kctd19对精子发生减数分裂的影响
25.取8周龄野生型和kctd19敲除小鼠睾丸进行精母细胞染色体铺片。用联会复合体标记分子sycp3进行免疫荧光染色,详细深入的观察小鼠精母细胞第一次减数分裂前期各级精母细胞数量的变化情况。之后sycp3与减数分裂同源重组过程中关键性标记蛋白进行免疫荧光双染,检测野生型和敲除kctd19小鼠,同源重组过程中dna双链断裂的形成、同源染色体相互配对、联会、交叉等重要事件标记蛋白的定位和表达变化情况,探索敲除kctd19对精子发生减数分裂的影响。关键蛋白如下:dna双链断裂发生的标志分子γh2ax;dna双链断裂缺口单链形成的标志分子rpa1;单链入侵因子即同源重组因子rad51和dmc1;同源染色体联会的标记分子sycp1;同源染色体发生交叉的标记分子mlh1。
26.3)kctd19与hdac1转录抑制复合体引起组蛋白去乙酰化的分子机制
27.取8周龄野生型小鼠睾丸组织,通过免疫共沉淀方法检测kctd19和hdac1的相互作用,免疫荧光双染分析kctd19与hdac1之间的共定位。然后收集不同发育阶段(出生后15天、18天、21天和8周龄)野生型和敲除kctd19小鼠睾丸,采用real-time pcr、western blot和免疫荧光等技术,分析组蛋白h3(h3k9、h3k14、h3k23、h3k27)和h4(h4k5、h4k8、h4k12和h4k16)等乙酰化蛋白的表达变化,探索kctd19能否通过介导精母细胞组蛋白去乙酰化水平调节精子发生的过程。
28.为了进一步寻找kctd19与hdac1形成的转录抑制复合体参与调节精母细胞发育的下游信号分子和通路,取出生后18天野生型和敲除kctd19小鼠睾丸组织,使用sta-put法分选粗线期精母细胞。微量rna试剂盒提取rna,使用rna-seq方法筛选出下游表达差异的调控基因。取出生后18天野生型小鼠睾丸组织,分选粗线期精母细胞,通过chip-seq筛选出在精子发生减数分裂过程中kctd19作用的靶dna序列。综合rna-seq和chip-seq结果,利用生物信息学数据分析确定kctd19下游信号分子,并用real-time pcr、western blotting、免疫荧光双染、emsa和荧光素酶报告基因等方法来进一步确认。
29.2、实验方法
30.1)sta-put沉降法分选小鼠精母细胞
31.将去除包膜的睾丸组织置于裂解液(1mg/ml胶原酶;1mg/ml透明质酸酶)中,37℃孵育15-20min,4℃ 200g离心5min,弃上清(主要是间质细胞和支持细胞)。pbs重悬沉淀清洗一次,加入裂解液(0.25wt%胰酶;1mg/ml dnase i)重新消化,37℃孵育5min,离心,弃上清。pbs重悬沉淀清洗一次,再次用15ml pbs重悬,200目滤网过滤,单细胞悬液标记好即可准备分离。连接sta-put仪器,按照左4wt%、右2wt%的顺序分别加入300ml 4wt%和2wt%浓度的bsa至连续浓度梯度混合仪中,连接输液管和梯度混合仪并封闭好连接端口,确保系统密闭无漏夜。开启阀门和搅拌器,使得2%-4%的连续浓度梯度层进入沉降罐中。将15ml单细胞悬液加入沉降罐中,避免产生气泡。静置沉降2-3h后,观察沉降罐中的细胞完全分
层。用自动收集器将细胞收集到45个左右的收集管中,每管12ml。将收集的细胞经4℃ 600g离心5min,弃上清,每个收集管中加入1ml pbs。取奇数管按顺序各取50ml细胞悬液加入96孔板中,显微镜下观察,按照细胞形态辨别各时期精原细胞、精母细胞、圆形和长形精子。按同类细胞收集到一起,不能判定的细胞类型不要,保证细胞纯度。收集的细胞可以用来提取rna、蛋白或者用于染色体免疫共沉淀,也可液氮冷冻保持到-80℃备用。
32.2)精母细胞染色体铺片
33.取睾丸单根曲细精管2-2.5cm,低渗液(30mm tris;50mm蔗糖;17mm柠檬酸钠;5mm edta)放置45min,转移到20μl蔗糖溶液(100mm,ph 8.2)中,用镊子撕碎,去除残留的小管,再加入20μl蔗糖溶液,吹打成单细胞悬液。另取两张干净的载玻片,在载玻片右上方滴加20μl固定液(1%pfa固定液;0.15%tritonx-100,ph 9.2),悬液分成两份,两张片子右上角各滴一滴,慢慢铺平。置于暗盒中,自然晾干,可直接用于免疫荧光,或放-80℃保存备用。
34.3)免疫荧光双染
35.精母细胞染色体铺片后,0.4%photoflo洗涤3min
×
3次。而组织切片放入二甲苯中脱蜡两次,每次10min。将脱完蜡的切片依次放入100%、95%、80%、70%的酒精和蒸馏水中,每次5min。把切片放入0.01m,ph 6.0柠檬酸钠缓冲液中,用微波炉加热修复。高火煮沸溶液,用低火维持溶液沸腾4min
×
4次,然后让其自然冷却至室温。pbst洗涤5min
×
3次,用10%正常驴血清,室温孵育至少1h。加入不同种属来源的两种一抗,4℃孵育过夜。用pbst洗涤5min
×
3次,加555/488标记的两种荧光二抗,37℃孵育1h。用pbst洗涤5min
×
3次,dapi室温复染。防淬灭封片剂封片,激光共聚焦荧光显微镜观察并照相。
36.4)染色体免疫共沉淀(chip)
37.收集分选的精母细胞,1wt%的甲醛处理,交联核酸与dna结合蛋白。加入0.125m甘氨酸终止。用超声方法随机把染色质破碎成200-1000bp的dna片段;片段分成两部分,一份用于免疫共沉淀方法,一份用于对照实验(input dna)。使用kctd19抗体与超声破碎的dna片段进行免疫沉淀,形成dna-蛋白质-抗体复合物,利用protein琼脂糖磁珠富集抗体复合物。通过抗原和抗体反应形成dna-蛋白质-抗体复合体,然后沉淀此复合体,特异性地富集目的蛋白结合的dna片段。洗脱液洗脱复合体,nacl解交联释放dna片段,最后用纯化柱纯化dna。纯化的dna溶液可以直接用来测序。
38.5)凝胶阻滞(emsa)
39.根据chip-seq选择的dna结合序列设计单链探针,合成生物素标记的探针。配制6%非变性的聚丙烯酰胺凝胶,将结合缓冲液、体外转录翻译系统获得的kctd19蛋白(promega试剂盒)和生物素标记的探针室温孵育20min。再加入5μl 5xloading buffer,轻轻混匀,按照10v/cm的电压电泳。电泳结束后按照滤纸、尼龙膜、胶和滤纸的顺序进行电转膜,在4℃冰箱中完成。结束后,用紫外灯照射尼龙膜10min,将dna与尼龙膜交联。之后用封闭液封闭尼龙膜,加入ecl发光液反应3min,暗室显影。然后用图像分析系统检测蛋白条带的光密度,定量分析。
40.6)荧光素酶报告试验(luciferase assay)
41.pgl3.0萤火虫荧光素酶报告质粒、海肾荧光素酶报告质粒、超表达质粒或是空质粒共转染293ft细胞24h,用细胞裂解液200μl室温裂解15min。然后取20μl裂解液加入到离心管中,再加入50μl荧光反应液,混匀,置于荧光检测仪中检测萤火虫荧光素酶活性。最后
再加入50μl终止液,启动海肾荧光素酶反应并测量。结果统计:萤火虫荧光素酶荧光强度/海肾荧光素酶荧光强度的比值代表启动子活性。
42.7)免疫印迹(western blotting)
43.将预冷的裂解液300μl加入组织中,电动匀浆器裂解均匀,冰上放置30min。4℃离心12000g,15min,取上清到另一个1.5ml离心管中。用bca蛋白试剂盒测定蛋白质浓度。取一定量的上清加入5
×
上样缓冲液,98℃加热5min使蛋白变性。经sds-page电泳、转膜后,5%脱脂牛奶室温封闭2h,加入一抗4℃孵育过夜,tbst洗涤10min
×
3次,加入二抗室温孵育1h,tbst洗涤10min
×
3次,加入ecl发光液反应3min,暗室显影。然后用图像分析系统检测蛋白条带的光密度,定量分析。
44.3、实验结果
45.1)kctd19蛋白在小鼠睾丸曲细精管中的表达
46.首先通过诱导重组蛋白的表达成功制备了kctd19兔源多克隆抗体,然后检测kctd19在小鼠睾丸曲细精管中的表达和定位情况。选取出生后1天、6天、10天、12天、14天、18天、21天、28天和8周龄成年小鼠的睾丸,western blotting方法检测kctd19蛋白在睾丸发育过程中的表达变化。结果显示kctd19从出生后14天开始表达,之后逐渐升高,直到成年(图1a)。免疫组织化学结果显示,kctd19在支持细胞、精原细胞、前细线期、细线期和偶线期精母细胞中不表达,在粗线期、双线期、中期精母细胞和1-8期圆形精子细胞中高表达,在9-12期长形精子细胞中表达降低,在13-16期长形精子细胞中的表达消失(图1b)。以上结果提示kctd19可能在小鼠精子发生过程中发挥重要作用。
47.2)构建kctd19敲除小鼠
48.为了研究kctd19在雄性生殖细胞中的功能,采用crispr/cas9技术将kctd19的第二个外显子定点敲除,将cas9 mrna与grna一起注入受精卵胞质,然后将受精卵移植到同期发情假孕受体的输卵管壶腹部,获得突变型f0代,将获得的f0代突变小鼠与野生型小鼠配对,获得f1代杂合(+/-)小鼠,最后f1代杂合小鼠自交,得到敲除(-/-)小鼠,其相应的对照野生型小鼠即为wild-type(wt)小鼠(图2a)。pcr基因组基因型鉴定,qrt-pcr和western blotting结果显示kctd19在基因组,mrna和蛋白水平都完全缺失(图2b-d),以上结果说明kctd19被有效的敲除。
49.3)敲除kctd19精子发生阻滞在减数分裂中期
50.由于kctd19特异性表达于小鼠睾丸,因此我们猜想kctd19-/-雄性小鼠的繁殖能力是否受到影响。配种实验显示kctd19-/-雄性小鼠交配见栓的雌鼠均不能怀孕。表明kctd19对于雄性小鼠的正常繁殖能力是必需的,而kctd19-/-雌性小鼠是可育的,无论与wt还是kctd19
+/-雄鼠交配,均能在2个月内正常怀孕和产生子代。为了探索导致kctd19-/-雄性小鼠不育的原因,比较了成年小鼠睾丸的形态学和组织学差异。发现kctd19-/-小鼠睾丸体积明显变小(图3a),睾丸体重与小鼠体重的比值也比对照组小鼠要明显降低(图3b)。组织学苏木精-伊红(hematoxylin and eosin,h&e)染色结果显示敲除kctd19小鼠曲细精管中出现大量的空泡及空腔,生殖细胞的发育阻滞在减数分裂中期,没有圆形和长形精子细胞,不能发育到成熟精子(图3c),而且曲细精管直径明显变短(图3d)。在正常情况下,附睾尾储存成熟精子,而kctd19敲除小鼠中没有精子的出现(图3e),这也是导致敲除kctd19雄性小鼠最终不育的直接原因。以上结果说明kctd19参与调节小鼠精子发生减数分裂过程。
51.4)kctd19在小鼠精子发生减数分裂过程中与hdac1相互作用
52.为了研究精子发生减数分裂过程kctd19是否与hdac1相互作用,取野生型出生后18天小鼠睾丸(没有圆形和长形精子)做免疫共沉淀实验。结果显示kctd19在精子发生减数分裂过程中能够与hdac1相互作用(图4)。以上预实验结果说明kctd19在小鼠精子发生减数分裂过程中能与去乙酰化酶hdac1形成复合体发挥作用,其潜在的调控作用和机制仍需深入研究。
53.以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1