一种中和冠状病毒的双特异性抗体
1.本发明涉及一种中和冠状病毒的双特异性抗体及其同源二聚体,编码该双特异性抗体的核酸分子,包含该核酸分子的载体,包含该载体的宿主细胞,以及该双特异性抗体及其同源二聚体在制备治疗或预防冠状病毒所导致的疾病的药物方面的应用,以及在检测产品方面的应用,属于生物医药领域。
背景技术:
2.自2019年12月以来,由新型冠状病毒(sars-cov-2)引起的新型冠状病毒肺炎(covid-19)疫情在全世界迅速传播,给人类健康和全球公共卫生安全带来严峻的挑战。
3.sars-cov-2属于冠状病毒科,与2003年暴发的sars冠状病毒同属β属冠状病毒,氨基酸同源性高达77.2%。sars-cov-2病毒的主要包膜蛋白是刺突蛋白(也称spike蛋白,简称s蛋白)。刺突蛋白在病毒感染过程中被细胞内的蛋白酶水解成s1和s2两部分,其中,s2是跨膜蛋白,s1具有识别并结合细胞受体血管紧张素转换酶-2(ace-2)的受体结合区(receptor binding domain,简称rbd)。s1和s2构成的刺突蛋白是sars-cov-2病毒特异性识别、结合靶细胞受体,并介导病毒感染的病毒蛋白,因此也是中和抗体的识别靶点。
4.到目前为止,对covid-19的临床治疗多以对症支持治疗为主,新冠肺炎的临床症状的复杂性给医生带来了很大的挑战,研发可治疗新冠肺炎的特效药也已成为当前药物研究领域的热点及前沿。
5.国内外许多研究报道了从新冠患者体内分离的中和抗体,这些中和抗体主要靶向sars-cov-2刺突蛋白上的rbd区域或ntd(n-terminal domain)区域,阻碍病毒进入细胞而达到保护效果。在动物实验和临床实验中,许多抗体也被证实具有一定预防和治疗新冠病毒感染的作用,部分sars-cov-2中和抗体已获得fda批准用于covid-19的临床治疗。例如,再生元公司的regen-cov(casirivimab和imdevimab)组合抗体治疗covid-19可以将住院和死亡的人数降低100%。
6.然而,sars-cov-2属于rna病毒,在传播流行过程中病毒的基因组序列容易产生突变;例如,近期在全球各地出现的alpha英国突变株b.1.1.7,beta突变株b.1.351,gamma巴西突变株p.1和lambda秘鲁突变株c.37等等;特别是,最近还出现了传染性更强的流行毒株,delta突变株b.1.617.2和omicron(奥密克戎)突变株b.1.1.529。据报道,奥密克戎突变株的刺突蛋白(s蛋白)上有多达32处变异,并且其中多处变异导致其对目前各国使用的新冠疫苗有更强的抗药性,临床上治疗新冠的抗体也基本都失效。
7.因此,开发能够广谱中和多种新冠病毒突变株的抗体,尤其是能够中和新出现的新冠病毒突变株的抗体,对于本领域的研究学者来说是非常紧迫的研究课题。
8.为了提高中和抗体对新冠病毒的中和广度和中和能力,研究人员们对已有的新冠中和抗体进行基因工程改造,希望构建能够靶向病毒的多个表位(有效抑制逃逸现象),广谱性和中和活性都更好的抗体。双特异性抗体就是一个有前景的研究方向。
9.双特异性抗体(bispecific antibody,bsab)是含有两种特异性抗原结合位点,能
够同时靶向两个不同的表位的人工抗体。bsab不仅能够靶向同一分子的两个表位起到多位点特异性结合的作用,也能够靶向不同靶分子的两个表位起到不同靶分子之间的桥梁作用,因此具有作为治疗药物的巨大潜力。
10.双特异性抗体最初是通过融合两个不同抗体的杂交瘤来制备。由于每个杂交瘤均能够产生不同的免疫球蛋白,融合所得的杂交瘤或四倍体瘤理论上能够产生具有同时第一个亲本杂交瘤和第二个亲本杂交瘤的抗原特异性的抗体,然而这种方法产生的抗体轻重链配对组合复杂,正确配对比率低,无法达到药物生产所期望的效果。科学家们也开发了诸如“结-入-穴”(knob-into-hole)和单基因编码的双特异性抗体的构建方法。
11.因此,本领域技术人员希望通过上述的方法来开发新的能够中和多种冠状病毒,尤其是新出现的多种新冠病毒突变株的双特异性抗体。
技术实现要素:
12.为解决上述技术问题,本发明一方面提供了一种中和冠状病毒的双特异性抗体,所述双特异性抗体包含两个单链抗体片段scfv-1和scfv-2,其中,
13.所述scfv-1的轻链可变区vl-1包含如seq id no.1所示的轻链可变区的lcdr1-1序列、如seq id no.2所示的轻链可变区的lcdr2-1序列以及如seq id no.3所示的轻链可变区的lcdr3-1序列;
14.所述scfv-1的重链可变区vh-1包含如seq id no.4所示的重链可变区的hcdr1-1序列、如seq id no.5所示的重链可变区的hcdr2-1序列以及如seq id no.6所示的重链可变区的hcdr3-1序列;
15.所述scfv-2的轻链可变区vl-2包含如seq id no.7所示的轻链可变区的lcdr1-2序列、如seq id no.8所示的轻链可变区的lcdr2-2序列以及如seq id no.9所示的轻链可变区的lcdr3-2序列;
16.所述scfv-2的重链可变区vh-2包含如seq id no.10所示的重链可变区的hcdr1-2序列、如seq id no.11所示的重链可变区的hcdr2-2序列以及如seq id no.12所示的重链可变区的hcdr3-2序列。
17.优选的,所述scfv-1的轻链可变区vl-1的序列如seq id no.13所示,或者,其与seq id no.13所示序列有80%以上的序列同源性;
18.所述scfv-1的重链可变区vh-1的序列如seq id no.14所示,或者,其与seq id no.14所示序列有80%以上的序列同源性;
19.所述scfv-2的轻链可变区vl-2的序列如seq id no.15所示,或者,其与seq id no.15所示序列有80%以上的序列同源性;
20.所述scfv-2的重链可变区vh-2的序列如seq id no.16所示,或者,其与seq id no.16所示序列有80%以上的序列同源性。
21.关于氨基酸序列的“序列同源性”的百分比,是通过确定两个序列中存在的氨基酸残基的数目来产生匹配位置的数目,将匹配位置的数目除以比较窗口中的位置总数,将结果乘以100从而产生序列的同源性百分比。
22.在本发明的一个具体实施方案中,上述scfv-1的轻链可变区vl-1可以在seq id no.13所示序列的基础之上进行少量氨基酸的缺失、插入或者氨基酸突变,获得同源性在
80%以上的氨基酸序列。少量氨基酸的置换(缺失或插入,或者氨基酸突变,或者相似氨基酸的替代),特别是在构架区部分的保守的氨基酸置换所获得的变体,其与seq id no.13所示序列具有较高的同源性(80%以上的同源性),且保留了轻链可变区原有的性质和功能,即与冠状病毒特异性结合的抗体性质和功能,那么,这些变体也落入本发明的保护范围之内。同样的,上述scfv-1的重链可变区vh-1也可以在seq id no.14所示序列的基础之上进行少量氨基酸的缺失、插入或者氨基酸突变,特别是在构架区部分的保守的氨基酸置换所获得的变体,所获得的变体保留了重链可变区原有的性质和功能,即与冠状病毒特异性结合的抗体性质和功能,这些变体也都落入本发明的保护范围之内。同理,上述情况也适用于scfv-2的轻链可变区vl-2和scfv-2的重链可变区vh-2,具体不再赘述。
23.其中,构架区,是指位于cdr之间的氨基酸序列,包括重链可变区的构架区和轻链可变区的构架区。
24.优选的,所述scfv-1的c端通过第一接头肽与所述scfv-2的n端连接,或者scfv-2的c端通过第一接头肽与所述scfv-1的n端连接。
25.优选的,所述scfv-1从n端到c端依次包含所述轻链可变区vl-1、第二接头肽和所述重链可变区vh-1;或者,所述scfv-1从n端到c端依次包含所述重链可变区vh-1、第二接头肽和所述轻链可变区vl-1;
26.所述scfv-2从n端到c端依次包含所述轻链可变区vl-2、第三接头肽和所述重链可变区vh-2;或者,所述scfv-2从n端到c端依次包含所述所述重链可变区vh-2、第三接头肽和轻链可变区vl-2;
27.所述第一接头肽的序列为glyser(gly4ser)4模式,第二接头肽和第三接头肽的序列为(gly4ser)3模式。
28.优选的,所述双特异性抗体还包括人igg1的fc结构域。
29.优选的,所述scfv-1的c端通过第一接头肽与所述scfv-2的n端连接,所述scfv-2的c端通过铰链肽连接人igg1的fc结构域;或者,
30.所述scfv-2的c端通过第一接头肽与所述scfv-1的n端连接,所述scfv-1的c端通过铰链肽连接人igg1的fc结构域。
31.优选的,所述人igg1的fc结构域从n端到c端依次包含重链恒定区ch2和重链恒定区ch3;所述重链恒定区ch2的序列如seq id no.17所示;
32.所述重链恒定区ch3的序列如seq id no.18所示;所述铰链肽的序列如seq id no.19所示。
33.本发明另一方面提供了一种中和冠状病毒的双特异性抗体的同源二聚体,其中,所述中和冠状病毒的双特异性抗体的同源二聚体为:当上述的双特异性抗体在宿主细胞中表达时,所述的人igg1的fc结构域发生同源二聚化所形成的同源二聚体。
34.本发明再一方面提供了一种核酸分子,其中,所述核酸分子编码如上述的双特异性抗体。
35.优选的,所述核酸分子中,编码所述scfv-1的核酸序列如seq id no.20所示;所述核酸分子中,编码所述scfv-2的核酸序列如seq id no.21所示。
36.优选的,编码所述双特异性抗体的核酸序列如seq id no.22所示。
37.本发明再一方面提供了一种包含上述核酸分子的载体。
38.术语“载体”一词指的是,可将编码某蛋白的多聚核苷酸插入其中并使该蛋白获得表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内得以表达。载体可以包含多种控制表达的元件,例如启动子序列、转录起始序列、增强子序列、选择元件及报告基因等。另外,载体还可含有复制起始位点。载体还有可能包括协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。在本发明的实施方案中,载体可以选自,但不限于:质粒、噬菌粒、柯斯质粒、人工染色体(如酵母人工染色体yac、细菌人工染色体bac或p1来源的人工染色体pac)、噬菌体(如λ噬菌体或m13噬菌体)以及用作载体的动物病毒,例如,逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。
39.本发明再一方面提供了一种包含上述载体的宿主细胞。
40.关于“宿主细胞”,可以选择,但不限于:大肠杆菌或枯草菌等原核细胞,酵母细胞或曲霉菌等真菌细胞,s2果蝇细胞或sf9等昆虫细胞,或者纤维原细胞、cho细胞、cos细胞、nso细胞、hela细胞、bhk细胞、hek293细胞等动物细胞模型。
41.优选的,所述宿主细胞为hek293细胞。
42.本发明再一方面提供了一种药物组合物,其中,所述药物组合物包含上述的双特异性抗体,或者包含上述的同源二聚体。
43.本发明再一方面提供了上述的双特异性抗体、上述的同源二聚体,或者上述的药物组合物,在制备治疗或预防由冠状病毒所导致的疾病的药物方面的用途。
44.在本发明的一个优选实施方案中,所述用途是指在制备治疗或预防sars-cov-2及其突变株、sars-cov或类sars冠状病毒所导致的疾病的药物方面的用途。
45.在本发明的一个更优选实施方案中,所述sars-cov-2突变株为alpha、beta、gamma、delta、lambda或omicron突变株。
46.本发明再一方面提供了一种检测产品,其中,所述检测产品包含上述的双特异性抗体,或者包含上述的同源二聚体。
47.所述检测产品用于检测冠状病毒在样品中的存在或水平。
48.在本发明的一个具体实施方案中,所述检测产品包括,但不限于,检测试剂、检测试剂盒、检测芯片或试纸等。
49.本发明的上述双特异性抗体可以通过化学方法或者基因工程的方法进行标记,标记后的抗体或其抗原结合片段可以用于检测;标记后的抗体或其抗原结合片段,落入本发明的保护范围之内。
50.具体的检测方法,可以采用以下步骤,1)提供样品;2)将所述样品与上述本发明的双特异性抗冠状病毒抗体进行接触;3)检测样品与抗体或其抗原结合片段之间的免疫反应。
51.本发明再一方面提供了一种生产上述的双特异性抗冠状病毒抗体的方法,其中,通过培养含有编码上述的双特异性抗冠状病毒抗体的核酸分子的宿主细胞,以生产上述双特异性抗冠状病毒抗体。
52.本发明再一方面提供了一种生产上述的双特异性抗体的同源二聚体的方法,培养上述的宿主细胞,当如上述的双特异性抗体在所述宿主细胞中表达时,所述的人igg1的fc
no.13所示,或者,其与seq id no.13所示序列有80%以上的序列同源性;所述scfv-1的重链可变区vh-1的序列如seq id no.14所示,或者,其与seq id no.14所示序列有80%以上的序列同源性。
65.具体在本实施例中,所述scfv-1的轻链可变区vl-1的序列如seq id no.13所示,所述scfv-1的重链可变区vh-1的序列如seq id no.14所示。
66.具体来说,本技术实施例1的单链抗体片段scfv-1的轻链可变区vl-1采用了单抗gw01的轻链可变区的序列,重链可变区vh-1采用了单抗gw01的重链可变区的序列。关于单抗gw01的技术内容,参见公开号为cn111793129a的发明专利申请公开文件(即本技术的申请人于2020年07月28日递交的申请号为20201074031.9的专利申请);根据已公开的信息,单抗gw01为全人源抗体,可以特异性结合sars-cov和sars-cov-2的s1蛋白的受体结合区rbd。
67.在本发明的一个具体实施方案中,所述scfv-2的轻链可变区vl-2包含如seq id no.7所示的轻链可变区的lcdr1-2序列、如seq id no.8所示的轻链可变区的lcdr2-2序列以及如seq id no.9所示的轻链可变区的lcdr3-2序列;所述scfv-2的重链可变区vh-2包含如seq id no.10所示的重链可变区的hcdr1-2序列、如seq id no.11所示的重链可变区的hcdr2-2序列以及如seq id no.12所示的重链可变区的hcdr3-2序列。
68.在本发明的一个优选实施方案中,所述scfv-2的轻链可变区vl-2的序列如seq id no.15所示,或者,其与seq id no.15所示序列有80%以上的序列同源性;所述scfv-2的重链可变区vh-2的序列如seq id no.16所示,或者,其与seq id no.16所示序列有80%以上的序列同源性。
69.具体在本实施例中,所述scfv-2的轻链可变区vl-2的序列如seq id no.15所示;所述scfv-2的重链可变区vh-2的序列如seq id no.16所示。
70.具体来说,本技术实施例1的单链抗体片段scfv-2的轻链可变区vl-2采用了单抗16l9的轻链可变区的序列,重链可变区vh-2采用了单抗16l9的重链可变区的序列。关于单抗16l9的技术内容,参见公开号为cn112159469a的发明专利申请公开文件(即本技术的申请人于2020年09月30日递交的申请号为202011065506.2的专利申请);根据已公开的信息,单抗16l9为全人源抗体,可以特异性结合sars-cov-2的s1蛋白的受体结合区rbd。
71.在本技术的一个具体实施方案中,scfv-1的c端通过第一接头肽与所述scfv-2的n端连接。在本技术的另一个具体实施方案中,也可以是scfv-2的c端通过第一接头肽与所述scfv-1的n端连接。
72.在本实施例中,scfv-1的c端通过第一接头肽(linker-a)与scfv-2的n端连接,且scfv-1从n端到c端依次包含轻链可变区vl-1、第二接头肽(linker-b)和重链可变区vh-1,scfv-2从n端到c端依次包含轻链可变区vl-2、第三接头肽(linker-c)和重链可变区vh-2。
73.即,实施例1的双特异性抗体,从n端到c端依次为:scfv-1—linker-a—scfv-2;更具体地,实施例1的双特异性抗体,从n端到c端依次为:vl-1—linker-b—vh-1—linker-a—vl-2—linker-c—vh-2。
74.当然,在本技术的其他实施方案中,抗体的结构也可以是vh-1—linker-b—vl-1—linker-a—vl-2—linker-c—vh-2、vl-1—linker-b—vh-1—linker-a—vh-2—linker-c—vl-2或者vh-1—linker-b—vl-1—linker-a—vh-2—linker-c—vl-2。
75.在本技术的其他实施方案中,抗体的结构也可以是vl-2—linker-c—vh-2—linker-a—vl-1—linker-b—vh-1、vh-2—linker-c—vl-2—linker-a—vl-1—linker-b—vh-1、vl-2—linker-c—vh-2—linker-a—vh-1—linker-b—vl-1或者vh-2—linker-c—vl-2—linker-a—vh-1—linker-b—vl-1。
76.在本实施例中,scfv-1与scfv-2之间的第一接头肽(linker-a),其序列采用glyser(gly4ser)4模式,具体如seq id no.23所示。
77.在本实施例中,第二接头肽(linker-b)和第三接头肽(linker-c)的序列,均采用(gly4ser)3模式,具体如seq id no.24所示。
78.在本技术的一个具体实施方案中,双特异性抗体还包括人igg1的fc结构域。
79.在本技术的一个具体实施方案中,scfv-1的c端通过第一接头肽与scfv-2的n端连接,scfv-2的c端通过铰链肽(hinge)连接人igg1的fc结构域。在本技术的另一个具体实施方案中,也可以是scfv-2的c端通过第一接头肽与所述scfv-1的n端连接,scfv-1的c端通过铰链肽(hinge)连接人igg1的fc结构域。
80.在本实施例中,双特异性抗体的序列,从n端到c端依次为:scfv-1—linker-a—scfv-2—hinge—fc。
81.在本技术的一个具体实施方案中,人igg1的fc结构域从n端到c端依次包含重链恒定区ch2和重链恒定区ch3;
82.即,实施例1的双特异性抗体的序列,从n端到c端依次为:
83.vl-1—linker-b—vh-1—linker-a—vl-2—linker-c—vh-2—hinge—ch2—ch3。
84.其中,重链恒定区ch2的序列如seq id no.17所示;重链恒定区ch3的序列如seq id no.18所示;铰链肽hinge的序列如seq id no.19所示。
85.实施例1的中和冠状病毒的双特异性抗体的制备
86.步骤1)构建含有fc基因片段的抗体表达载体pcdna3.4-fc
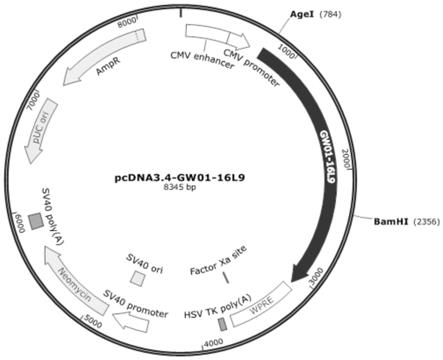
87.通过金斯瑞公司合成全人源igg1信号肽基因sp、铰链肽hinge、重链恒定区ch2和重链恒定区ch3的基因片段,即sp-fc基因。在信号肽和铰链肽基因之间插入agei和bamhi酶切位点,中间由gtacgc序列间隔开来,即合成sp-agei-bamhi-fc序列将sp-agei-bamhi-fc基因通过ta克隆的方式连接到pcdna3.4载体上,最终得到pcdna3.4-fc表达载体,其中pcdna3.4载体购自赛默飞世尔科技有限公司,其具体的质粒图谱如图1所示。
88.步骤2)合成抗体基因序列
89.如上所述,实施例1的单链抗体片段scfv-1的轻链可变区vl-1采用了单抗gw01的轻链可变区的序列(如seq id no.13所示),重链可变区vh-1采用了单抗gw01的重链可变区的序列(如seq id no.14所示);两者之间的第二接头肽(linker-b)如seq id no.24所示。
90.与之对应的,编码scfv-1的核酸序列如seq id no.20所示;
91.实施例1的单链抗体片段scfv-2的轻链可变区vl-2采用了单抗16l9的轻链可变区的序列(如seq id no.15所示),重链可变区vh-2采用了单抗16l9的重链可变区的序列(如seq id no.16所示);两者之间的第三接头肽(linker-c)如seq id no.24所示。
92.与之对应的,编码scfv-2的核酸序列如seq id no.21所示。
93.由南京金斯瑞公司,按常规方法合成单链抗体scfv-1—linker-a—scfv-2对应的
核苷酸序列,如seq id no.22所示。
94.步骤3)构建双特异性抗体基因的表达载体
95.将上述第2)步骤合成的单链抗体scfv-1—linker-a—scfv-2的核苷酸序列的n端和c分别经agei和bamhi酶切后,连接胶纯化回收后的目的片段到上述第1)步骤构建的pcdna3.4-fc表达载体中,并转化dh5α感受态细胞构建最终双特异性抗体的表达质粒,将其命名为pcdna3.4-gw01-16l9,其质粒图谱如图2所示。
96.步骤4)双特异性抗体在哺乳动物细胞293f中的表达
97.双特异性抗体的表达质粒经质粒纯化试剂盒(美基生物)纯化,并利用ez trans细胞转染试剂(李记生物)共转染hek293f细胞表达。
98.具体转染步骤为:转染前一天将50ml的293f细胞以1.2
×
106个细胞/ml的密度铺在250ml细胞培养摇瓶中,转染当天用转染试剂ez-trans与步骤3)构建的表达质粒充分混合(质量体积比为dna:ez-trans=1:3)溶于无血清的opm培养基中得到en-trans混合物(即60μg dna和180μl ez-trans溶于4ml培养基),静置15分钟后将ez-trans-dna混合物以雨滴状均匀加入hek293f细胞中,转染六天后离心获取细胞培养上清用于后续的双特异性抗体的提取和纯化步骤。(附注:当抗体在宿主细胞中表达时,人igg1的fc结构域会发生同源二聚化形成同源二聚体;经后续的提取和纯化后,进行鉴定。)
99.步骤5)抗体的提取和纯化
100.将上述步骤4)收集的细胞上清液用0.45μm滤膜过滤,用结合缓冲液1
×
pbs稀释上清,利用protein-g柱(天地人和生物科技公司,常州)纯化上清中的含igg1 fc的双特异性抗体,纯化方法参照protein-g柱的使用说明。纯化获得的双特异性抗体,将其命名为双抗gw01-16l9。
101.利用nanodrop2000(thermofisher)测定280nm吸光值并计算抗体浓度。亲和纯化后抗体通过sds-page进行纯度分析和鉴定,取5μl纯化后的样品与20μl 5
×
上样缓冲液混合,放入100℃的金属水浴锅中加热10分钟,取加热后的样品混合液10μl上样于page gels(南京金斯瑞生物科技有限公司),经电泳将样品按分子量大小分离,分离完样品的凝胶经考马斯亮蓝r250染色3小时后,用脱色液进行脱色,于geldoc go gel imaging system(bio-rad)拍照获得表达纯化的双特异性抗体的sds-page检测结果,如图3所示。下述的实施例2,以及对比例1和2的抗体的sds-page均显示在图3中。
102.实施例2
103.实施例2的抗体的序列结构,从n端到c端依次为:
104.vl-2—linker-c—vh-2—linker-a—vl-1—linker-b—vh-1—hinge—ch2—ch3。
105.实施例2的抗体制备过程,除了步骤2)按照各自的抗体序列进行合成以外,其他步骤基本同实施例1,具体不再赘述。
106.实施例2的抗体,命名为双抗16l9-gw01。
107.效果数据
108.一、sars-cov-2及其突变株、sars-cov、蝙蝠类sars冠状病毒(btsl-cov)wiv-1、rs3367假病毒的生产
109.sars-cov-2及其突变株、sars-cov、btsl-cov wiv-1、rs3367、假病毒是表面分别
具有各自相应的刺突膜蛋白(spike,s),携带荧光素酶报告基因的非复制缺陷型逆转录病毒颗粒,可以模拟sars-cov-2及其突变株、btsl-cov wiv-1、rs3367、sars-cov病毒对宿主细胞(如人肝癌细胞系huh-7、稳定表达人ace2受体的293t细胞系293t-ace2)的感染过程,并在感染细胞内表达荧光素酶报告基因。由于假病毒感染不会产生具有感染能力的病毒颗粒,因此可以安全地在生物安全二级实验室内进行相关操作。
110.sars-cov-2、btsl-cov wiv-1、rs3367和sars-cov假病毒分别通过各自的s蛋白表达质粒和带荧光素酶报告基因的hiv env缺陷的骨架质粒(pnl4-3.luc.r-e-)共转染293t细胞获得。
111.sars-cov-2、sars-cov、btsl-cov wiv-1和rs3367的s基因序列根据ncbi genbank序列nc_045512、abd72979.1、kc881007.1和kc881006.1设计,基因序列经密码子优化后,由南京金斯瑞公司合成,并连接到pcdna3.1真核表达载体构建成sars-cov-2、sars-cov、btsl-cov wiv-1和rs3367s蛋白表达质粒。其中,sars-cov-2突变株假病毒alpha、beta、gamma、delta、lambda、omicron需要对s蛋白表达质粒进行相应的点突变和缺失突变。pnl4-3.luc.r-e-骨架质粒源自美国nih aids reagent program。所有质粒通过转化dh5α感受态细胞扩增,并利用美基生物生产的质粒纯化试剂盒纯化,纯化操作过程参照试剂盒说明书。
112.293t细胞在含10%胎牛血清(gibco)的dmem培养基培养,转染前接种到10cm细胞平皿中。培养24小时后,利用eztrans细胞转染试剂(李记生物)将骨架质粒(pnl4-3.luc.r-e-)与表达sars-cov、btsl-cov wiv-1、rs3367、sars-cov-2及其突变株表达质粒以3:1的比例共转染293t细胞,详细转染方法参见ez trans细胞转染试剂的使用说明书。转染48小时后,收取含有假病毒的上清液,2500转离心10分钟去除细胞碎片后并分装冻存于-80℃冰箱,用于中和抗体的检测。
113.二、本技术实施例1和2的双特异性抗体(gw01-16l9和16l9-gw01)对sars-cov-2及其突变株(alpha、beta、gamma、delta、lambda和omicron),以及包括sars-cov、蝙蝠类冠状病毒btsl-cov wiv1、rs3367在内的多种冠状病毒的假病毒的中和活性的检测
114.在96孔细胞板上测试不同浓度的双特异性抗体抑制假病毒感染huh-7细胞来检测其对sars-cov-2及其突变株、sars-cov、btsl-cov wiv-1、和rs3367病毒的中和能力。
115.检测方法大致如下:1)huh-7细胞接种于96孔细胞板,每孔接种1
×
104个,37℃,5%co2细胞培养箱培养24小时;2)将实施例和对比例抗体以细胞培养基稀释成不同浓度,与等体积含100tcid50的假病毒稀释液混合,在37℃孵育1小时;3)弃掉细胞培养液,每孔加入50μl病毒抗体复合物,设置复孔,同时设置无抗体组,无病毒组及阳性血清对照组;4)培养12小时后,每孔加入150μl维持液,37℃继续培养48小时;5)利用荧光素酶检测试剂盒(luciferase assay system,promega cat.#e1500)裂解细胞并检测每孔的荧光素酶活性,具体检测方法参照试剂盒说明书;利用多功能酶标仪(perkin elmer)检测每孔化学发光rlu值;6)根据抗体与病毒对照rlu值的比例计算不同浓度抗体对假病毒的中和抑制百分比,并利用prism7软件(graphpad)计算出抗体抑制病毒的半数抑制剂量ic50(单位μg/ml)。
116.实验组1:采用本技术实施例1的双特异性抗体gw01-16l9;
117.实验组2:采用本技术实施例1的双特异性抗体16l9-gw01;
118.对比组1:采用全人源新型冠状病毒单抗gw01(对比例1);
119.对比组2:采用全人源新型冠状病毒单抗16l9(对比例2)。
120.检测结果如下表1所示:
121.表1
[0122][0123]
表1为实施例1和2的双特异性抗体(gw01-16l9和16l9-gw01),以及对照组抗体(单抗gw01和单抗16l9)对多种新冠病毒突变株以及其他多种冠状病毒的中和ic50结果。
[0124]
从表1可以看出:
[0125]
1)实施例1和2的双特异性抗体(gw01-16l9和16l9-gw01)对于包括sars-cov-2alpha、beta、gamma、delta、lambda和omicron在内的多种新冠病毒突变株,以及sars-cov、蝙蝠类冠状病毒btsl-cov wiv1、rs3367假病毒均具有强效中和能力,证明了实施例1和2的双特异性抗体(gw01-16l9和16l9-gw01)能够中和多种新冠病毒突变株以及其他多种冠状病毒,证明了实施例1和2的双特异性抗体(gw01-16l9和16l9-gw01)在中和冠状病毒方面的广谱性。
[0126]
2)令人惊喜的发现是,对于最近刚出现的omicron突变株,对比例1和2(单抗gw01和单抗16l9)的ic50值均大于50μg/ml,然而它们组合后的双特异性抗体(gw01-16l9和16l9-gw01)的ic50值却分别为0.0538μg/ml、0.5334μg/ml。这说明单抗gw01和单抗16l9各自对于omicron突变株均没有中和效力,但是它们组合后形成的双特异性抗体(gw01-16l9和16l9-gw01)却意外表现出显著的中和能力,尤其是gw01-16l9表现出显著的强效中和能力。
[0127]
这一发现,让发明人也感觉到非常的意外和惊喜,也希望能够及时的公开并进行临床推广,为防控omicron突变株所引发的新一轮疫情做出贡献。
[0128]
综上,本技术实施例1和2的双特异性抗体(gw01-16l9和16l9-gw01)对于包括sars-cov-2alpha、beta、gamma、delta、lambda和omicron在内的多种新冠病毒突变株,以及包括sars-cov-2、sars-cov、btsl-cov wiv-1和rs3367在内的多种冠状病毒均具有强效中和能力,在中和冠状病毒方面的变现出优良的广谱性,显著优于目前fda批准用于covid-19
临床治疗的casirivimab和imdevimab等抗体;特别是,对于最近刚出现的omicron突变株,本技术实施例1和2的双特异性抗体也意外表现出显著的中和能力。
[0129]
基于本技术实施例1和2的双特异性抗体的效果数据,证明了单抗gw01与16l9的组合构成的双特异性抗体(gw01-16l9和16l9-gw01)在中和冠状病毒方面优良的广谱性,特别是对于多种新冠病毒突变株均具有强效中和能力。
[0130]
在本领域技术人员获得本技术的公开内容和精神实质的基础之上,可以在本技术实施例1的双抗序列基础上进行一些简单调整,例如,在实施例1的双抗序列基础上调换一下轻链和重链的前后顺序,获得如vh-1—linker-b—vl-1—linker-a—vl-2—linker-c—vh-2、vl-1—linker-b—vh-1—linker-a—vh-2—linker-c—vl-2或者vh-1—linker-b—vl-1—linker-a—vh-2—linker-c—vl-2的抗体。也可以在实施例2的双抗序列基础上调换一下轻链和重链的前后顺序,获得如vh-2—linker-c—vl-2—linker-a—vl-1—linker-b—vh-1、vl-2—linker-c—vh-2—linker-a—vh-1—linker-b—vl-1或者vh-2—linker-c—vl-2—linker-a—vh-1—linker-b—vl-1的抗体;可以合理地推测出它们均具有与实施例1和2双抗类似的效果;这些等同替换方案均落入本技术的保护范围内。
[0131]
本领域技术人员也可以在本技术实施例1和2的双抗序列基础之上,对于接头肽序列、fc结构域序列和铰链肽序列等进行常规的等同替换;本领域技术人员也可以在本发明的双抗序列基础之上做出不影响抗体整体效果的氨基酸插入、替换或缺失处理;这些等同替换方案均落入本技术的保护范围内。
[0132]
从上述内容可以看出,本发明的中和冠状病毒的双特异性抗体及其同源二聚体对于冠状病毒具有优良的广谱、强效中和能力,因此,本领域技术人员在获知这一技术内容的基础上,可以开发包含本发明的双特异性抗体或其同源二聚体的药物组合物;以及,本发明的双特异性抗体或其同源二聚体,或包含它们的药物组合物在制备治疗或预防由冠状病毒所导致的疾病的药物方面的用途。
[0133]
除此之外,本领域技术人员在获知上述技术内容的基础上,开发包含本发明的双特异性抗体或其同源二聚体的检测产品,用于检测冠状病毒在样品中的存在或水平。
[0134]
应用例
[0135]
本应用例描述了本技术实施例1的双特异性抗体来治疗包括sars-cov-2在内的冠状病毒所导致的疾病的方法。
[0136]
尽管提供了特定施用方法、剂量和模式,但是本领域技术人员将理解的是可在实质性不影响治疗的情况下作改变。基于本文公开的指导,可通过施用治疗有效量的本文所述的双特异性抗体来治疗或预防冠状病毒感染,从而降低或消除冠状感染。
[0137]
具体的施用方法如下:
[0138]
1)对象的预治疗:在具体实施例中,在施用包括本领域技术人员已知的一种或多种抗病毒药物疗法的治疗剂之前先对对象进行治疗。然而,并不总是要求进行此种预治疗,并可经熟练的临床医生决定。
[0139]
2)治疗组合物的施用
[0140]
筛选对象之后,将上述的治疗有效剂量的本技术实施例1的双特异性抗体施用于对象(如处于感染sars-cov-2冠状病毒风险或已知感染sars-cov-2冠状病毒的成年人或新生婴儿)。可将另外药物如抗病毒剂在施用所公开的药剂同时、之前或之后施用于对象。通
过本领域已知的任何方法如口服施用、吸入、静脉、肌肉、腹膜内或皮下来实现施用。为预防、降低,抑制和/或治疗对象的状况,而施用的组合物的量取决于正在治疗的对象、病症的严重程度和治疗对象的施用方式。理想地,药剂的治疗有效量是足以预防、降低、和/或抑制、和/或治疗对象的状况而不引起对象中实质性细胞毒性效应的量。有效量可容易地由本领域技术人员例如用建立剂量应答曲线的常规试验来确定。同样地,这些组合物可用惰性稀释剂或药学上可接受的载体配制。在一个具体实例中,根据sars-cov-2病毒感染的特定阶段,每两周以5mg每kg或每两周10mg每kg施用抗体。在一实例中,连续施用抗体。在另一实例中,以50μg每kg施用抗体,每周两次,持续2-3周。治疗组合物可长期施用(如持续几个月或几年时间)。
[0141]
3)评价
[0142]
施用一种或多种疗法之后,监控感染sars-cov-2的对象sars-cov-2病毒水平的降低,或与新冠肺炎疾病相关的一种或多种临床症状的减少。在特定实例中,治疗2天后开始,对对象进行一次或多次分析。采用本领域已知的任何方法监控对象。例如,可获得来自对象的生物样品包括咽拭子,并对sars-cov-2病毒水平的变化进行评估。
[0143]
4)额外治疗
[0144]
在具体实施例中,如果对象稳定或对治疗有少量的、混合的或部分的应答,可在用他们之前接受了期望时间的相同方案和物质制剂进行再评价之后,进行额外的治疗。
[0145]
应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
[0146]
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式或变更均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1