一种基于核酸核酶与环状向导RNA调控的Cas12a-
一种基于核酸核酶与环状向导rna调控的cas12a-c
crrna系统及其应用
技术领域
1.本发明属于分析检测技术领域,具体涉及一种基于核酸核酶与环状向导rna调控的cas12a-c
crrna系统及其在生物传感方面的应用。
背景技术:
2.分子生物传感对于临床诊断、生物安全、食品安全和环境监测至关重要。目前,crispr-cas系统作为信号放大工具已被广泛用于生物传感领域。研究人员基于crispr-cas体系已建立了许多核酸检测方法,广泛用于传染性或非传染性疾病的诊断。然而,对于非核酸类生物标志物(例如小分子、蛋白质和金属离子)的传感方法数量非常有限,急需拓展。
3.在自然界中,共价闭合环状rna(circrnas)广泛存在于类病毒、拟病毒中以及真核生物、细菌和古细菌拼接的内含子或外显子中。circrnas可以通过化学或酶促连接反应制备,是可用于各种功能设备的一类独特的核酸纳米结构。目前,已建立的基于crispr-cas的生物传感系统均利用线状向导rna(
l
crrna)引导cas蛋白识别特定核酸序列,从而激活cas蛋白对单链dna(ssdna)或单链rna(ssrna)信号报告分子进行切割。由于circrnas与线状rna(
l
rna)相比表现出不同的结构和功能,导致其很少用于crispr生物传感系统的开发。
4.迄今为止,研究人员设计了多种可以切割rna的核酸核酶(nazymes),例如核糖核酶(ribozyme)、脱氧核酶(dnazymes)和适体核酶(aptazymes)。这些核酸核酶能够识别各种非核酸类的生物标志物,例如金属离子、小分子、寡核苷酸、蛋白质和致病细菌等。然而,利用核酸核酶对环状向导rna(ccrrna)切割来释放
l
crrna激活cas12a体系的相关研究还未见报道,这对拓展基于crispr-cas的非核酸类靶标检测具有重要意义。
技术实现要素:
5.鉴于此,本发明首次将ccrrna用于crispr-cas12a体系,证明ccrrna可以降低cas12a的切割活性,当nazyme对ccrrna进行切割时,释放出的
l
crrna可恢复cas12a的活性;此外,本发明构建了核酸核酶激活的cas12-c
crrna系统(na3c),实现了对小分子5'-三磷酸腺苷(atp)和两种致病菌(大肠杆菌和肺炎克雷伯菌)的实时、灵敏检测。从而,证明了本发明对非核酸类目标物检测的通用性,拓展了crispr-cas技术在生物传感和临床诊断领域的应用。
6.本发明提供如下技术方案:
7.一种环状ccrrna,所述的ccrrna通过线性
l
crrna模板和rna连接模板连接环化获得。
8.进一步地,所述的
l
crrna的核苷酸序列如seq id no:1-7所示;所述的rna连接模板的核苷酸序列如seq id no:8-13所示。
9.本发明提供一种基于核酸核酶与ccrrna调控cas12a的na3c系统,所述的系统包括cas12a、上述的ccrrna和核酸核酶。
10.基于以上技术方案,进一步地,所述的核酸核酶包括核苷酸序列如seq id no:14-20所示的核酸核酶。
11.基于以上技术方案,进一步地,所述的系统包括顺式切割底物dsdna和反式切割底物ssdna。
12.基于以上技术方案,进一步地,dsdna的核苷酸序列由seq id no:21和seq id no:22连接构成或者由seq id no:23和seq id no:24连接构成;ssdna的核苷酸序列如seq id no:25所示。
13.基于以上技术方案,进一步地,所述的ssdna序列的两端分别修饰fam荧光基团和dabcyl猝灭基团,cas12切割ssdna后,使得荧光基团与荧光猝灭基团分离,产生荧光信号。
14.基于以上技术方案,进一步地,所述的系统包括缓冲溶液、rnase抑制剂、氯化镁溶液。
15.基于以上技术方案,进一步地,所述的缓冲溶液包括tris-hcl和cas12a切割缓冲液,cas12a切割缓冲液组成为:20mm tris盐酸,100mm氯化钾,5mm氯化镁,1mm dtt,5%丙三醇,50μg/ml肝素钠,ph 7.5。
16.本发明一方面提供上述的na3c系统在生物传感和临床诊断方面中的应用。
17.本发明另一方面提供一种基于上述的na3c系统检测atp或致病菌的方法,包括以下步骤:
18.(1)在目标物存在的情况下,atp或致病菌响应的核酸核酶切割ccrrna,释放出
l
crrna;
19.(2)将步骤(1)中释放的
l
crrna与cas12a、顺式切割底物dsdna混合后,再加入反式切割底物ssdna后,检测荧光信号。
20.基于以上技术方案,进一步地,检测atp时,所述核酸核酶的核苷酸序列如seq id no.18所示。
21.基于以上技术方案,进一步地,所述的致病菌包括大肠杆菌和肺炎克雷伯菌。
22.基于以上技术方案,进一步地,检测大肠杆菌时,所述核酸核酶的核苷酸序列如seq id no.19所示。
23.基于以上技术方案,进一步地,检测肺炎克雷伯菌时,所述核酸核酶的核苷酸序列如seq id no.20所示。
24.本发明还提供一种应用上述的na3c系统检测临床尿液样本中大肠杆菌的方法,包括以下步骤:
25.(1)细胞收集:离心收集待检样品中的细菌细胞;
26.(2)细胞裂解:使用缓冲液洗涤步骤(1)得到的细菌细胞1次以上,将细胞沉淀悬浮于缓冲液中,超声破碎细胞,然后离心收集大肠杆菌的胞内混合物(cim);
27.(3)na3c检测:将步骤(2)得到的胞内混合物、ccrrna、核苷酸序列如seq id no.19所示的核酸核酶孵育10~60min,取所得混合液与cas12a和dsdna混合20~40min,加入反式切割底物ssdna后,检测荧光信号。
28.与现有技术相比,本发明的有益效果是:
29.本发明首次利用ccrrna组建crispr-cas12a系统,发现ccrrna能够降低cas12a的活性,利用核酸核酶对ccrrna切割,释放出
l
crrna,释放的
l
crrna能够恢复cas12a的活性。基于
ca-630,ph 7.5。
45.下述实施例中的洗脱缓冲液(1
×
wb):50mm hepes,100mm氯化钾,5mm氯化镁,0.01%(v/v)igepal ca-630,ph 7.5。
46.表1:本实施例中使用的核酸序列
47.[0048][0049]
实施例1基于核酸核酶与环状向导rna调控的cas12a系统并构建生物传感器的技术路线
[0050]
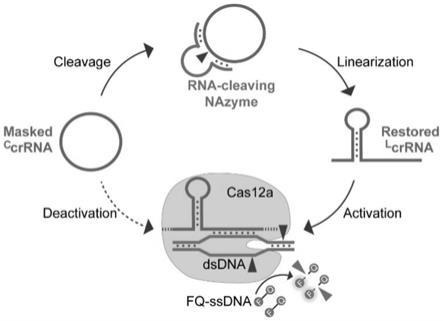
本技术基于核酸核酶与环状向导rna调控的cas12a系统并构建生物传感器的技术路线主要包括以下步骤:(1)ccrrna对cas12a系统的调控可行性验证,探究ccrrna对cas12a蛋白顺式切割和反式切割动力学的影响;(2)cas12a-crrna结合亲和力表征;(3)构建基于核酸核酶激活的cas12a系统;(4)构建atp和两种致病菌的生物传感器,探究该传感器对目标物检测的灵敏度、选择性,并用于实际临床样本的诊断,探究用于临床诊断的灵敏度和特异性。
[0051]
实施例2探究ccrrna对cas12a功能的调控
[0052]
本发明构建的基于核酸核酶与ccrrna调控cas12a系统的原理图如图1所示,是基于ccrrna可以降低cas12a对dna的切割活性,因此本发明首先探究ccrrna对cas12a功能的调控影响,主要包括ccrrna对cas12a顺式切割dsdna的反应动力学以及反式切割ssdna的反应动力学影响。
[0053]
(1)ccrrna
ii
的制备:5’磷酸化
l
crrna(如
l
crrnai、
l
crrna
ii
,100pmol)首先与连接模
板(如lti、lt
ii
,110pmol)和10μl 10
×
t4 rna ligase2(t4rl2)缓冲液(500mm tris盐酸,20mm氯化镁,10mm dtt,4mm atp)混合,加热至90℃2分钟,然后在室温(rt)下冷却15分钟;向该混合物中加入50u的t4rl2、100u的rnase抑制剂和无核酸酶的水,使总体积为100μl,37℃反应2小时后,所得ccrrna
ii
分子通过乙醇沉淀浓缩,10%dpage(8m尿素)纯化。
[0054]
(2)制备顺式切割底物双链dna:在50μl的1
×
hb缓冲液中,nts(500pmol)与ts(100pmol)在95℃下变性5分钟,然后梯度冷却(1℃/min)至rt。
[0055]
(3)ccrrna对cas12a顺式切割dsdna的动力学:5’标记fam的ts
ii
和nts
ii
用于制备dsdna
ii
。cas12a(5pmol)在室温下与ccrrna
ii
(41nt)或
l
crrna
ii
(2.5pmol)在50μl含有1u/μl rnase抑制剂的1
×
ccb中预组装10分钟。将1.25μl 2μm fam标记的dsdna
ii
添加到混合物中,并分别在37℃下孵育5、10、20、40和60分钟,然后在90℃下加热10分钟以灭活cas12a。通过15%变性聚丙烯酰胺凝胶电泳分析反应混合物。
[0056]
(4)ccrrna对cas12a反式切割ssdna的动力学:cas12a(10pmol)首先与dsdna
ii
(10pmol)、ccrrna
ii
或
l
crrna
ii
(10pmol)在37℃下50μl含有1u/μl rnase抑制剂的1
×
ccb中预组装30分钟。添加3.75μl 10μm的fq-ssdna报告基因,然后使用cary eclipse荧光分光光度计在37℃下实时测量荧光强度60分钟,每30秒进行一次荧光测量(λ
ex
:495nm;λ
em
:520nm)。
[0057]
实验结果如图2所示,ccrrna可使cas12a对dsdna的切割活性降低5倍,对ssdna的非特异性切割活性降低30倍。
[0058]
实施例3ccrrna与cas12a的亲和力表征
[0059]
(1)点印迹实验
[0060]
通过喷蜡打印机(xerox colourqube 8570n)在硝化纤维膜(millipore hf120)上打印直径为4mm的圆形测试区,120℃加热2min使蜡融进膜,形成疏水屏障。将1μl的cas12a(148ng/ul)点样在每个测试区。室温干燥10分钟后,用10μl含有1%bsa的1
×
bb溶液封闭30分钟。用20μl 1
×
wb洗涤两次后,加入10μl 100nm fam标记的
l
crrna
ii
或ccrrna
ii
,孵育30分钟。将纸板置于2ml 1
×
wb的槽中洗涤5分钟,干燥后,利用荧光成像仪扫描成像。
[0061]
通过点印迹实验的定性分析,图3a显示
l
crrna
ii
与cas12a结合的亲和力明显较好,而与ccrrna
ii
的结合亲和力较差。
[0062]
(2)荧光各向异性分析
[0063]
结合反应在100μl 1
×
bb中进行,缓冲液中含有5nm的fam标记的
l
crrna
ii
(或ccrrna
ii
)、不同浓度的cas12a和1u/μl rnase抑制剂。rt孵育30分钟后,在激发波长485nm和发射波长520nm的条件下,用酶标仪测量荧光各向异性值。
[0064]
通过荧光各向异性的定量分析,图3b显示
l
crrna
ii
与cas12a结合kd值为42
±
8nm;ccrrna
ii
与cas12a结合kd值为260
±
20nm,表明ccrrna
ii
与cas12a的亲和力和ccrrna
ii
与cas12a的亲和力
l
crrna
ii
相比,下降了6倍。
[0065]
实施例4构建核酸核酶激活的ccrrna的cas12a系统(na3c)
[0066]
实施例4主要包括基于核糖核酶(hh15)激活的cas12a系统以及基于脱氧核酶(10-23dnazyme)激活的cas12a系统,具体实验步骤如下:
[0067]
(1)hh15(或10-23dnazyme)对ccrrnai(或ccrrna
ii
)的切割:将1.25μl 2μmccrrnai(或ccrrna
ii
)、1.25μl 100μm hh15(或10-23dnazyme)、2μl 500mm tris-hcl(ph 7.5)和5μl
无核酸酶水混合,并在90℃下加热3分钟,冷却至室温。然后加入10μl 100mm氯化镁溶液和0.5μl rnase抑制剂(40u/μl),使总体积为20μl。然后将反应混合物在室温下孵育60分钟。所得混合物用于以下分析。
[0068]
(2)ccrrna切割产物的dpage分析:将10μl上述切割混合物与10μl 2
×
rna上样缓冲液(95%(v/v)甲酰胺、0.02%(w/v)sds、0.02%(w/v)溴酚蓝、0.01%(w/v)二甲苯氰醇、1mm edta)混合。利用20%dpage凝胶分离混合物,然后在室温下用1
×
sybr gold染色10分钟,荧光成像仪扫描成像。利用image quant软件计算hh15(或10-23dnazyme)切割产生的条带的荧光强度。
[0069]
(3)fq-ssdna切割的动力学分析:将20μl上述切割混合物与5μl 10
×
ccb、1.25μl rnase抑制剂(40u/μl)、1μl 10μm cas12a和1μl 10μm dsdnai(或dsdnaii)混合。在37℃下孵育30分钟后,加入18μl无核酸酶水和3.75μl 10μm fq-ssdna(总体积:50μl)。然后使用cary eclipse荧光分光光度计在37℃下实时测量荧光强度60分钟,每30秒进行一次荧光测量(λ
ex
:495nm;λ
em
:520nm)。
[0070]
图4显示hh15(或10-23dnazyme)可以切割ccrrnai(或ccrrna
ii
)释放出
l
crrnai(或
l
crrna
ii
),且释放出来的
l
crrnai(或
l
crrna
ii
)能够激活cas12a的切割活性,对fq-ssdna信号分子进行反式切割,恢复荧光。
[0071]
实施例5基于na3c系统生物传感器检测atp和两种致病菌(大肠杆菌和肺炎克雷伯氏菌)
[0072]
(1)atp检测:atp适体核酶(classⅰ(a))对ccrrnaa的切割实验除了使用fam标记的ccrrnaa,其余步骤与实施例4(1)相同。在atp检测实验中,1.25μl 2μm fam标记的ccrrnaa、2μl 500mm tris盐酸(ph 7.5)、1.25μl 100μm class i(a)和12μl无核酸酶水在90℃下变性3分钟。冷却至室温后,分别加入2μl不同浓度的atp(0、1、5、10、100、500、1000、5000和10000μm)、1μl 100mm氯化镁和0.5μl rnase抑制剂(40u/μl),在室温下孵育60分钟;分别取20μl上述切割混合物与5μl10
×
ccb、1.25μl rnase抑制剂(40u/μl)、1μl 10μm cas12a和1μl 10μm dsdnai混合,在37℃下孵育30分钟后,加入18μl无核酸酶水和3.75μl 10μm fq-ssdna(总体积:50μl),在37℃下测量荧光强度60分钟。
[0073]
同时分别使用1mm utp、ctp和gtp进行上述的实验,探究atp检测的特异性,结果如图5e所示。
[0074]
图5显示,na3c系统释放的荧光强度与atp的浓度成正比,检出限低至500nm,同时对utp、gtp、ctp没有响应,对atp具有良好的选择性。
[0075]
(2)致病菌检测:大肠杆菌(cicc 23796)、铜绿假单胞菌(atcc 9027)和唐菖蒲伯克霍尔德菌(cicc 10574)在5ml luria bertani(lb)中生长过夜;肺炎克雷伯菌(atcc 13883)在5ml胰蛋白酶大豆肉汤(tsb)中过夜生长,并在37℃培养箱下连续摇动,直到培养物的od
600
达到~1。取1ml培养物在4℃下以11,000g离心10分钟。在0℃下将细胞沉淀悬浮在100μl 1
×
erb中。将细菌细胞超声1分钟,然后在4℃下以11,000g离心10分钟。得到的胞内混合物(cim)用于以下实验。
[0076]
检测大肠杆菌时:将10μl 2
×
erb、1.25μl 2μm c
crrnab、1.25μl 100μm ec1(seq id no:19)和1μl无核酸酶水混合,在90℃下加热3分钟,冷却至室温。随后加入1.5μl rnase抑制剂(40u/μl)和5μl不同浓度的大肠杆菌cim(107、106、105、104、103、102和0cfu/ml),将反
应混合物在室温下温育30分钟。将20μl上述反应混合物与5μl 10
×
ccb、1.25μl rnase抑制剂(40u/μl)、1μl 10μm cas12a和1μl 10μm dsdna
ii
混合。在37℃下孵育30分钟后,加入18μl无核酸酶水和3.75μl 10μm fq-ssdna(总体积:50μl)。将反应混合物在37℃下测量荧光强度60分钟。探究特异性时,使用106cfu/ml浓度的铜绿假单胞菌、肺炎克雷伯菌、唐菖蒲伯克霍尔德菌的cim进行上述实验。检测肺炎克雷伯菌时,所用到的环状向导rna为ccrrnab,核酸核酶序列为kp6(seq id no:20),除此之外实验步骤与检测大肠杆菌相同。
[0077]
通过na3c对两种致病菌(大肠杆菌、肺炎克雷伯菌)的检测性能结果如图5和图6所示,荧光强度与大肠杆菌或肺炎克雷伯菌的浓度均成正比,对两种致病菌的检出限均低至102cfu/ml,同时对干扰菌没有响应,具有很高的特异性。
[0078]
实施例6利用na3c检测临床尿液中的大肠杆菌
[0079]
na3c检测临床尿液中大肠杆菌的具体流程如图8a所示,包括大肠杆菌细胞收集,细胞裂解,na3c反应等过程,具体操作如下:
[0080]
(1)细胞收集:11000g离心10分钟收集样品(1ml)中的细菌细胞。
[0081]
(2)细胞裂解:1
×
wb洗涤两次后,将细胞沉淀悬浮于500μl 1
×
erb中,0℃,超声1min。然后将细胞悬液在4℃下以11,000g离心5分钟以获得cim-ec。
[0082]
(4)na3c:将5μl cim-ec、10μl 2
×
erb、1.25μl 2μm c
crrnab、1.25μl 100μm ec1、1μl无核酸酶水、1.5μl rnase抑制剂(40u/μl)在室温下孵育30分钟。然后将20μl上述反应混合物与5μl 10
×
ccb、1.25μl rnase抑制剂(40u/μl)、1μl 10μm cas12a和1μl 10μm dsdna
ii
混合。在37℃下反应30分钟后,加入18μl无核酸酶水和3.75μl 10μm fq-ssdna(总体积:50μl)。将反应混合物在荧光分光光度计中在37℃下孵育30分钟。
[0083]
通过上述实验步骤,本发明测试了20个培养阳性和20个培养阴性的尿液样本(图7),基于常用的临床阈值(1,000cfu/ml),na3c的检测结果为22个阳性样本,18个阴性样本(图8b)。相对于标准培养方法的阳性预测一致性(ppa)和阴性预测一致性(npa)分别为100%和90%。受试者工作特征曲线下面积(auc)为0.978,表明na3c具有用于临床诊断的潜力。
[0084]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1