一株链霉菌及其在制备抗菌药物中的应用
1.本发明属于链霉菌发酵技术领域。
背景技术:
2.微生物是药物产生的重要来源,自从青霉素被发现以来,人类从微生物的次生代谢产物中获得了许多重要的天然产物,如红霉素、链霉素、利福霉素等等,为人类的健康事业做出了很大的贡献。
3.目前市场上的药物中,超过120种重要药物来自于微生物,包括青霉素、环孢菌素a、阿霉素等,尤其是在抗感染和抗肿瘤药物中,微生物药物的比重超过50%。
4.海洋是一个高盐、寡营养,甚至低温、高压、无光照的环境,这种生态环境的特殊性使得海洋微生物产生的次生代谢产物的生物合成途径和酶反应系统与陆地微生物相比有着巨大的差异,赋予了海洋微生物独特的代谢途径,导致一些新颖的专属于海洋的菌种以及化学结构奇特、新颖、生物活性多样性显著的海洋药物先导化合物的产生,为新药研究与开发提供了大量的菌种资源、模式结构和药物前体。因此,为了开辟新的药源,世界各国都在向“深蓝进军”,转向从海洋微生物中探索新的药物资源。
技术实现要素:
5.本发明的目的是提供一株链霉菌(streptomyces sp.)btbu20218885,其保藏编号为 cgmcc no.23712。该菌株已于2021年11月5日保藏于中国微生物菌种保藏管理委员会普通微生物中心,该中心简称cgmcc,该中心地址为北京市朝阳区北辰西路1号院3号,该菌株保藏号为cgmcc no.23712。
6.本发明还提供了一种化合物,具有如下结构式:
7.所述化合物由链霉菌(streptomyces sp.)btbu20218885发酵制备。
8.本发明同时提供了所述化合物在制备抗菌药物中的应用。
9.在本发明的具体实施方式中,所述抗菌药物为抗金黄色葡萄球菌药物。
10.在本发明的具体实施方式中,所述抗菌药物为抗大肠杆菌药物。
11.在本发明的具体实施方式中,所述抗菌药物为抗分枝杆菌药物。
12.所述药物还可包括药学上允许的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂、增效剂、添加剂和溶剂等。制备所述抗菌药物时,可将有效剂量的所述化合物与药学上允许的稀释剂、赋形剂、填充剂、粘合剂、湿润
剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂、增效剂、添加剂和溶剂等混合,制成各种药用制剂。所述药物的形态可为片剂、胶囊、软胶囊、散剂、颗粒剂、细粒剂、液剂、丸剂、乳剂或悬浊剂等口服制剂,亦可为针剂(如粉剂、水剂、油剂)栓剂、软膏、硬膏、贴剂、喷雾剂、酊剂或滴眼剂等非口服制剂。这些制剂都可采用本领域技术人员熟知常用的制备方法而获得。其给药途径可为口服、经皮,静脉或肌肉注射。
附图说明
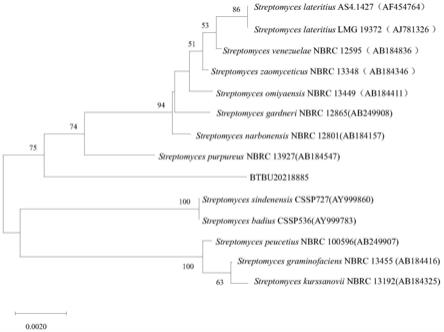
13.图1为系统发育树图。
14.图2为化合物的质谱图,
15.图3为化合物溶于dmso-d6中的1h-nmr谱图,
16.图4为化合物溶于dmso-d6中的
13
c-nmr谱图。
具体实施方式
17.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
18.金黄色葡萄球菌(staphylococcus aureus atcc 25923),结核分枝杆菌(mycobacterium tuberculosis atcc编号为27294),大肠杆菌(escherchia coli atcc 25923)
19.实施例1
20.菌株btbu20218885的分离与鉴定
21.一、菌株btbu20218885的分离
22.取1g海泥样品(2018年10月采集自中国福建厦门沿海海泥),放入装有9ml无菌水的 50ml离心管中,以20khz、100w功率超声2min,200rpm振摇2小时;取1ml悬浊液,放入装有9ml无菌水的50ml离心管中,充分震荡混匀;取1ml悬浊液,放入装有9ml无菌水的50ml离心管中,充分震荡混匀;取1ml悬浊液,放入装有9ml无菌水的50ml离心管中,充分震荡混匀,置于60℃下1小时,取0.2ml涂布于菌株分离培养基上,获得一株菌,将其命名为菌株btbu20218885。
23.菌株分离培养基的成分如下(%均为质量百分比):可溶性淀粉2%、l-天冬素0.05%、 kno
3 0.1%、k2hpo4·
h2o 0.05%、nacl 0.05%、mgso4·
7h2o 0.05%、caco
3 0.1%、agar 2%和水,ph7.2-7.5。
24.二、菌株btbu20218885的鉴定
25.菌株btbu20218885在斜面培养基上28℃生长10天,菌株btbu20218885的16s rrna 的编码序列如序列表的序列1所示(seq id no.1),将序列信息提交ncbi数据库进行序列比对。菌株btbu20218885与模式菌株streptomyces purpureus nbrc 13927(t)的16s rrna 的编码序列的相似性为98.68%。利用clsstal w序列分析软件对将获得的16s rrna序列进行多序列比对,利用mega8.0软件中的邻接法生成系统发育树,见图1(步缺值设定为 1000)。
26.根据菌落形态及序列比对的结果,菌株btbu20218885属于链霉菌(streptomyces sp.)。菌株btbu20218885已于2021年11月5日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏号为cgmcc no. 23712。链霉菌(streptomyces sp.)btbu20218885 no.23712简称链霉菌btbu20218885。
27.实施例2
28.应用链霉菌btbu20218885生产制备化合物
29.一、种子液的制备
30.1、将链霉菌btbu20218885划线接种于平皿培养基上,28℃培养7天(使气生菌丝生长丰满),得到平皿菌种。
31.平皿培养基的制备方法:将4克酵母浸提物、10克麦芽浸提物、4克葡萄糖和20克琼脂粉溶于水,调ph至7.0-7.2,用水定容至1l,115℃灭菌30分钟。
32.2、将种子培养基分装于500ml三角烧瓶中(100ml/瓶),将斜面菌种挖块接种至种子培养基,28℃、200rpm振荡培养5天,得到od
600nm
=1.2-1.4的种子液。
33.种子培养基的制备方法:将4克酵母浸提物、10克麦芽浸提物和4克葡萄糖溶于水,调 ph至7.0-7.2,用水定容至1l,115℃灭菌30分钟。
34.二、发酵
35.将5ml步骤一制备得到的种子液加入100ml发酵培养基中,28℃、200rpm振荡培养10天。
36.发酵培养基的制备方法:葡萄糖10g,稷粉(millet meal)20g,药媒20g,mops 20g,蒸馏水1l,调ph至7.0-7.5,用水定容至1l,115℃灭菌30分钟。
37.三、分离纯化化合物
38.1、取步骤二得到的发酵体系,20℃、10000rpm离心10分钟,分别收集上清。
39.2、取步骤1得到的上清,用乙酸乙酯进行萃取,静置待水相与乙酸乙酯相分层后,收集位于上层的乙酸乙酯相;剩余的水相再次用乙酸乙酯进行萃取,静置待水相与乙酸乙酯相分层后,收集位于上层的乙酸乙酯相;剩余的水相再次用乙酸乙酯进行萃取,静置待水相与乙酸乙酯相分层后,收集位于上层的乙酸乙酯相;合并三次萃取得到的乙酸乙酯相,减压蒸馏除去有机溶剂,得到粗品。
40.3、将粗品,用乙酸乙酯溶解,减压蒸馏除去有机溶剂,得到样品。
41.4、将样品用甲醇重新溶解,过滤去除不溶物后进行反向高效液相色谱。
42.反向高效液相色谱的条件:采用agilent eclipse xdb c-18反相色谱柱(9.4
×
250mm);流动相为乙腈或乙腈和水的混合物;洗脱时间为10min,流速为3.0毫升/分钟;洗脱过程中,乙腈在流动相中的体积百分比从20%线性上升至90%;检测波长为254纳米。
43.收集峰值的保留时间为5.13min的峰的洗脱液,减压蒸干后得到化合物。
44.四、化合物的结构表征
45.1、质谱
46.质谱测试采用高分辨电喷雾电离质谱hresims,甲醇为质谱检测时化合物溶剂。
47.化合物的质谱图见图2,显示其[m+h]
+
峰为229.0100m/z。
[0048]
5、核磁共振谱
[0049]
化合物溶于dmso-d6中的1h-nmr谱图见图3,
[0050]
化合物溶于dmso-d6中的
13
c-nmr谱图见图4;
[0051]
表1化合物的归属情况
[0052][0053]
化合物结构式如下:
[0054][0055]
实施例3
[0056]
检测化合物抗细菌的活性
[0057]
mhb培养基:称取24克mueller-hinton broth干粉,溶解于1000毫升蒸馏水,调ph至7.2, 121℃灭菌20分钟。mueller-hinton broth:北京奥博星生物技术有限责任公司。
[0058]
万古霉素:美国amresco公司。
[0059]
四环素:购自美国amresco公司。
[0060]
环丙沙星:购自美国amresco公司。
[0061]
氯霉素:购自美国amresco公司。
[0062]
一、制备菌液
[0063]
通过血球计数板计数,用mhb培养基将细菌制备成(2-5)
×
105个细胞/ml的菌液。
[0064]
分别采用以下几种细菌:金黄色葡萄球菌和大肠杆菌。
[0065]
二、制备待测溶液
[0066]
以无菌dmso为溶剂将化合物配制为4mg/ml的母液,然后用无菌dmso依次稀释得到浓度为 2mg/ml、1mg/ml、500μg/ml、250μg/ml、125μg/ml、62.5μg/ml、31.25μg/ml的稀释液。
[0067]
以无菌dmso为溶剂将阳性对照药物配制为320μg/ml的母液,然后用无菌dmso依次稀释得到浓度为160μg/ml、80μg/ml、40μg/ml、20μg/ml、10μg/ml、5μg/ml和2.5μg/ml的稀释液。
[0068]
分别采用以下阳性对照药物:万古霉素(在对金黄色葡萄球菌进行检测时作为阳性对照药物)、环丙沙星(在对大肠杆菌进行检测时作为阳性对照药物)。
[0069]
三、测定化合物抑制细菌的最小抑菌浓度
[0070]
1、取无菌96孔细胞培养板,每孔加入40μl mhb培养基。
[0071]
2、取完成步骤1的96孔细胞培养板,分组处理如下:
[0072]
阳性对照组(每种阳性对照药物7个孔):分别加入2μl步骤二制备的7个稀释度的阳性对照药物稀释液;
[0073]
实验组(每种化合物7个孔):分别加入2μl步骤二制备的化合物稀释液;
[0074]
阴性对照组(7个孔):分别加入2μl无菌dmso。
[0075]
3、取完成步骤2的96孔细胞培养板,每孔加入40μl步骤一得到的菌液,37℃培养16小时后观察各孔中细菌的生长状况:如该孔中呈混浊状态,说明相应浓度的化合物无抗细菌活性;如该孔中呈澄清状态,说明相应浓度的化合物具有抗细菌活性。对于每个化合物,细菌生长被完全抑制的孔所对应的化合物终浓度(所加入的稀释液中的化合物浓度/40)即为该化合物对细菌的最低抑菌浓度,mic值。
[0076]
化合物抗细菌的活性检测结果见下表3:
[0077]
表3各个化合物的抗细菌活性检测结果(mic值,μg/ml)
[0078][0079]
实施例4
[0080]
检测化合物抗分枝杆菌的活性
[0081]
7h9培养基培养基:取4.7g middlebrook 7h9 broth培养基粉末(美国bd公司)、2ml甘油、0.5ml tween80、900ml水和100ml middlebrook oadc enrichment(美国bd公司),充分混合,经0.22um孔径无菌滤膜过滤灭菌。
[0082]
异烟肼:购自sigma-aldrich公司。
[0083]
利福平:购自sigma-aldrich公司。
[0084]
一、制备菌液
[0085]
将分枝杆菌接种至7h9培养基,37℃、60rpm振荡培养,直至od
600nm
为0.50-0.55。采用如结核分枝杆菌。
[0086]
二、制备待测溶液
[0087]
以无菌dmso为溶剂将化合物配制为4mg/ml的母液,然后用无菌dmso依次稀释得到浓度为 2mg/ml、1mg/ml、500μg/ml、250μg/ml、125μg/ml、62.5μg/ml、31.25μg/ml的稀释液。分别采用以下化合物:化合物a、化合物b、化合物c、化合物d、化合物e、化合物f、化合物g 和化合物j。
[0088]
以无菌dmso为溶剂将阳性对照药物配制为320μg/ml的母液,然后用无菌dmso依次稀释得到浓度为160μg/ml、80μg/ml、40μg/ml、20μg/ml、10μg/ml、5μg/ml和2.5μg/ml的稀释液。分别采用以下阳性对照药物:异烟肼(在对牛分枝杆菌和耻垢分枝杆菌进行检测时作为阳性对照药物)、利福平(在对结核分枝杆菌进行检测时作为阳性对照药物)。
[0089]
三、测定化合物抑制分枝杆菌的最小抑菌浓度
[0090]
1、取96孔细胞培养板,每孔加入40μl 7h9培养基。
[0091]
2、取完成步骤1的96孔细胞培养板,分组处理如下:
[0092]
阳性对照组(每种阳性对照药物7个孔):分别加入2μl步骤二制备的7个稀释度的阳性对照药物稀释液;
[0093]
实验组(每种化合物7个孔):分别加入2μl步骤二制备的化合物稀释液;
[0094]
阴性对照组(7个孔):分别加入2μl无菌dmso。
[0095]
3、取完成步骤2的96孔细胞培养板,每孔加入40μl步骤一得到的菌液,37℃培养96小时后观察各孔中分枝杆菌的生长状况:如该孔中呈混浊状态,说明相应浓度的化合物无抗分枝杆菌活性;如该孔中呈澄清状态,说明相应浓度的化合物具有抗分枝杆菌活性。对于每个化合物,分枝杆菌生长被完全抑制的孔所对应的化合物终浓度(所加入的稀释液中的化合物溶液浓度/40)即为该化合物对分枝杆菌的最低抑菌浓度,mic值。
[0096]
化合物抗分枝杆菌的活性为0.625μg/ml。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1