胃癌原代细胞的培养基和培养方法与流程
本发明属于生物,具体涉及一种用于胃癌原代细胞的培养基、和使用该培养基培养胃癌原代细胞的方法。
背景技术:
1、胃癌(gastric carcinoma)是起源于胃黏膜上皮的恶性肿瘤,在我国各种恶性肿瘤中发病率居首位。胃癌发病有明显的地域性差别,在我国的西北与东部沿海地区胃癌发病率比南方地区明显为高。好发年龄在50岁以上,男女发病率之比为2:1。由于饮食结构的改变、工作压力增大以及幽门螺杆菌的感染等原因,使得胃癌呈现年轻化倾向。胃癌可发生于胃的任何部位,其中半数以上发生于胃窦部,胃大弯、胃小弯及前后壁均可受累。绝大多数胃癌属于腺癌,早期无明显症状,或出现上腹不适、嗳气等非特异性症状,常与胃炎、胃溃疡等胃慢性疾病症状相似,易被忽略。因此,目前我国胃癌的早期诊断率仍较低。目前全国早期胃癌的诊断率仍然低于20%,胃癌患者5年生存率仅为27.4%。
2、近几年,在分子生物学的兴起与发展下,肿瘤药物治疗呈现多样化趋势,其中分子靶向药物因其针对性强、安全性高等优势成为胃癌临床治疗中研究的热点。但是临床上针对众多治疗方案,怎么选择适合病人的方案就尤为重要。尽管有基因检测作为指标,但是有些病人没有基因突变,或者有些病人即使有某种突变,但是针对该突变有多种靶向药物,这时确定治疗方案在临床上有一定的难度。除了基因测序,体外对胃癌病人样本进行原代细胞培养已经成为未来体外预测疗效和指导临床用药的重要手段,但是体外快速获得胃癌原代细胞一直是亟待解决的技术问题。
3、目前主要有两种培养原代细胞的技术发展得相对成熟。一种是使用经辐射的饲养细胞和rock激酶抑制剂y27632来促进原代上皮细胞的生长,即细胞条件重编程技术(liu等,am j pathol,180:599-607,2012)。另一种技术是体外3d培养成体干细胞从而获得类似于组织器官的类器官技术(hans clevers等,cell,11,172(1-2):373-386,2018)。
4、然而,这两种技术都存在一定的局限性。细胞重编程技术是一种将患者自体原代上皮细胞与鼠源性饲养细胞共培养的技术。在对患者原代细胞进行药物敏感性测试时,这些鼠源性细胞的存在会干扰患者自体原代细胞的药物敏感性检测结果;但如果撤除鼠源性饲养细胞,病人自体原代细胞就脱离了重编程环境,细胞的增殖速率和细胞内信号通路会发生明显的改变(liu等,am j pathol,183(6):1862-1870,2013;liu等,cell death dis.,9(7):750,2018),从而使患者自体原代细胞对药物的响应结果受到较大影响。类器官技术是将患者自体原代上皮细胞包埋在细胞外基质内进行体外三维立体培养的技术,该技术无需饲养细胞,因此不存在鼠源性饲养细胞的干扰问题。但是类器官技术的培养基内需添加多种特定的生长因子(如wnt蛋白和r-spondin家族蛋白),成本昂贵,不适于普及到临床进行大规模应用。另外,类器官在整个培养过程中均需将细胞包埋在细胞外基质胶中,其细胞接种、传代和药物敏感性测试的铺板步骤相较于2d培养操作繁琐费时,且该技术所形成的类器官大小尺寸不好控制,易出现部分类器官生长过大而导致内部发生坏死的情况。因此,类器官技术相较于2d培养技术可操作性和适用性不强,需要专业技术人员操作,不适合大规模广泛应用于临床体外药物敏感性检测(nick barker,nat cell biol,18(3):246-54,2016)。
5、鉴于以上技术的局限性,临床上需要开发一种原代胃癌细胞培养技术,其培养周期短,成本可控,操作便捷,不受外源性细胞干扰。在将该技术应用于构建原代胃癌肿瘤细胞模型时,所培养的胃癌肿瘤细胞能代表胃癌患者自身的生物学特性。通过体外评估抗肿瘤药物在不同癌症患者个体所衍生的细胞模型上的敏感性,来提高临床上抗肿瘤药物的响应率,减少不合适的药物给患者造成的痛苦及医疗资源的浪费。
技术实现思路
1、为了解决上述技术问题,本发明提供了一种用于在体外快速扩增胃癌原代细胞的培养基和培养方法及其应用。
2、本发明的一个方面在于提供一种胃癌原代细胞的培养基,所述培养基包含mst1/2激酶抑制剂;选自y27632、法舒地尔、和h-1152中的至少一种的rock激酶抑制剂;b27添加剂和n2添加剂中的至少一种添加剂;碱性成纤维细胞生长因子;chir99021;表皮细胞生长因子;its细胞培养添加剂;sb202190;地塞米松;成纤维细胞生长因子10;n-乙酰-l-半胱氨酸;和胃泌素。其中,所述mst1/2激酶抑制剂包括式(i)的化合物或其药学可接受的盐、或溶剂化物,
3、
4、其中,
5、r1选自c1-c6烷基、c3-c6环烷基、c4-c8环烷基烷基、c2-c6螺环烷基、以及任选地被1-2个独立地r6取代的芳基(例如苯基和萘基等)、芳基c1-c6烷基(例如苯甲基等)和杂芳基(例如噻吩基等);
6、r2和r3各自独立地选自c1-c6烷基,优选c1-c3烷基,更优选甲基;
7、r4和r5各自独立地选自氢、c1-c6烷基、c3-c6环烷基、c4-c8环烷基烷基、c1-c6烷基羟基、c1-c6卤代烷基、c1-c6烷基氨基c1-c6烷基、c1-c6烷氧基c1-c6烷基、和c3-c6杂环基c1-c6烷基(所述杂环基选自例如哌啶基、四氢吡喃基等);
8、r6选自卤素(优选氟和氯,更优选氟)、c1-c6烷基(优选甲基)、c1-c6烷氧基(优选甲氧基)、和c1-c6卤代烷基(优选三氟甲基)。
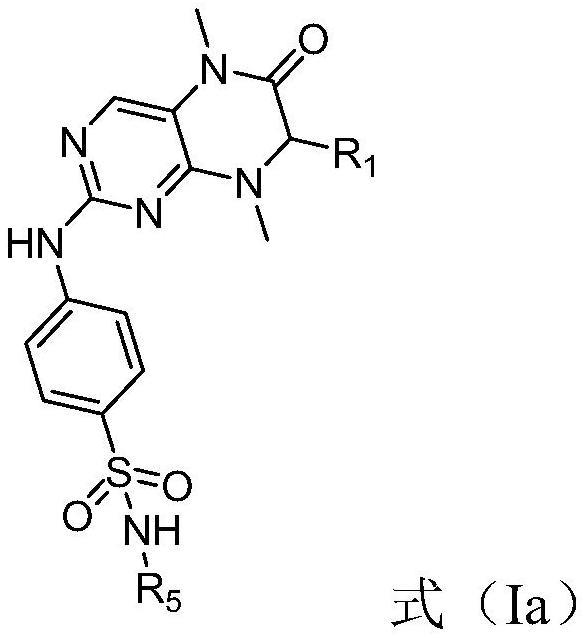
9、优选的实施方式中,mst1/2激酶抑制剂包括式(ia)的化合物或其药学可接受的盐、或溶剂化物,
10、
11、其中,
12、r1选自c1-c6烷基、任选地被1-2个独立地r6取代的苯基、任选地被1-2个独立地r6取代的噻吩基、和任选地被1-2个独立地r6取代的苯甲基,r1更优选为任选地被1-2个独立地r6取代的苯基;
13、r5选自氢、c1-c6烷基、和c3-c6环烷基,r5更优选为氢;
14、r6各自独立地选自卤素、c1-c6烷基、和c1-c6卤代烷基,r6更优选为氟、甲基或三氟甲基。
15、优选地,所述mst1/2抑制剂是选自以下化合物或其药学可接受的盐、或溶剂化物中的至少一种。
16、
17、
18、
19、
20、
21、最优选地,本发明的mst1/2激酶抑制剂为化合物1。
22、在本发明的实施方式中,本发明的培养基中各成分的含量满足以下任意一项或多项或全部满足:
23、(1)所述mst1/2激酶抑制剂的浓度为2.5~20μm;
24、(2)所述b27或n2细胞培养添加剂相对于培养基的体积比为1:25~1:400;
25、(3)所述碱性成纤维细胞生长因子的浓度为1~30ng/ml;
26、(4)所述its细胞培养添加剂相对于培养基的体积比为1:25~1:400;
27、(5)所述rock激酶抑制剂的浓度为2.5~40μm;
28、(6)所述地塞米松的浓度为25~400nm;
29、(7)所述chir99021的浓度为1.25~10μm;
30、(8)所述表皮细胞生长因子的浓度为2.5~20ng/ml;
31、(9)所述成纤维细胞生长因子10的浓度为50~800ng/ml;
32、(10)所述胃泌素的浓度为1.25~20nm;
33、(11)所述sb202190的浓度为50~800nm;
34、(12)所述n-乙酰-l-半胱氨酸的浓度为0.25~4mm。
35、在本发明的实施方式中,所述培养基还含有选自dmem/f12、dmem、f12或rpmi-1640的初始培养基;和选自链霉素/青霉素、两性霉素b和primocin中的一种或多种的抗生素作为基础培养基。
36、在优选的实施方式中,当抗生素选自链霉素/青霉素时,链霉素浓度范围为25~400μg/ml,青霉素浓度范围为25~400u/ml,当抗生素选自两性霉素b时,浓度范围为0.25~4μg/ml,当抗生素选自primocin时,浓度范围为25~400μg/ml。
37、本发明还提供一种胃癌原代细胞的培养方法。在本发明的胃癌原代细胞的培养方法中,使用本发明的胃癌原代细胞培养基对胃癌原代细胞进行培养。
38、本发明的胃癌原代细胞培养方法包括以下步骤。
39、(1)按上述配方配制本发明的原代细胞培养基。
40、(2)用细胞外基质胶稀释液包被培养器皿。
41、具体地,该细胞外基质胶使用低生长因子型细胞外基质胶,例如,可采用市售的matrigel(购自康宁公司)或bme(购自trevigen公司)。更具体而言,用无血清的培养基稀释细胞外基质胶,培养基可以是dmem/f12(购自康宁公司)。细胞外基质胶的稀释比例为1:50-1:400,优选为1:100-1:200。包被方法为将稀释后的细胞外基质胶加入培养器皿内,使其完全覆盖培养器皿底部,静置包被30分钟以上,优选在37℃条件下静置包被,优选包被时间为30~60分钟。包被结束后吸弃多余的细胞外基质胶稀释液,培养器皿备用。
42、(3)从胃癌实体瘤组织分离样本,获得胃癌原代细胞。
43、原代胃癌细胞例如可以来源于胃癌手术样本和活检内镜样本。胃癌手术样本例如来源于进行过说明并获得同意的胃癌肿瘤患者手术切除癌组织样本,内镜样本经由内镜引导采集自胃内病灶。在患者手术切除或活检后的半小时内进行上述组织样本的收集。以手术样本为例,在无菌环境下,切取非坏死部位的组织样本,其体积在5mm3以上,将其置于预冷的10-15ml dmem/f12培养基或商品化保存液中,盛在塑料无菌带盖离心管内,冰上运输至实验室。
44、在生物安全柜内,将组织样本转移至细胞培养皿内,用如上文所述的基础培养基润洗组织样本,将组织样本表面的血细胞清洗掉。将润洗后的组织样本转移至另一个新的培养皿内,加入1-3ml基础培养基,用无菌手术刀片和手术镊将组织样本分割为体积小于3mm3的组织碎块。
45、将组织样本碎块转移至离心管内,用台式离心机(sigma公司3-18k)以1000~3000rpm离心3~5分钟;弃上清,按1:3比例加入基础培养基和组织消化液(其中组织消化液的配制方法为:将1~2mg/ml胶原酶ⅱ、1~2mg/ml胶原酶ⅳ、50~100u/ml脱氧核糖核酸、0.5~1mg/ml透明质酸酶、1~5mm氯化钙、5~10mg/ml牛血清白蛋白溶于1640培养基中),标记样本编号,封口膜密封,以37℃、200~300rpm恒温摇床(知楚仪器zqly-180n)消化,每间隔半小时或1小时观察消化是否完成;若未见明显组织块即可终止消化,否则继续消化,直至消化充分,消化时间范围为4~8小时。消化完成后,细胞滤网(细胞筛孔径为例如70-100μm)过滤掉未消化的组织团块,滤网上的组织团块用基础培养基冲洗,将残留细胞冲入离心管中,用台式离心机以1000~3000rpm离心3~5分钟。弃上清,观察剩余细胞团是否含有血细胞,若有血细胞,加3~8ml血细胞裂解液(购自sigma公司),混匀,4℃裂解10~20分钟,5分钟摇晃混匀一次,裂解结束后取出,以1000~3000rpm离心3~5分钟。
46、(4)在包被好的培养器皿内接种步骤(3)中分离得到的原代胃癌细胞,并采用步骤(1)中的原代细胞培养基进行培养。
47、更具体而言,在多孔板的一个孔中按1×104~8×104个/cm2(例如4×104个/cm2)的密度接种原代胃癌肿瘤细胞,加入适量如2-3ml原代胃癌细胞培养基,在例如37℃、5%co2的条件下于细胞培养箱中培养8-16天,期间每4天换成新鲜的原代细胞培养基,在原代胃癌细胞长至占多孔板底面积80%~90%左右的细胞密度时进行消化传代。
48、该接种步骤无需使用饲养细胞,相比细胞条件重编程技术,免去了培养和辐照饲养细胞的操作步骤。该步骤相比类器官技术,也无需在冰上将原代细胞和基质胶混匀后形成胶滴,并等待胶滴凝固后加入培养基,预先包被好的培养器皿可直接用于原代细胞接种。此外,包被培养器皿仅需少量稀释后的细胞外基质胶,相比类器官技术,节约了价格昂贵的细胞外基质胶的使用量,也简化了操作步骤。
49、任选地,接种后的原代胃癌细胞在培养8~16天后,当培养容器内形成的细胞克隆汇合达到底面积80%,弃去上清,加入0.5~2ml0.05%胰酶(购自thermo fisher公司)进行细胞消化,室温下孵育5~20分钟;然后用含有例如5%(v/v)胎牛血清、100u/ml青霉素和100μg/ml链霉素的dmem/f12培养液1~4ml重悬消化处理后的细胞,以1000~3000rpm离心3~5分钟;使用本发明的原代细胞培养基将消化后的单细胞重悬,将所得到的细胞悬液置入包被有细胞外基质胶的t25细胞培养瓶中继续扩大培养。t25细胞培养瓶的包被操作同步骤(2)。
50、扩增的胃癌原代细胞呈2d生长,避免了类器官技术扩增出现的类器官大小不均一和生长过大的类器官出现内部坏死等情况。
51、本发明还提供一种用于评估或筛选治疗胃癌疾病的药物的方法,其包括以下步骤:
52、(1)使用本发明的胃癌原代细胞的培养方法培养胃癌原代细胞;
53、(2)选定需要检测的药物并按照所需浓度梯度进行稀释;
54、(3)对(1)中培养得到的细胞添加稀释后的所述药物;
55、(4)进行细胞活性测试。
56、本发明的有益效果包括:
57、(1)提高胃癌原代细胞培养的成功率,成功率达到90%以上;
58、(2)保证体外原代培养的胃癌原代细胞能够保持病人的病理特性;
59、(3)所培养的原代胃癌上皮细胞不受成纤维细胞干扰,能得到纯化的胃癌上皮细胞;
60、(4)培养基成分不含血清,所以不受不同批次血清质量和数量的影响;
61、(5)扩增效率高,能快速培养出胃癌原代细胞,扩增出的胃癌原代细胞还可以连续传代;
62、(6)传代步骤无需冰上操作和解离基质胶,10-15分钟内即可完成细胞的消化传代;
63、(7)培养成本可控,培养基无需加入价格昂贵的wnt激动剂、r-spondin家族蛋白、noggin蛋白、bmp抑制剂等因子;
64、(8)所述技术培养获得的胃癌原代细胞数量大,适合高通量筛选候选化合物和为病人提供高通量药物体外敏感性功能测试。
- 还没有人留言评论。精彩留言会获得点赞!