一种大豆蛋白含量相关的分子标记及其应用
1.本发明涉及生物技术领域中一种大豆蛋白含量相关的分子标记及其应用。
背景技术:
2.大豆(glycine max l.)富含蛋白质,既可以用于制作蛋白食品同时也可以用于饲料的生产。蛋白含量是大豆重要的品质性状。而大豆蛋白是一种营养健康的植物蛋白,大豆蛋白质含有人体需要的8种氨基酸,食用大豆蛋白便能够满足人体每天对蛋白的需求。大豆蛋白也是一种有利于人体健康的植物蛋白,其蛋白质中不含胆固醇,因此能够有效地预防心血管疾病,而所含有的异黄酮还有助于维护动脉血管弹性,具有非常高的营养价值和保健价值,因此在肉类制品、乳制品以及面类制品甚至医药保健品上均得到广泛的应用。通过提升大豆的蛋白含量含量,培育高产优质的大豆不仅有助于人们生活水平的改善同时也能够促进人的身心健康发展,还可以提高社会的经济效益。
3.大豆蛋白含量往往是由不同基因的连锁群控制着的,既受到遗传的影响同时也受环境的显著影响。研究表明,在中国不同生态区种植的大豆品种其蛋白含量具有明显且广泛的遗传变异。通过深入分析与品质性状相关qtl位点,众多研究也表明,控制品质性状的qtl基本分散在20条染色体上。由于蛋白含量是受环境的调控且受多基因调控性状,具有复杂的遗传基础。因此,通过挖掘控制大豆蛋白相关的qtl,解析影响蛋白含量变化的遗传机制,能够为大豆品质性状分子辅助育种等提供更多理论支持。
4.近几十年来,与大豆蛋白含量相关的qtl定位研究取得了较大的进展。但由于蛋白质含量变化受其复杂的遗传基础和外界环境的相互影响,不同的研究者所得到的研究结果差异很大。许多研究者采用不同的材料和方法对大豆蛋白质含量遗传进行了大量研究,包括传统的数量遗传实验、基于分子标记的qtl分析以及候选基因预测等。其中,在多个环境或不同遗传背景下的群体进行检测发现,6号染色体(c2连锁群)、15号染色体(e连锁群)和20号染色体(i连锁群)上均存在多次能够检测到的qtl区段,结果表明其检测到的qtl区段对蛋白质含量的影响较为稳定,可能受环境影响较小,可以对这3个相关的位点进一步精细定位(魏荷,2015)。bolon等(2010)利用大豆基因芯片对近等基因系材料进行了分析,最后将20号染色体连锁群上的qtl区域界定到8.4mb区间内。
5.因此,探究对大豆品质性状相关遗传位点,提高分子标记辅助育种改良大豆品质的效率,为进一步培育高产高品质的大豆品种提供理论支持。
6.参考文献
7.魏荷,王金社,卢为国.大豆籽粒蛋白质含量分子遗传研究进展[j].中国油料作物学报,2015,37(03):394-400.
技术实现要素:
[0008]
本发明所要解决的技术问题是如何准确鉴定大豆蛋白含量。
[0009]
为了解决上述技术问题,本发明提供引物对在a1-a3中的任一种应用,所述snp为
chr15_4510542_a_g,位于15号染色体上,为seq id no.1的第30位核苷酸,其核苷酸种类为a或g;
[0010]
a1、在鉴定或辅助鉴定大豆蛋白含量中的应用;
[0011]
a2、在制备鉴定或辅助鉴定大豆蛋白含量产品中的应用;
[0012]
a3、在大豆育种中的应用或在制备大豆育种产品中的应用;
[0013]
所述引物对为由p1和p2组成的组合物;所述p1为与seq id no.1所示的双链dna的第1-29位上游特异结合的单链dna;所述p2为与seq id no.1所示的双链dna的第148-168位下游特异结合的单链dna。
[0014]
上述应用中,所述p1为seq id no.2所示的单链dna,所述p2为seq id no.3所示的单链dna。
[0015]
检测大豆基因组中snp的多态性或基因型的物质在a1-a3中的任一种应用,所述snp为seq id no.1第30位核苷酸,其核苷酸种类为a或g;
[0016]
a1、在鉴定或辅助鉴定大豆蛋白含量中的应用;
[0017]
a2、在制备鉴定或辅助鉴定大豆蛋白含量产品中的应用;
[0018]
a3、在大豆育种中的应用或在制备大豆育种产品中的应用。
[0019]
所述大豆为chr15_4510542_a_g为纯合型大豆。
[0020]
上述应用中,所述物质为下述任一种:
[0021]
d1)所述物质含有扩增包括所述snp在内的大豆基因组dna片段的pcr引物;
[0022]
d2)所述物质为含有d1)所述pcr引物的pcr试剂;
[0023]
d3)所述物质为含有d1)所述pcr引物或d2)所述pcr试剂的试剂盒;
[0024]
d4)所述物质含有d1)所述pcr引物和限制性内切酶bcli;
[0025]
d5)所述物质为含有d2)所述pcr试剂和限制性内切酶bcli的试剂。
[0026]
上述应用中,所述pcr引物为p1和p2组成的引物对;所述p1为与seq id no.1所示的双链dna的第1-29位上游特异结合的单链dna;所述p2为与seq id no.1所示的双链dna的第148-168位下游特异结合的单链dna。
[0027]
上述应用中,所述p1为seq id no.2所示的单链dna,所述p2为seq id no.3所示的单链dna。
[0028]
本发明还提供产品,所述产品含有所述检测大豆基因组中所述snp的多态性或基因型的物质,所述产品为c1)-c3)中任一种产品:
[0029]
c1)检测与大豆蛋白含量相关的单核苷酸多态性或基因型的产品;
[0030]
c2)鉴定或辅助鉴定大豆蛋白含量的产品;
[0031]
c3)用于大豆育种的产品。
[0032]
本发明还提供检测大豆基因组中所述snp的基因型的方法。
[0033]
本发明所提供的检测大豆基因组中所述snp的基因型的方法为如下ⅰ或ⅱ:
[0034]ⅰ、包括如下k1)和k2):
[0035]
k1)以待测大豆的基因组dna为模板,采用上述引物对进行pcr扩增得到pcr产物;
[0036]
k2)检测步骤k1)得到的pcr产物,根据所述pcr产物确定待测大豆所述snp的基因型:
[0037]
所述pcr产物对应seq id no.1第30位的核苷酸只为g的所述待测大豆的基因型为
gg;所述pcr产物对应seq id no.1第30位的核苷酸只为a的所述待测大豆的基因型为aa;
[0038]ⅱ、包括如下l1)和l2):
[0039]
l1)以待测大豆基因组dna为模板,采用p1和p2组成的引物对进行pcr扩增得到pcr产物;
[0040]
l2)下述l21)或l22):
[0041]
l21)以bcli酶切步骤l1)所得的pcr产物,检测酶切产物的大小,根据所述酶切产物的大小确定待测大豆所述snp的基因型:
[0042]
所述酶切产物只为168bp的dna片段的所述待测大豆的基因型为gg;所述酶切产物只为143bp的dna片段和25bp的dna片段的所述待测大豆的基因型为aa;
[0043]
l22)检测步骤l1)得到的pcr产物的序列,根据所述序列确定待测大豆所述snp的基因型:
[0044]
所述pcr产物对应seq id no.1第30位的核苷酸为g的所述待测大豆的基因型为gg;所述pcr产物对应seq id no.1第30位的核苷酸为a的所述待测大豆的基因型为aa。
[0045]
本发明还提供鉴定或辅助鉴定大豆蛋白含量的方法,包括以上述检测大豆基因组中所述的snp的多态性的方法检测待测大豆多态性,根据待测大豆的多态性鉴定或辅助鉴定大豆的蛋白含量;多态性为gg的待测大豆蛋白含量高于或候选高于多态性为aa的待测大豆蛋白含量。
[0046]
本发明所要解决的另一个技术问题是如何进行大豆育种。
[0047]
为了解决上述技术问题,本发明提供了大豆育种的方法,包括以上述检测大豆基因组中所述的snp的多态性的方法检测待测大豆多态性,选择多态性为gg的大豆作为亲本进行育种。
[0048]
本发明还提供所述引物对的下述a1-a3的任一种应用:
[0049]
a1、在鉴定或辅助鉴定大豆蛋白含量中的应用;
[0050]
a2、在制备鉴定或辅助鉴定大豆蛋白含量产品中的应用;
[0051]
a3、在大豆育种中的应用或在制备大豆育种产品中的应用。
[0052]
上述应用,所述大豆育种为培育高蛋白大豆。
[0053]
上文中,所述大豆为纯系。所述待测大豆可为hj117(母本)
×
hobbit(父本)的重组自交系(recombinant inbred lines,ril)。所述待测大豆可为hj117(母本)
×
中黄13(母本)的重组自交系(recombinant inbred lines,ril)。所述待测大豆可为hj117(母本)
×
齐黄34(父本)的重组自交系(recombinant inbred lines,ril)。
[0054]
本发明的一个实施例中,使用引物扩增包括snp位点chr15_4510542_a_g在内的大豆基因组dna,以bcli对反应产物进行酶切,酶切产物进行凝胶电泳确定了该snp位点的核苷酸类型。实验证明,无论是针对hj117
×
hobbit的ril群体、hj17
×
中黄13的ril群体、hj117
×
齐黄34的ril群体,还是针对hj117
×
徐豆16的ril群体,使用本发明的引物对snp位点chr15_4510542_a_g位点分型,和蛋白含量对应的可解释的遗传变异率在11.20%-39.00%,说明chr15_4510542_a_g是与大豆蛋白含量相关的snp分子标记,可用于鉴定或辅助鉴定大豆蛋白含量,可用于大豆蛋白含量品种的筛选,可用于大豆分子标记辅助育种,可用于高蛋白大豆的选育和培育。
附图说明
[0055]
图1为本发明实施例1中hj117为母本的后代群体蛋白性状的gwas分析结果图。
[0056]
图2为本发明实施例2中hj117
×
hobbit的ril群体蛋白正态分布及标记选择效率图。
[0057]
图3为本发明实施例2中hj117
×
齐黄34的ril群体蛋白正态分布及标记选择效率图。
[0058]
图4为本发明实施例2中hj117
×
中黄13的ril群体蛋白正态分布及标记选择效率图。
[0059]
图5为本发明实施例2中hj117
×
徐豆16的ril群体蛋白正态分布及标记选择效率图。
具体实施方式
[0060]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0061]
下述实施例中的实验方法,如无特殊说明,均为常规方法。
[0062]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0063]
下述实施例中使用的大豆品种hj117记载于非专利文献“郭静文,史晓蕾,刘茜,赵青松,邸锐,刘兵强,闫龙,王凤敏,张孟臣,赵宝华,杨春燕.基于转录组测序技术挖掘大豆蛋白质合成相关基因.2019年01期”,大豆品种hobbit记载于非专利文献“李灿东,郭泰,王志新,郑伟,张振宇,郭美玲,刘忠堂.美国矮秆大豆hobbit资源利用及合98—1667的选育.2014年第7期”,大豆品种中黄13(国审豆2001008)、齐黄34(国审豆2013009)、徐豆16(国审豆2009020)为已审定品种,公众可以从河北省农林科学院粮油作物研究所(即申请人处)获得,以重复本技术实验。
[0064]
采用spss11.5统计软件对数据进行处理,实验结果以平均值
±
标准偏差表示,采用one-way anova检验,p<0.05表示与对照相比具有显著性差异。
[0065]
实施例1、分子标记的获得与相关检测体系的构建
[0066]
一、分子标记的获得
[0067]
利用大豆品种hj117为母本,与5~10品种进行杂交形成1000个左右后代的ril群体材料,通过简化基因组测序的方法(slaf)获得不同家系的多态性。进一步通过gwas的方法对这1000个家系的蛋白含量进行gwas定位分析,结果见图,共定位到两个显著的位点,其中在15号染色体上p值最小的位点是chr15_4510542,为1.46e-13,变异类型为a/g变异,其中g为增效基因型,在此将该功能位点命名为chr15_4510542_a_g。
[0068]
chr15_4510542_a_g是大豆基因组内的一个二等位多态性的snp位点,位于15号染色体上,具体为seq id no.1的第30位,核苷酸种类为g或a(以字母r表示)。
[0069]
二、分子标记相关引物的设计
[0070]
根据snp位点的位置,在基因组上将上下游各30bp的序列提取出来,根据序列使用“dcaps finder”程序(http://helix.wustl.edu/dcaps/dcaps.html)设计dcaps引物(neff et al.,2002),在snp位置附近引入单核苷酸错配,使得限制内切酶在扩增的pcr产物中对
以其中一亲本为模板扩增的序列之一产生识别位点(li et al.,2012)。
[0071]
针对snp位点chr15_4510542_a_g,具体使用的引物为f和r,序列如下:
[0072]
f(前引物):5
’‑
tcattctctttgatatcaaatgcttgatc-3’(如seq id no.2所示);
[0073]
r(后引物):5
’‑
agaacaagaaataagggagc-3’(如seq id no.3所示)。
[0074]
使用的内切酶是bcli,bcli的识别位点为tgatca。当chr15_4510542_a_g的核苷酸种类为aa时,seq id no.1的第24-30位为tgatca,可被bcli识别并酶切;当chr15_4510542_a_g的核苷酸种类为gg时,seq id no.1的第24-30位为tgatcg不能被bcli识别。
[0075]
三、分子标记检测体系的构建
[0076]
构建分子标记检测体系如下:
[0077]
提取待测大豆的基因组dna,以f和r组成的引物对进行pcr扩增,pcr的反应体系和程序如表1所示:
[0078]
表1 pcr反应体系
[0079]
成分用量10
×
ex tag hs buffer2.5μl0.2mm dntp2.0μltemplate1.0μlprimer-f(10μm)0.5μlprimer-r(10μm)0.5μlex taq hs0.2μlddh2o18.3μltotal25μl
[0080]
pcr反应程序:95℃2min,95℃30s,53℃30s,72℃30s,72℃10min,16℃延长,共30cycles。
[0081]
扩增的pcr产物通过琼脂糖凝胶电泳进行检测,有单一性条带的产物以bcli酶切检测。使用的内切酶体系见表2:
[0082]
表2酶切体系
[0083]
成分用量10
×
neb buffer2.5μl限制性内切酶1.0μlpcr产物10μlddh2o11.5μltotal25μl
[0084]
在酶的工作温度下酶切30min,然后在3%琼脂糖凝胶电泳中检测消化产物,并在凝胶成像系统中观察结果:消化产物中条带大小比消化前小为143bp,表明待测大豆的snp位点chr15_4510542_a_g的基因型为aa,即待测大豆为aa型家系;消化产物中条带大小与消化前一致,仍为168bp,表明待测大豆的snp位点chr15_4510542_a_g的基因型为gg,即待测大豆为gg型家系。
[0085]
实施例2、分子标记相关片段或引物在鉴定待测大豆蛋白质含量中的应用
[0086]
为了进一步证实标记chr15_4510542后代选择高蛋白材料中的效应。随机选用4个
ril(recombinant inbred lines)群体,分别为hj117
×
hobbit的ril群体、hj17
×
中黄13的ril群体、hj117
×
齐黄34的ril群体和hj117
×
徐豆16的ril群体进行蛋白含量增效验证,具体如下:
[0087]
一、鉴定hj117
×
hobbit的ril群体的蛋白含量增效情况
[0088]
实验材料为以hj117为母本,以hobbit为父本杂交,之后选f2群体的个体多代自交产生hj117
×
hobbit的ril群体,群体中每个株系都是相对纯合的。在hj117
×
hobbit的ril群体中选140个随机家系进行如下实验:
[0089]
1、测定待测大豆的蛋白含量
[0090]
测定140个随机家系的蛋白含量采用近红外分析仪进行测定,结果见表3的第2列。
[0091]
在hj117
×
hobbit的ril群体中,140个随机家系的蛋白百分含量分布符合正态分布(见图2的a图),群体的变异范围在46.16
±
3.21%之间,说明蛋白含量由多基因控制。
[0092]
2、标记chr15_4510542_a_g的测定
[0093]
以实施例1中第三部分构建的分子标记检测体系对hj117
×
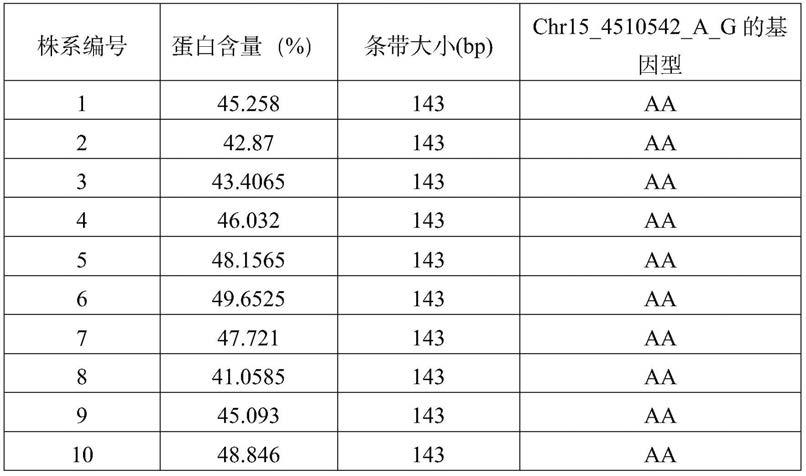
hobbit的ril群体中的上述140个随机家系以及亲本hj117和hobbit进行检测,具体大豆蛋白含量与chr15_4510542_a_g的基因型的对应关系见表3:
[0094]
表3待测大豆分子标记检测结果
[0095]
[0096]
[0097]
[0098]
[0099][0100]
chr15_4510542_a_g标记对这些家系进行分型的结果见图2的b图,显示aa和gg型家系的平均蛋白含量分别为45.19%和47.02%,该标记在群体中可解释的遗传变异率为28.41%,gg型家系的平均蛋白含量显著高于aa型家系的平均蛋白含量(p<0.05)。表明利用该标记在该群体中可以有效提高选择高蛋白家系选出的效率。
[0101]
二、鉴定hj117
×
齐黄34的ril群体的蛋白含量增效情况
[0102]
实验材料为以hj117为母本,以齐黄34为父本杂交,之后选f2群体的个体多代自交产生hj117
×
齐黄34的ril群体,群体中每个株系都是相对纯合的。在hj117
×
齐黄34的ril群体中选155个随机家系进行如下实验:
[0103]
1、测定待测大豆的蛋白含量
[0104]
测定155个随机家系的蛋白含量采用近红外分析仪进行测定,结果见表4的第2列。
[0105]
在hj117
×
齐黄34的ril群体中,155个随机家系的蛋白百分含量分布符合正态分布(见图3的a图),群体的变异范围在46.69
±
2.41%之间,说明蛋白含量由多基因控制。
[0106]
2、标记chr15_4510542_a_g的测定
[0107]
以实施例1中第三部分构建的分子标记检测体系对hj117
×
齐黄34的ril群体中的上述155个随机家系以及亲本hj117和齐黄34进行检测,具体大豆蛋白含量与chr15_4510542_a_g的多态性的对应关系见表4:
[0108]
表4待测大豆分子标记检测结果
[0109]
[0110]
[0111]
[0112]
[0113][0114]
chr15_4510542_a_g标记对这些家系进行分型的结果见图3的b图,显示aa和gg型家系的平均蛋白含量分别为45.80%和47.45%,gg型家系的平均蛋白含量显著高于aa型家系的平均蛋白含量(p<0.05)。该标记在群体中可解释的遗传变异率为34.28%,表明利用该标记在该群体中可以有效提高选择高蛋白家系选出的效率。
[0115]
三、鉴定hj117
×
中黄13的ril群体的蛋白含量增效情况
[0116]
实验材料为以hj117为母本,以中黄13为父本杂交,之后选f2群体的个体多代自交产生hj117
×
中黄13的ril群体,群体中每个株系都是相对纯合的。在hj117
×
中黄13的ril群体中选111个随机家系进行如下实验:
[0117]
1、测定待测大豆的蛋白含量
[0118]
测定111个随机家系的蛋白含量采用近红外分析仪进行测定,结果见表5的第2列。
[0119]
在hj117
×
中黄13的ril群体中,111个随机家系的蛋白百分含量分布符合正态分布(见图4的a图),群体的变异范围在46.66
±
2.80%之间,说明蛋白含量由多基因控制。
[0120]
2、标记chr15_4510542_a_g的测定
[0121]
以实施例1中第三部分构建的分子标记检测体系对hj117
×
中黄13的ril群体中的上述111个随机家系以及亲本hj117和中黄13进行检测,具体大豆蛋白含量与chr15_4510542_a_g的基因型的对应关系见表5:
[0122]
表5待测大豆分子标记检测结果
[0123]
[0124]
[0125]
[0126][0127]
chr15_4510542_a_g标记对这些家系进行分型的结果见图4的b图,显示aa和gg型家系的平均蛋白含量分别为46.69%和47.29%,该标记在群体中可解释的遗传变异率为11.20%,gg型家系的平均蛋白含量显著高于aa型家系的平均蛋白含量(p<0.05)。表明利用该标记在该群体中可以有效提高选择高蛋白家系选出的效率。
[0128]
四、鉴定hj117
×
徐豆16的ril群体的蛋白含量增效情况
[0129]
实验材料为以hj117为母本,以徐豆16为父本杂交,之后选f2群体的个体多代自交产生hj117
×
徐豆16的ril群体,群体中每个株系都是相对纯合的。在hj117
×
徐豆16的ril群体中选163个随机家系进行如下实验:
[0130]
1、测定待测大豆的蛋白含量
[0131]
测定163个随机家系的的蛋白含量采用近红外分析仪进行测定,结果见表6的第2列。
[0132]
在hj117
×
徐豆16的ril群体中,163个随机家系的蛋白百分含量分布符合正态分布(见图5的a图),群体的变异范围在46.35
±
2.82%之间,说明蛋白含量由多基因控制。
[0133]
2、标记chr15_4510542_a_g的测定
[0134]
以实施例1中第三部分构建的分子标记检测体系对hj117
×
徐豆16的ril群体中的上述163个随机家系以及亲本hj117和徐豆16进行检测,具体大豆蛋白含量与chr15_4510542_a_g的基因型的对应关系见表6:
[0135]
表6待测大豆分子标记检测结果
[0136]
[0137]
[0138]
[0139]
[0140]
[0141][0142]
chr15_4510542_a_g标记对这些家系进行分型的结果见图5的b图,显示aa和gg型家系的平均蛋白含量分别为45.15%和47.35%,该标记在群体中可解释的遗传变异率为39.00%,gg型家系的平均蛋白含量显著高于aa型家系的平均蛋白含量(p<0.05)。表明利用该标记在该群体中可以有效提高选择高蛋白家系选出的效率。
[0143]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1