一种季戊四乙二胺的制备方法
1.本发明涉及胺类有机物技术领域,更具体的说是一种季戊四乙二胺的制备方法。
背景技术:
2.季戊四醇中有四个羟基,羟基中的氧原子中有未共用的电子对,氧原子的电负性比氢原子的电负性与碳原子的电负性大,c-o键和o-h键有非常强的极性,因此c-o键和o-h键是进行化学反应的主要部位。季戊四醇衍生物是制备许多功能材料的中间体,如:季戊四溴、季戊四胺、季戊四乙二胺。这些衍生物在生物医药、材料科学、催化剂、主客体化学、人工天线等领域具有广阔的应用前景。
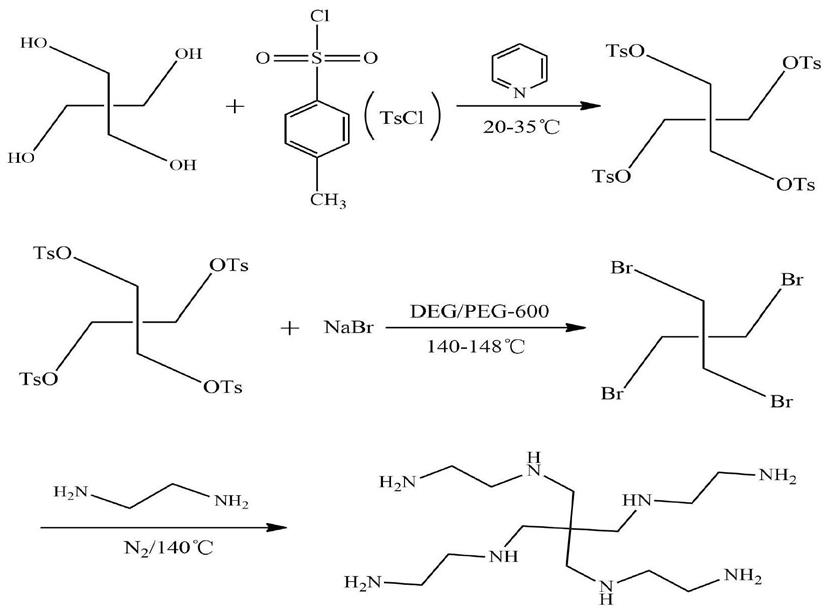
3.分子结构季戊四乙二胺是一种优良的化学中间体,可以用作制药、天然气脱硫、化学阻垢等多个领域。目前合成所述季戊四乙二胺的方法是经过三步反应,第一步是季戊四醇四苯磺酸酯的合成,第二步是四溴代季戊烷的合成,第三步季戊四乙二胺的合成。具体制备工艺路线如下:
[0004][0005]
上述工艺相对繁琐,分离工艺复杂,生产成本高,产率也较低(不到70%),环境污染严重,同时反应中需要使用吡啶作为溶剂与清洗剂,其巨大毒性对生产操作人员与环境有很大的危害,已不能满足当前化工过程高效性、经济性、环保性要求。
[0006]
因此,如何开发出一种高效、廉价、环境友好的季戊四乙二胺的制备工艺成为了本领域技术人员亟需解决的问题。
技术实现要素:
[0007]
有鉴于此,本发明提供了一种季戊四乙二胺的制备方法,使用两步法替代了传统的三步法制备季戊四乙二胺,有效解决了传统的三步法制备季戊四乙二胺所存在的工艺繁琐、分离复杂、成本高、效率低以及需要使用有毒溶剂等技术问题。
[0008]
为了达到上述目的,本发明采用如下技术方案:
[0009]
一种季戊四乙二胺的制备方法,包括以下步骤:
[0010]
(1)将季戊四醇溶液和甲苯磺酰氯溶液混合后进行反应,得到季戊四醇四苯磺酸酯;
[0011]
(2)在保护气体下,将季戊四醇四苯磺酸酯加入到乙二胺中进行反应,即得季戊四乙二胺。
[0012]
所述季戊四醇溶液的浓度为2.0~4.0mmol/ml,甲苯磺酰氯溶液的浓度为2.0~4.0mmol/ml。
[0013]
所述季戊四醇溶液和甲苯磺酰氯溶液的体积比为1:3~5。
[0014]
所述步骤(1)反应的温度为20~35℃,反应时间为30~60h。
[0015]
所述保护气体为氮气、氩气、氦气、氖气和二氧化碳中的一种。
[0016]
所述季戊四醇四苯磺酸酯与乙二胺的质量体积比为(4~6)g:(50~70)ml。
[0017]
所述步骤(2)反应的温度为70~100℃,反应时间为30~50h。
[0018]
经由上述的技术方案可知,与现有技术相比,本发明的有益效果如下:
[0019]
本发明所述技术方案替代了传统的三步法制备季戊四乙二胺,该方法具有反应温度低,反应过程简单、产物产率高、操作与分离简单等优点,并且使用氮甲基吡咯烷酮代替吡啶作为溶剂,增强了生产过程中的环境性与生产人员的健康性,可实现季戊四乙二胺的大批量制备。
附图说明
[0020]
图1为本发明实施例1所制备的季戊四醇四苯磺酸酯的红外光谱图(ftir);
[0021]
图2为本发明实施例1所制备的季戊四醇四苯磺酸酯的核磁共振谱图(1hnmr);
[0022]
图3为本发明实施例1所制备的季戊四乙二胺的红外光谱图(ftir);
[0023]
图4为本发明实施例1所制备的季戊四乙二胺的核磁共振谱图(1hnmr)。
具体实施方式
[0024]
本发明提供了一种季戊四乙二胺的制备方法,包括以下步骤:
[0025]
(1)将季戊四醇溶液和甲苯磺酰氯溶液混合后进行反应,得到季戊四醇四苯磺酸酯;
[0026]
(2)在保护气体下,将季戊四醇四苯磺酸酯加入到乙二胺中进行反应,即得季戊四乙二胺。
[0027]
上述步骤的反应过程如下:
[0028][0029]
作为优选,季戊四醇溶液和甲苯磺酰氯溶液的溶剂均为氮甲基吡咯烷酮。
[0030]
作为优选,所述季戊四醇溶液的浓度为2.5~3.0mmol/ml,甲苯磺酰氯溶液的浓度为3.0~3.5mmol/ml。
[0031]
作为优选,所述季戊四醇溶液和甲苯磺酰氯溶液的体积比为1:4。
[0032]
作为优选,所述步骤(1)反应的温度为25~30℃,反应时间为40~50h。
[0033]
作为优选,季戊四醇溶液和甲苯磺酰氯溶液反应结束后,加入冰水,经过滤、真空干燥即得季戊四醇四苯磺酸酯。
[0034]
作为优选,所述保护气体为氮气或氩气。
[0035]
作为优选,所述季戊四醇四苯磺酸酯与乙二胺的质量体积比为(4~5)g:(50~60)ml。
[0036]
作为优选,所述步骤(2)反应的温度为80~90℃,反应时间为35~40h。
[0037]
作为优选,季戊四醇四苯磺酸酯与乙二胺反应结束后,经减压蒸馏(-0.1mpa)、真空干燥即得季戊四乙二胺。
[0038]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0039]
实施例1
[0040]
季戊四乙二胺的制备方法包括以下步骤:
[0041]
(1)先将季戊四醇(3.94g,0.029mol)溶于10ml氮甲基吡咯烷酮中,接下来,将对甲苯磺酰氯(25g,0.13mol)溶于40ml氮甲基吡咯烷酮中,随后,25℃下,4h内滴加到季戊四醇溶液中,36h结束反应,加入冰水,过滤可以得到白色固体,60℃真空干燥,得白色的季戊四醇四苯磺酸酯;
[0042]
(2)将季戊四醇四苯磺酸酯(5g)加入到乙二胺(60ml)中,氮气氛围下,80℃反应36h,结束反应,减压蒸馏,将多余的乙二胺减压蒸馏除去,60℃真空干燥,得到淡黄色粘稠的季戊四乙二胺。
[0043]
经测定,本实施例步骤(1)得到的季戊四醇四苯磺酸酯转化率可达99.5%;步骤
(2)得到的季戊四乙二胺转化率可达99%。
[0044]
实施例2
[0045]
季戊四乙二胺的制备方法包括以下步骤:
[0046]
(1)先将季戊四醇(3.4g,0.025mol)溶于10ml氮甲基吡咯烷酮中,接下来,将对甲苯磺酰氯(22.88g,0.12mol)溶于40ml氮甲基吡咯烷酮中,随后,28℃下,4h内滴加到季戊四醇溶液中,36h结束反应,加入冰水,过滤可以得到白色固体,60℃真空干燥,得白色的季戊四醇四苯磺酸酯;
[0047]
(2)将季戊四醇四苯磺酸酯(4g)加入到乙二胺(50ml)中,氮气氛围下,85℃反应35h,结束反应,减压蒸馏,将多余的乙二胺减压蒸馏除去,60℃真空干燥,得到淡黄色粘稠的季戊四乙二胺。
[0048]
经测定,本实施例步骤(1)得到的季戊四醇四苯磺酸酯转化率可达99.3%;步骤(2)得到的季戊四乙二胺转化率可达98.88%。
[0049]
实施例3
[0050]
季戊四乙二胺的制备方法包括以下步骤:
[0051]
(1)先将季戊四醇(4.08g,0.03mol)溶于10ml氮甲基吡咯烷酮中,接下来,将对甲苯磺酰氯(26.69g,0.14mol)溶于40ml氮甲基吡咯烷酮中,随后,30℃下,5h内滴加到季戊四醇溶液中,40h结束反应,加入冰水,过滤可以得到白色固体,60℃真空干燥,得白色的季戊四醇四苯磺酸酯;
[0052]
(2)将季戊四醇四苯磺酸酯(4g)加入到乙二胺(55ml)中,氮气氛围下,90℃反应40h,结束反应,减压蒸馏,将多余的乙二胺减压蒸馏除去,60℃真空干燥,得到淡黄色粘稠的季戊四乙二胺。
[0053]
经测定,本实施例步骤(1)得到的季戊四醇四苯磺酸酯转化率可达99.5%;步骤(2)得到的季戊四乙二胺转化率可达99.12%。
[0054]
本发明采用傅立叶变换红外光谱仪(wqf-520,北京瑞利分析器材公司)和核磁共振光谱仪(ascend-400,bruker)对本发明实施例1所制备的季戊四醇四苯磺酸酯和季戊四乙二胺的官能团和结构进行分析。图1为本发明实施例1所制备的季戊四醇四苯磺酸酯的红外光谱图(ftir);图2为本发明实施例1所制备的季戊四醇四苯磺酸酯的核磁共振谱图(1h nmr);图3为本发明实施例1所制备的季戊四乙二胺的红外光谱图(ftir);图4为本发明实施例1所制备的季戊四乙二胺的核磁共振谱图(1h nmr)。
[0055]
由图1可知,3055cm-1
和2958cm-1
处出现的吸收峰为c-h伸缩振动峰;位于1168cm-1
处的吸收峰为s=o对称伸缩振动峰;位于1459cm-1
和1598cm-1
吸收峰为苯环上的c-c的伸缩振动峰。
[0056]
由图2可知,核磁共振谱图能够证明制得的样品是季戊四醇四苯磺酸酯,其中位于7.72ppm、7.48ppm、3.23ppm三个化学位移峰各自为对甲苯磺酰基单元上的三个氢(h-1、h-2、h-3)。而位于2.43ppm的化学位移峰为季戊四醇结构中亚甲基上氢原子(h-4)。1h nmr(400mhz,dmso-d6)δ7.74-7.61(m,8h),7.51-7.42(m,8h),3.21(d,j=4.4hz,1h),2.43(s,12h)。
[0057]
由图3可知,季戊四乙二胺红外谱图中3368cm-1
和1638cm-1
处的吸收峰为-nh2伸缩振动峰和弯曲振动峰,2926cm-1
处的吸收峰为-ch
2-伸缩振动峰,1218cm-1
处的吸收峰为季戊
四醇中叔碳的特征吸收峰,在1116cm-1
处吸收峰为c-n的伸缩振动峰。
[0058]
由图4可知,核磁共振谱图能够证明制得的样品是季戊四乙二胺,其中位于4.71ppm化学位移峰为-nh2上氢原子(h-1),位于2.95ppm和2.99ppm处化学位移峰为-nh-ch
2-ch
2-nh
2-亚甲基上的氢(h-2、h-3),位于2.89ppm处化学位移峰为-ch
2-nh-ch
2-中-nh-上的氢原子(h-5),位于2.31ppm处化学位移峰为c-ch
2-nh-中-ch
2-上的氢原子(h-4)。1h nmr(400mhz,dmso-d6)δ4.71(m,4h),2.99-2.95(m,8h),2.89(m,4h),2.31(m,4h)。
[0059]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0060]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1