治疗α-地中海贫血的药物和诊断试剂盒的制作方法
治疗
α-地中海贫血的药物和诊断试剂盒
技术领域
1.本发明涉及生物技术领域,特别是涉及一种治疗α-地中海贫血的药物和诊断试剂盒。
背景技术:
2.地中海贫血(thalassaemia,简称地贫)是由于α及β珠蛋白肽链合成减少或缺失,从而引起血红蛋白生成障碍,导致无效造血和溶血性贫血。轻者肤色苍白或常伴有疲累感,重者伴有黄疸、脾脏肿大、骨骼疾病、以及儿童成长迟缓等症状。地中海贫血主要包含α-地中海贫血和β-地中海贫血两大类型,是全球最常见的人类单基因遗传血液病之一。
3.目前,α-地中海贫血主要以预防为主。该病分子基础比较复杂,突变类型多,突变热点分散,容易漏诊。
技术实现要素:
4.经发明人研究发现,α-地中海贫血患者中破骨细胞诱导分化通路中tgfbr1基因、ifngr1基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因、p38基因、oscar基因、trem2基因的6ma水平明显上调。
5.基于此,本技术提供了一种ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma在用于制备诊断或治疗α-地中海贫血的产品中的应用,为α-地中海贫血的诊断、治疗提供新的方向。
6.此外,还提供一种治疗α-地中海贫血的药物,包括6ma抑制剂,所述6ma抑制剂能够抑制ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma。
7.在其中一个和实施例中,所述药物还包括药学上可接受的辅料。
8.在其中一个和实施例中,所述药学上可接受的辅料包括溶剂、稳定剂、填充剂、粘合剂、崩解剂、润滑剂、增溶剂、ph调节剂及渗透压调节剂中的一种。
9.在其中一个和实施例中,所述稳定剂选自焦亚硫酸钠、亚硫酸氢钠、维生素c、半胱氨酸、抗坏血酸钠盐、异抗坏血酸钠盐、l-半胱氨酸盐酸盐和依地酸盐至少一种;
10.和/或,所述填充剂选自微晶纤维素、乳糖、淀粉、预交化淀粉、甘露醇和山梨醇中的至少一种;
11.和/或,所述崩解剂选自羧甲基淀粉钠、低取代羟丙基纤维素、交联聚乙烯比咯烷酮、交联羧甲基纤维素纳和干淀粉中的至少一种;
12.和/或,所述粘合剂选自羟丙纤维素、甲基纤维素、乙基纤维素、聚维酮和交联聚维酮中的至少一种;
13.和/或,所述润滑剂选自硬脂酸镁、滑石粉、微粉硅胶和富马酸硬脂酸钠中的至少一种;
14.和/或,所述增溶剂选自乙醇、异丙醇、丙二醇、聚乙二醇、泊洛沙姆、卵磷脂和羟丙
基-β-环糊精中的至少一种;
15.和/或,所述ph调节剂选自柠檬酸盐、磷酸盐、碳酸盐、醋酸盐、盐酸和氢氧化物中的至少一种;
16.和/或,所述渗透压调节剂选自氯化钠、甘露醇、葡萄糖、磷酸盐、柠檬酸盐和醋酸盐中的至少一种。
17.在其中一个和实施例中,所述药物为干粉剂、注射针剂、干混悬剂、胶囊剂或片剂。
18.此外,还提供一种α-地中海贫血的诊断试剂盒,包括用于检测ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma水平的检测试剂。
19.在其中一个和实施例中,所述检测试剂包括6ma抗体和用于扩增ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的引物对。
20.在其中一个和实施例中,所述诊断试剂盒还包括dna提取试剂、pcr扩增试剂、阴性对照品、阳性对照品和缓冲剂中的至少一种。
21.在其中一个和实施例中,所述dna提取试剂包括裂解液和dna纯化剂。
附图说明
22.图1为实施例1中提取的dna样本的琼脂糖凝胶电泳图;
23.图2为实施例1中免疫共沉淀测序的a01ip组、a01input组、ncip组和ncinput组的碱基质量图;
24.图3为实施例1中的peaks显著程度分布图;
25.图4为实施例1中a01和n01两个样品中相关基因文氏图;
26.图5为实施例1中富集热点(peaks)在基因功能元件上分布情况;
27.图6为实施例1中染色体上peaks的分布图;
28.图7为实施例1中α-地贫组和正常组甲基化基因go分析结果;
29.图8为实施例1中α-地贫组差异基因的生物过程富集气泡图;
30.图9~10为实施例1中α-地贫组差异基因的kegg信号通路富集分析结果。
具体实施方式
31.为了便于理解本发明,下面将对本发明进行更全面的描述,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使本发明公开内容更加透彻全面。
32.术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。本文中“α-地贫”为“α-地中海贫血”的简称。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
33.dna甲基化普遍与维持干细胞全能性和其他细胞、器官的发展过程的转录沉默有关联。dna甲基转移酶在造血干细胞的变异及增殖过程中起着至关重要的作用。人类dna甲基化最典型的类型是5-甲基脱氧胞嘧啶(5mc),它调节基因组印迹、x染色体失活和转座子
沉默。dna甲基化的类型除5mc外,还有另外一种类型:n6-甲基腺嘌呤(6ma)。与5mc相比,6ma在哺乳动物表观遗传学领域的重要性认识较少。发明人经研究发现,α-地中海贫血的发生和发展与6ma存在的联系。其中,go和kegg富集结果显示,差异基因主要涉及dna的复制、合成以及rna转录等生物过程,而破骨细胞诱导分化是唯一条具有显著性富集(p《0.05,fold-rich=6)的通路,并且此通路中tgfbr1基因、ifngr1基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因、p38基因、oscar基因、trem2基因的6ma水平明显上调,这为α-地中海贫血的诊断、治疗提供新的方向。此外,上述基因是在全基因组上对α-地中海贫血患者的所有基因进行检测,检测出的异常基因包含已知和未知的与α-地中海贫血贫相关基因靶点。与传统在已知的α-地中海贫血相关基因基础上做的试剂盒相比,漏诊的风险更小。
34.因此,本技术一实施方式提供了一种ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma在用于制备诊断或治疗α-地中海贫血的产品中的应用。
35.基于上述,本技术一实施方式还提供了一种治疗α-地中海贫血的药物,该药物包括6ma抑制剂,6ma抑制剂能够抑制ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma。破骨细胞是来自造血单核细胞-巨噬细胞谱系的多核细胞,而且破骨细胞具有调控造血作用。上述治疗α-地中海贫血的药物通过6ma抑制剂抑制ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma水平,使得破骨细胞诱导分化通路中的上述基因的6ma水平得到校正,从而使得破骨细胞能够实现造血调控,改善α-地中海贫血症状。
36.在一些实施例中,上述治疗α-地中海贫血的药物还包括药学上可接受的辅料。可选地,药学上可接受的辅料满足美国药典(usp)、欧洲药典(ep)、英国药典和/或国际药典的标准。
37.在一些实施例中,药学上可接受的辅料包括溶剂、稳定剂、填充剂、粘合剂、崩解剂、润滑剂、增溶剂、ph调节剂及渗透压调节剂中的一种。
38.在其中一个实施例中,稳定剂选自焦亚硫酸钠、亚硫酸氢钠、维生素c、半胱氨酸、抗坏血酸钠盐、异抗坏血酸钠盐、l-半胱氨酸盐酸盐和依地酸盐至少一种。
39.在其中一个实施例中,填充剂选自微晶纤维素、乳糖、淀粉、预交化淀粉、甘露醇和山梨醇中的至少一种。
40.在其中一个实施例中,崩解剂选自羧甲基淀粉钠、低取代羟丙基纤维素、交联聚乙烯比咯烷酮、交联羧甲基纤维素纳和干淀粉中的至少一种。
41.在其中一个实施例中,粘合剂选自羟丙纤维素、甲基纤维素、乙基纤维素、聚维酮和交联聚维酮中的至少一种。
42.在其中一个实施例中,润滑剂选自硬脂酸镁、滑石粉、微粉硅胶和富马酸硬脂酸钠中的至少一种。
43.在其中一个实施例中,增溶剂选自乙醇、异丙醇、丙二醇、聚乙二醇、泊洛沙姆、卵磷脂和羟丙基-β-环糊精中的至少一种。
44.在其中一个实施例中,ph调节剂选自柠檬酸盐、磷酸盐、碳酸盐、醋酸盐、盐酸和氢氧化物中的至少一种。
45.在其中一个实施例中,渗透压调节剂选自氯化钠、甘露醇、葡萄糖、磷酸盐、柠檬酸
盐和醋酸盐中的至少一种。
46.在一些实施例中,上述治疗α-地中海贫血的药物为干粉剂、注射针剂、干混悬剂、胶囊剂或片剂。可以理解的是,在其他实施例中,上述治疗α-地中海贫血的药物的剂型不限于上述。
47.基于上述,本技术一实施方式还提供了一种α-地中海贫血的诊断试剂盒,该诊断试剂盒包括用于检测ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma水平的检测试剂。上述α-地中海贫血的诊断试剂盒通过检测ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma水平的检测试剂,检测待测样本和正常样本中ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的6ma水平,从而判断待测样本是否为α-地中海贫血样本。
48.可选地,上述各基因的6ma水平的检测方法为高通量测序法、比色法以及液相色谱质谱联用法(lc-ms)。可以理解的是,用于检测上述各基因的检测试剂与检测方法对应。进一步地,上述各基因的6ma水平的检测方法为merip-seq、miclip-seq、scarlet或lc-ms/ms。
49.在一些实施例中,检测试剂包括6ma抗体和用于扩增ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的引物对。6ma抗体用于与dna片段上的6ma结合。通过扩增ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因的引物对分别扩增ifngr1基因、tgfbr1基因、oscar基因、trem2基因、sqstm1基因、map3k7ip2基因、map3k14基因和p38基因,然后再利用6ma抗体检测各基因的6ma水平。
50.在其中一个实施例中,用于扩增ifngr1基因的引物对的核苷酸序列如seq id no:1~seq id no:2所示;用于扩增tgfbr1基因的引物对的核苷酸序列如seq id no:3~seq id no:4所示;用于扩增oscar基因的引物对的核苷酸序列如seq id no:5~seq id no:6所示;用于扩增trem2基因的引物对的核苷酸序列如seq id no:7~seq id no:8所示;用于扩增sqstm1基因的引物对的核苷酸序列如seq id no:9~seq id no:10所示;用于扩增map3k7ip2基因的引物对的核苷酸序列如seq id no:11~seq id no:12所示;用于扩增map3k14基因的引物对的核苷酸序列如seq id no:13~seq id no:14所示;用于扩增p38基因的引物对的核苷酸序列如seq id no:15~seq id no:16所示。
51.具体地,如seq id no:1所示的核苷酸序列为:5
’‑
ccgactctttggccataatat-3’;如seq id no:2所示的核苷酸序列为:5
’‑
tgcaacttagctgatctc-3’;如seq id no:3所示的核苷酸序列为:5
’‑
cacagagaccacagacaaagt-3’;如seq id no:4所示的核苷酸序列为:5
’‑
ctgttgactgagttgcgataa-3’;如seq id no:5所示的核苷酸序列为:5
’‑
tggccattatagtccccccag-3’;如seq id no:6所示的核苷酸序列为:5
’‑
ggtctgagggaggaggtactg-3’;如seq id no:7所示的核苷酸序列为:5
’‑
ctctccggctgctcatcttac-3’;如seq id no:8所示的核苷酸序列为:5
’‑
tccaggagaagcagtgttcag-3’;如seq id no:9所示的核苷酸序列为:5
’‑
gacatcttccgaatctacatt-3’;如seq id no:10所示的核苷酸序列为:5
’‑
ccgatgtcatagttcttggtc-3’;如seq id no:11所示的核苷酸序列为:5
’‑
ggacagaagagatgagtacta-3’;如seq id no:12所示的核苷酸序列为:5
’‑
gagaagatacagggccatttg-3’;如seq id no:13所示的核苷酸序列为:5
’‑
ggatgagcacaagcctgggag-3’;如seq id no:14所示的核苷酸序列为:5
’‑
cccgtctttggtga-3’;如seq id no:15所示的核苷酸序列为:5
’‑
aatggctgaaatgacaaacaa-3’;如seq id no:16所示的核苷酸序列为:5
’‑
aattaagcatttaggccagtg-3’。
52.在一些实施例中,采用单重pcr分别扩增上述各基因。
53.在一些实施例中,上述诊断试剂盒还包括dna提取试剂、pcr扩增试剂、阴性对照品、阳性对照品和缓冲剂中的至少一种。dna提取试剂用于提取待测样本中的dna;pcr扩增试剂用于pcr扩增。
54.在一些实施例中,dna提取试剂包括裂解液和dna纯化剂。
55.具体实施例
56.以下结合具体实施例进行详细说明。以下实施例如未特殊说明,则不包括除不可避免的杂质外的其他组分。实施例中采用试剂和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,按照常规条件,例如文献、书本中所述的条件或者生产厂家推荐的方法实现。
57.实施例1
58.本实例20例研究样本均来源于中国人民解放军第一八一医院,其中10名α-地中海贫血患者和10名健康志愿者,年龄为28~44岁。α-地中海贫血患者是经地中海贫血基因芯片技术检测确诊为
ɑ-地中海贫血患者。排除标准为:1)患有原发性高血压、过敏性疾病、癌症或其他并发症者;2)妊娠者;3)服用激素治疗或者有放疗史的患者。实验组和正常对照组均在种族、性别、年龄上匹配。本研究经过医院伦理委员会批准,且所有受试者自愿签署知情同意书。
59.1.dna样本制备
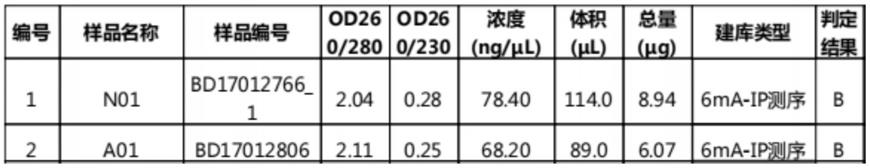
60.实验将10个α-地中海贫血患者的外周血取等量混合的样本作为α-地贫组,编号为a01,将10个健康志愿者的外周血取等量混合后的样本作为正常对照组,编号为n01。用dna提取试剂盒分别提取两组样本的dna。采用nanodrop 2000微量分光光度计检测纯度(od260/280=1.8~2.0);qubit荧光光度计检测浓度(≧1ng/μl);琼脂糖凝胶电泳(胶浓度1%、电压120v、时间45min)检测dna完整性(100~500bp),结果见表1和图1。图1中,m1为maker,1为a01,2为n01。
61.表1
[0062][0063]
由图1和表1可知,两组样本的dna质量符合建库和测序要求(判定结果为b类以上即可)。
[0064]
2.建库和测序
[0065]
(1)将各组提取的dna用te缓冲液分别稀释至150ng/μl,经超声裂解为200bp~400bp的片段,进行3’端修复,添加测序接头。然后95℃变性,冰上冷却。
[0066]
(2)各组裂解后的dna样本均取其中一部分dna作为比对(input),另一部分dna加入以500μl ip缓冲液稀释的6-ma抗体进行免疫共沉淀(ip),然后置于4℃孵育6h。在此期间,将蛋白a磁珠以ip缓冲液冲洗2遍,加入1%牛血清白蛋白(bsa)在4℃封闭6h后,再次用ip缓冲液冲洗2遍,加入到上述dna-抗体混合物,4℃摇床过夜孵育。
[0067]
(3)分离磁珠后,用ip缓冲液冲洗2遍,每次于4℃下用100μl洗脱液1h,洗脱2次。两次的洗脱液合并,加入20μl醋酸钠溶液(3mol/l,ph5.3),500μl无水乙醇,0.5μl甘油溶液(20ng/μl),-80℃冷冻过夜,4℃14000g离心20min,取沉淀物以7μl去离子水溶解,pcr扩增循环,ampure磁珠纯化,以重悬缓冲液重悬,共得到地贫组6ma-ip、地贫组6mainput、正常组6ma-ip、正常组6ma-input,共4份dna文库。
[0068]
(4)4份dna文库质控合格后,采用illumina测序。
[0069]
3.数据分析
[0070]
(1)对原始数据过滤和对比。
[0071]
illumina测序结果经casava软件进行碱基识别后转化为原始测序序列。其结果以fastq文件格式存,包含存储碱基序列以及其对应的测序质量信息。通过phred(phred score,qphred)数值预测碱基发生错误概率,q-score》30,碱基正确识别率达99.9%,从而实验reads碱基的质量。采用bowtie 2(v2.1.0:clean readsbowtie2-x genome.fa-u single.fq-s sample.sam-n1)将clean reads进行对比,得到基因上的定位信息。
[0072]
采用meme和dreme软件检测最富集的前1000个peak序列中显著的motif序列,检测最为可能的motif,寻找模式为每一个motif在每条序列至多出现一次,并且允许motif出现在其互补链上。
[0073]
(2)统计6ma-ipseq测序reads在全基因组的分布
[0074]
macs软件基于已定义的分析模型扫描全基因组的6ma富集区域(peaks),可以预测peaks的位置、序列等。对预测出来的peaks,采用poisson分布模型,利用比对的reads计算每个潜在区域的p-value。当p-value《1e-5时,认为此区域是一个peaks。p-value越小显著性越大。peaks数目用-log10(q-value)计算,取-log10(q-value)大于20。最后将测得的有差异甲基化位点所在的相关基因导入david基因功能分析,对所得结果在ncbi上进行相关比对。利用基因本体(go)分析对甲基化明显差异的基因分别进行分子功能、生物学过程、细胞组分富集;kegg进行信号通路分析,将分析结果进行fisher检验,选择差异有统计学意义(p<0.05)的基因。
[0075]
(3)在染色体分布
[0076]
对获得的peak在染色体上的分布进行统计和展示,定位到各条染色体上的peaks数目及定位分布情况可以反应出蛋白质结合位点的分布情况。
[0077]
(4)在功能元件分布
[0078]
根据peaks在基因组上位置进行定位:包括基因上游2k、5-utr、外显子、内含子、3-utr、下游2k和基因间区。设定优先级:上游2k》5-utr》外显子》内含子》3-utr》下游2k》基因间区,并满足overlap的长度占peak长度的50%及以上,统计每个区域内的peaks占总peaks的百分比。使用软件及参数(版本v2.17.0):bedtools intersect-wao-f 0.5-a peaksbed-b elementbed。
[0079]
(5)生物信息学分析
[0080]
利用david数据库(https://david.ncifcrf.gov/home.jsp)进行富集分析:基因本体(go)分析对甲基化明显差异的基因分别进行分子功能、生物学过程、细胞组分富集;kegg进行信号通路分析,将分析结果进行fisher检验,选择差异有统计学意义(p<0.05)的基因。
[0081]
4.结果及分析
[0082]
(1)6ma-ipseq结果分析
[0083]
本实施例应用n6-甲基腺嘌呤免疫共沉淀测序技术检测α-地中海贫血患者(a01)和健康志愿者(nc)的外周血样本,将未经免疫共沉淀的dna用来作为参考内参,所以在reads结果中包含a01ip(共沉淀),a01input(未共沉淀),ncip(共沉淀)和ncinput(未共沉淀)等四组数据。将本次实验原始数据过滤与比对后,q-score》30,碱基正确识别率达99.9%以上,说明本次实验获得高质量的reads碱基,见表2,图2。图2中,横坐标为所在位置上的测序读数,纵坐标为phred score评分。通过phred(phred score,qphred)数值预测碱基发生错误概率,q-score》30,碱基正确识别率达99.9%,从而保证本次实验reads碱基的高质量。
[0084]
表2
[0085][0086][0087]
peaks是6ma的分布热点(peaks),根据peaks数目用-log10(q-value)计算。图3为peaks显著程度分布图,横轴表示-log10qvalue分布,纵轴表示peaks数及其百分比;图4为a01和n01两个样品中相关基因文氏图。由图3和图4可知,本实施例共测得a01ip组41346个6ma热点(peaks)的-log10(qvalue)大于20(见图3)。与n01ip中6ma热点相比较,a01ip组包含了1194个基因6ma水平上调,3824个基因6ma水平下调(见图4)。
[0088]
图5为富集热点(peaks)在基因功能元件上分布情况。图5的纵坐标为基因数;横坐标为各基因功能元件。由图5可知,6ma的热点(peaks)主要分布在基因上游2k、5-utr、外显子、内含子、3-utr、下游2k和基因间区,其中大多数特异位点位于内含子上,但总体分布6ma水平较正常组低。
[0089]
图6为染色体上peaks的分布图,横坐标为peak在染色体上的坐标(单位为mb),纵坐标为染色体,每条竖线代表一个峰。由图6可知,定位到各条染色体上的peaks数目及定位分布情况可以反应出蛋白质结合位点的分布情况。结果显示,正常组染色体chr1、chr2、chr3、chr4、chr5、chr6、chr7、chrx等染色体peaks较多。
[0090]
(2)差异基因go富集分析
[0091]
α-地贫组(a01)和正常组(n01)甲基化基因go分析结果如图7所示,其中包括生物过程、分子功能和细胞组成三方面;富集气泡结果如图8所示。由图7和图8可知,6ma上调基因主要富集在为正调控新陈代谢过程、正调控大分子代谢过程和正调控转录。
[0092]
6ma表达水平变化显著的基因所参与的生物过程如表3所示。由表3可知,6ma表达水平变化显著的基因所参与的生物过程包括dna模板、正调控rna代谢作用、正向调控rna生物合成过程、等生物过程。
[0093]
表3
[0094][0095]
注:q-vuale为多重检验校正的p值。
[0096]
6ma表达水平变化显著的基因所涉及的分子功能如表4所示。由表4可知,上调基因主要富集分子功能为γ-干扰素受体活化;下调基因参与离子结合、金属离子结合、阳离子结合、转录酶活化等分子功能。
[0097]
表4
[0098][0099][0100]
注:q-vuale为多重检验校正的p值。
[0101]
总之,go分析结果显示,差异基因主要涉及正调控代谢过程(包括大分子代谢、rna代谢)、转录的正调控dna模板、生物合成过程。
[0102]
(3)kegg信号通路富集分析
[0103]
kegg信号通路富集分析结果如图9和图10所示。
[0104]
由图9可知,破骨细胞诱导分化是富集倍数最高也是唯一具有显著性的通路。由图10可知,ifngr1、tgfbr1、oscar、trem2、sqstm1、map3k7ip2、map3k14和p38这9个基因与破骨细胞诱导分化密切相关。
[0105]
综上,本实施例的地贫组6ma热点41346个,其中大多数热点位于内含子上,其中1194个基因6ma水平上调,3824个基因6ma水平下调。go和kegg富集结果显示,差异基因主要涉及dna的复制、合成以及rna转录等生物过程;而破骨细胞诱导分化是唯一条具有显著性富集(p《0.05,fold-rich=6)的通路,此通路包括tgfbr1、ifngr1、trem2、sqstm1、map3k7ip2、map3k14、p38、oscar和trem2上调基因。由此说明了破骨细胞分化通路相关信号基因的6ma表达异常与地中海贫血的发生或发展有密切的联系,通过校正这些基因的6ma表达可以有效治疗地中海贫血。
[0106]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0107]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1